Навигация
2. ПОЛУЧЕНИЕ МАГНИЯ.
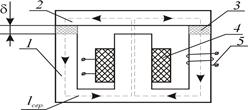
Преобладающий промышленный способ получения магния - электролиз расплава смеси MgCl2
![]() MgCl2 Mg2+ 2Cl-
MgCl2 Mg2+ 2Cl-
![]()
![]() К -) А +)
К -) А +)
![]()
![]()
![]() Mg2++2e Mg0 2Cl--2e Cl20
Mg2++2e Mg0 2Cl--2e Cl20
![]() ЭЛ-3
ЭЛ-3
![]() 2MgCl2 2Mg + 2Cl2
2MgCl2 2Mg + 2Cl2
расплава
в безводных MgCl2, KCl, NaCl. Для получения расплава используют обезвоженный карналлит или бимофит, а также MgCl2, полученный хлорированием MgO или как отход при производстве Ti.
Температура электролиза 700-720 оС, аноды графитовые, катоды стальные. Содержание MgCl2 в расплаве 5-8 %, при снижении концентрации до 4 % уменьшается выход магния по току, при повышении концентрации MgCl2 выше 8 % увеличивается расход электроэнергии. Для обеспечения оптимального содержания MgCl2 периодически отбирают часть отработанного электролита и добавляют свежий карналлит или MgCl2. Жидкий магний всплывает на поверхность электролита, откуда его отбирают вакуумным ковшом. Извлекаемый магниевый сырец содержит 0,1% примесей. Для очистки от неметаллических примесей магний переплавляют с флюсами - хлоридами или фторидами K,Ba,Na,Mg. Глубокую очистку осуществляют перегонкой в вакууме, зонной плавкой, электролитическим рафинированием. В результате получают магний чистотой 99,999 %.
![]()
![]() Кроме магния при электролизе получают также Cl2. В термических способах получения магния сырьем служит магнезит или доломит,
из которых прокаливанием получают MgO. 2Mg+O2=2MgO. В реторных или вращающих печах с графитовыми или угольными нагревателями оксид восстанавливают до металла кремнием (силиконотермический способ) или CaC2
(карбидотермический способ) при 1280-1300 оС, либо углеродом (карботермический способ) при темпратуре выше 2100 оС. В
карботермическом способе (MgO+C Mg+CO) образующуяся смесь CO и паров магния быстро охлаждают при выходе из печи инертным газом для предотвращения обратной реакции с магнием.
Кроме магния при электролизе получают также Cl2. В термических способах получения магния сырьем служит магнезит или доломит,
из которых прокаливанием получают MgO. 2Mg+O2=2MgO. В реторных или вращающих печах с графитовыми или угольными нагревателями оксид восстанавливают до металла кремнием (силиконотермический способ) или CaC2
(карбидотермический способ) при 1280-1300 оС, либо углеродом (карботермический способ) при темпратуре выше 2100 оС. В
карботермическом способе (MgO+C Mg+CO) образующуяся смесь CO и паров магния быстро охлаждают при выходе из печи инертным газом для предотвращения обратной реакции с магнием.
3. СВОЙСТВА МАГНИЯ.
3.1. Физические свойства магния.
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния. Плавится магний при темпратуре 651 оС, но в обычных условиях расплавить его довольно трудно: нагретый на воздухе до 550 оС он вспыхивает и мгновенно сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при комнатной температуре. При горении магния выделяется большое количество ультрафиолетовых лучей и тепла - чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г магния.
Магний расположен в главной подгрупп второй группы периодической системы элементов Д.И. Менделеева. Порядковый номер его - 12, атомный вес - 24,312. Электронная конфигурация атома магния в невозбужденном состоянии 1S22S2P63S2; валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность II. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации; поэтому магний в химическом отношении очень активен.
На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. Нормальный электронный потенциал магния в кислой среде равен -2,37в, в щелочной - 2,69в. В разбавленных кислотах магний растворяется уже на холоде. Во фтористоводородной кислоте нерастворим вследствие образования пленки из труднорастворимого в воде фторида MgF2; в концентрированной серной кислоте почти нерастворим. Магний легко растворяется при действии растворов солей аммония. Растворы щелочей на него не действуют. Магний поступает в лаборатории в виде порошка или лент. Если поджечь магниевю ленту, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру. Магниевые вспышки применяют в фотографии, в изготовлении осветительных ракет. Температура кипения магния 1107 оС, плотность = 1,74 г/см3, радиус атома 1,60 НМ.
Похожие работы
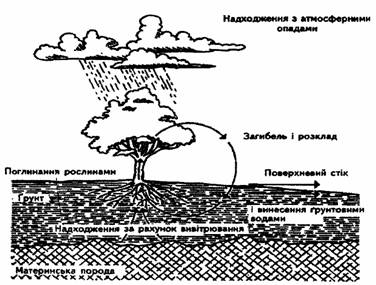
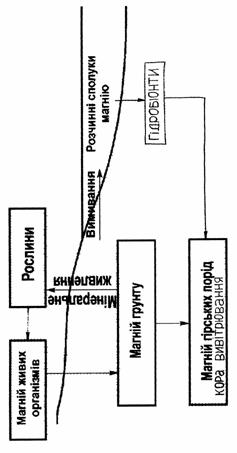
... його, якщо необхідно, і виводять будь-які надлишки, тому і нестача, і надлишок магнію в організмі - явище достатньо рідкісне, але коли таке трапляється, виникають дуже небезпечні захворювання. III. Схема біогеохімічного циклу магнію. Кругообіг макроелементів. Калій, кальцій, натрій і магній не зв'язані з органічними сполуками хімічно, хоча вони містяться у великих кількостях у клітинних і позакл ...
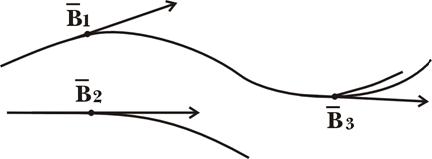
... тного поля в точці на осі колового провідника радіусом R на відстані d від центра колового провідника дорівнює: . Аналогічно обчислюється індукція магнітного поля, створена іншими провідниками з струмом. 2. ЗАКОН ПОВНОГО СТРУМУ ТА ЙОГО ВИКОРИСТАННЯ ДЛЯ РОЗРАХУНКУ МАГНІТНИХ ПОЛІВ. ВИХРОВИЙ ХАРАКТЕР МАГНІТНОГО ПОЛЯ У електростатиці було встановлено, що робота при переміщенні одиничного ...
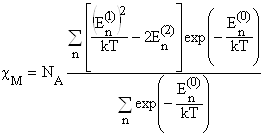
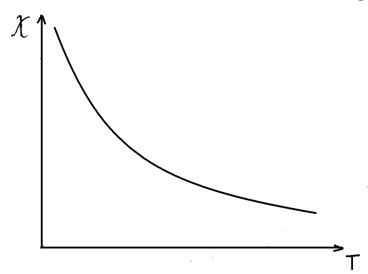
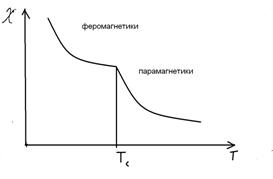
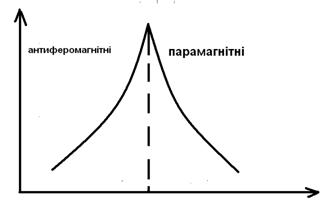
... вираз для макроскопічної магнітної сприйнятливості з урахуванням больцманівського розподілу ансамблю магнітних моментів по енергетичних рівнях приймає вигляд: Це і є рівняння Ван-Флека – основне в магнетохімії, пов’язуюче магнітні властивості з будовою молекул. Тут NA – число Авогадро, k – постійна Больцмана. З деякими крайніми випадками його ми вже зустрічалися вище. Якщо Е(0) = 0, а Е(2) ...
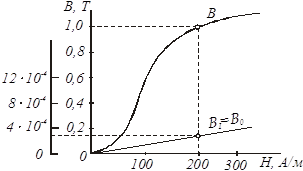
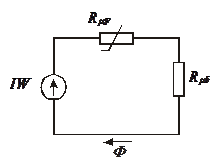
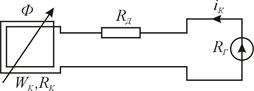
... І = const при вимірюванні. 5.3 Програма роботи 1. Вивчити будову та принципи дії мілівеберметра і мілітесламетра. 2. Вивчити лабораторну установку дослідження характеристик Ш-подібного електромагніта. 3. Експериментальним шляхом зняти вебер-амперну характеристику електромагніта . На підставі експериментальних даних провести необхідні розрахунки і побудувати криву намагнічування B = f(H) і ...
0 комментариев