Генетика как наука оформилась 100 лет назад, после вторичного открытия законов Менделя. Ее бурное развитие ознаменовалось в последние годы расшифровкой нуклеотидного состава ДНК генома многих десятков видов. Возникли новые ветви знаний — геномика, молекулярная палеогенетика. В начале 2001 г. в рамках дорогостоящей 10-летней международной программы объявлено о принципиальной расшифровке генома человека. Эти достижения, пожалуй, можно сравнить с выходом человека в космос и высадкой на Луну.
Генетическая инженерия и биотехнология сильно изменили облик науки. Вот любопытный эпизод, уже попавший в новейшую сводку: “После 1998 года началась беспрецедентная гонка между 1100 учеными мирового сообщества проекта “Геном человека” и частной акционерной фирмой “Celera Genomics”” [1]. Фирма надеялась первой прийти к финишу и извлекать выгоду от патентования фрагментов ДНК человека. Но пока победил принцип: “Что создано природой и Богом, не может патентоваться человеком”.
Мог ли представить такую фантасмагорическую картину Грегор Мендель, неспешно проводя год за годом свои опыты в тиши монастырского садика? В какой степени она трансформирует естественное саморазвитие науки? Действительно ли тотальный анализ ДНК геномов снимает все покровы? Упования, что Буратино уже нашел заветный золотой ключик от потайной двери, столкнулись с непредвиденной реальностью и парадоксами. У человека лишь 3% ДНК генома кодируют белки, и, возможно, еще 20—25% участвуют в регуляции действия генов. Какова же функция, и есть ли она у остальной части ДНК? Гены в геноме порой сравнивают с небольшими островами в море неактивных и, возможно, “мусорных” последовательностей. ДНК-гонка порой напоминает присказку: “принеси то, не знаю что”.
Возражения скептиков отнюдь не сняты. Ведь при тотальном секвенировании номинация (применю модный термин) определенного отрезка ДНК в “ранг гена” проводится лишь на основе сугубо формальных критериев (знаков генетической пунктуации, необходимых для транскрипции). Роль, время и место действия большинства “генов-номинантов” пока совершенно неясны.
Но есть и другая проблема. Под геномом надо понимать всю наследственную систему, включая не только структуру определенного набора ДНК элементов, но и характер связей между ними, который определяет ход онтогенеза в конкретных условиях среды. Налицо системная триада: элементы, связи между ними и свойства целостности. Отсюда следует важный вывод: знание структуры генов на уровне ДНК — необходимо, но вовсе недостаточно для описания генома. Мы лишь на пороге постижения динамического способа организации и неканонических форм наследования [2, 3].
Неожиданно в конце ХХ в. вопрос о том, каковы границы и спектр наследственной изменчивости, вышел за рамки чисто академических дискуссий. Сначала в Англии, а потом и в Германии пришлось забивать скот из-за нейродегенеративной аномалии, способной передаваться людям с мясом больных животных. Инфекционным агентом оказались не ДНК или РНК, а белки, названные прионами (от англ. prions — protein infectious particles — белковые инфекционные частицы).
Впервые с их необычным проявлением исследователи столкнулись еще в 60-е годы. Но тогда этот феномен пытались истолковать в рамках классических представлений, полагая, что это “медленные вирусные инфекции” животных или особый тип супрессорных мутаций у дрожжей. Теперь выясняется, “феномен прионов не является экзотикой, характерной для млекопитающих, а скорее — частным случаем общебиологического механизма” динамического наследования [4]. Вероятно, центральную догму молекулярной генетики придется дополнить с учетом возможности внутри- и межвидовой передачи по типу инфекций [5].
В начале 80-х годов классик молекулярной биологии и генетики Р.Б.Хесин выделил три формы неканонической наследственной изменчивости: неслучайные упорядоченные изменения в локусах и участках хромосом, состоящих из повторов ДНК; изменение и наследование свойств цитоплазмы; эпигенетическое наследование локальных и общих изменений упаковки хроматина. Затем добавились мобильные гены, поведение которых привело к проблеме непостоянства геномов [6].
Цель этой статьи — показать, что разные формы неменделевского наследования не исключение, а следствие более общих представлений об организации генома. Наследственные изменения отнюдь не сводятся только к мутациям [7].
Андре Львов и роль его открытия
По удивительному совпадению в один и тот же 1953 г. появились две статьи, определившие лицо современной генетики: открытие двойной спирали ДНК Дж.Уотсоном и Ф.Криком и концепция профага и лизогении бактерий А.Львова (1902—1994), которая, на мой взгляд, имеет сейчас для биологии, медицины и генетики не меньшее значение, чем двойная спираль ДНК.
Львов установил, что фаг может встраиваться в хромосому бактерии и передаваться в ряду многих поколений как обычный бактериальный ген. В таком состоянии у фага работает лишь ген-репрессор, который блокирует работу всех остальных его локусов. Бактерия, включившая фаг в свой геном, называется лизогенной, а встроенный фаг — профагом. Такая лизогенная бактерия защищена от заражения другими фагами. Под действием ультрафиолета или изменений внутренней среды клетки репрессор инактивируется, блокада снимается, и фаг размножается, вызывая гибель клетки. Теперь даже трудно представить, сколь революционным было это открытие.
Андре Львов — выходец из России, его родители эмигрировали во Францию в конце XIX в. Образ матери ученого Марии Симинович навсегда запечатлен на полотне художника В.Серова “Девушка, освещенная солнцем” (1888). Мария Яковлевна Львова-Симинович дожила до 90 лет. За несколько недель до второй мировой войны она передала в Третьяковскую галерею письма и рисунки В.Серова [9]. Отец Львова был знаком с Мечниковым и водил сына к нему в Институт Пастера. Так через века и страны тянутся и переплетаются нити культуры. За свою долгую жизнь А.Львов работал последовательно как протозоолог, бактериолог, биохимик, генетик и, наконец, как вирусолог. В Институте Пастера он патронировал и Ж.Моно, и Ф.Жакобу, разделивших с мэтром Нобелевскую премию 1965 г. за открытие оперона.
Уже с 20-х годов были известны штаммы бактерий, которые якобы несут фаги в скрытом состоянии и время от времени вызывают лизис клеток. Однако открыватель бактериофагии Ф.Д'Эррель смотрел на фаг только как на летальный для клетки агент, не допуская мысли о его скрытом состоянии. Это мнение разделял сначала и классик молекулярной генетики М.Дельбрюк. Дело в том, что он и его коллеги в США работали с так называемыми Т-фагами, которые неспособны встраиваться в хромосому бактерий. В силу “демона авторитетов” лизогенией с 20-х годов скрупулезно не занимались. Пионер этих работ, блестящий микробиолог из Института Пастера, Эжен Вольман был схвачен немцами как еврей во время оккупации Парижа и погиб.
После войны Львов возобновил в Пастеровском институте исследования скрытого фагоносительства. В 1953 г. он создал стройную концепцию профага, сразу же осознав ее значение для вирусной теории рака и ряда вирусных патологий у человека. Его ясная схема феномена лизогении до сих пор приводится во всех сводках по молекулярной генетике.
В 1958 г. Ф.Жакоб и Элиас Вольман (сын Эжена Вольмана) ввели термин “эписома” для элементов, способных существовать либо в свободном, либо интегрированном в геном хозяина состоянии. К эписомам они отнесли умеренные фаги, половой фактор бактерий, факторы колициногенности, с помощью которых одни штаммы бактерий убивают другие бактерии. В замечательной книге “Пол и генетика бактерий”, написанной в 1961 г. (и уже на следующий год вышедшей стараниями известного генетика С.И.Алиханяна в русском переводе), авторы предвидели существование эписомоподобных элементов и у высших организмов, прозорливо указывая на “контролирующие элементы”, открытые Б.Мак-Клинток в начале 50-х годов (Нобелевская премия по физиологии и медицине 1983 г.). Однако в то время они не предполагали, сколь глубока эта аналогия. После открытия в начале 70-х годов инсерционных мутаций, вызванных включением вирусной ДНК в клеточный геном бактерий, появилась возможность выстроить эволюционный ряд двусторонних переходов: инсерционные сегменты“транспозоны“плазмиды“фаги.
Сходные ряды перевоплощений найдены и у эвкариот. У дрозофилы мобильные элементы семейства gypsy (“цыган”) могут существовать в виде встроенных в хромосому копий; находиться в виде их полных или уменьшенных кольцевых или линейных плазмид в цитоплазме; наконец, в случае отдельных “разрешающих” мутаций в геноме хозяина способны одеться оболочкой, стать настоящими инфекционными ретровирусами и заражать посторонних хозяев через корм. Сходство Р-транспозонов у дрозофилы и эндогенного ретровируса ВИЧ у человека (табл.) позволяет предсказывать возможные эволюционно-генетические события в популяциях человека, судьбу неизбежных сейчас и в будущем его контактов с чужими геномами.

Принцип факультативности и обобщенная концепция генома
Многие факты изменчивости, связанной с мобильными элементами, не укладываются в представления о мутациях как о локализованных изменениях структуры, числа или расположения генных локусов. Дабы совместить данные классической и “подвижной” генетики, я в 1985 г. предложил естественную классификацию элементов генома, включающую две подсистемы: облигатные (гены и их регуляторные области в хромосомах) и факультативные элементы (ДНК- и РНК-носители, число и топография которых варьирует в разных клетках или организмах одного вида) [8].
Из этой классификации вытекают важные следствия, позволяющие осмыслить или сформулировать многие необычные факты из области наследственной изменчивости. Назовем некоторые из них:
универсальность факультативности. Нет видовых геномов, которые состоят лишь из облигатных элементов, как нет живых организмов, состоящих лишь из скелетного остова;
генетическая неидентичность дочерних клеток. В силу случайности они различаются по числу и составу цитоплазматических факультативных элементов. Соотношение фракций облигатных и факультативных элементов ДНК – относительно устойчивый видовой признак. Имея сходное число генных локусов, близкие виды могут отличаться по количеству ДНК в 2—5 и более раз, наращивая блоки повторов и меняя их геномную топографию. Между облигатной и факультативной частями генома непрерывно наблюдаются разные переходы. Самые очевидные примеры — мутации генов за счет внедрения (инсерций) мобильных элементов или умножение числа (амплификация) сегментов хромосом и переход их в разные внутри- и внехромосомные состояния;
характерный тип наследственной изменчивости для каждой из двух подсистем генома. Моргановские мутации легко соотносятся с облигатным компонентом. Разнообразные наследственные изменения в числе и топографии факультативных элементов я предложил называть “вариациями” (как в музыке — вариации на заданную тему). Мутации, согласно классическим представлениям, происходят, как правило, случайно, с низкой частотой у отдельных особей. Характер вариаций совсем иной — здесь возможны массовые, упорядоченные изменения под действием самых разных, в том числе слабых немутагенных факторов (температуры, пищевого режима и т.д.);
двухэтапный характер большинства природных наследственных изменений. Сначала активизируются факультативные элементы как наиболее чувствительные к изменениям среды. Затем начинают опосредованно поражаться и генные локусы. К такому выводу мы пришли в ходе многолетних наблюдений за вспышками мутаций в природе. Большинство их оказалось нестабильными и были вызваны инсерциями мобильных элементов, которые таинственным образом время от времени активируются в природе. У дрозофилы около 70% мутаций, возникших в природе или лаборатории спонтанно, связано с перемещениями мобильных элементов.
Мак-Клинток впервые сделала заключение, что активация факультативных элементов и последующая структурная реорганизация генома могут быть следствием адаптивного ответа клетки на стресс [9]. Наследственная система, активируя факультативные элементы, осуществляет генетический поиск, переходя к новому адаптивному уровню функционирования. Так, многолетние исследования Л.З.Кайданова показали, что после длительного инбридинга в линиях дрозофил вдруг за одно-два поколения происходят множественные кооперативные перемещения подвижных генов и сайт-специфичные перестройки хромосом; при этом одновременно резко повышается выживаемость.
Обобщенное представление о геноме как ансамбле облигатных и факультативных элементов расширяет и понятие “горизонтальный перенос”, включающий не только интеграцию чужеродных генов в хромосомы ядра. О горизонтальном переносе можно говорить уже и в случаях создания устойчивой ассоциации двух генетических систем, в которой появляются новые признаки и свойства.
Функциональная факультативность генома
Наследственные изменения возникают в результате ошибок процессов, оперирующих с наследственным материалом любых живых организмов, — репликации, транскрипции, трансляции, а также репарации и рекомбинации.
Факультативность репликации означает возможность относительно автономной гипер- или гипорепликации отдельных участков ДНК, независимо от плановой закономерной репликации всей геномной ДНК в ходе деления клетки. Такими свойствами обладают участки хромосом с повторами, блоки гетерохроматина. При этом автономная репликация приводит к умножению числа отдельных сегментов и имеет, как правило, адаптивный характер.
Факультативность транскрипции состоит в возможности появления разных мРНК с одной и той же матрицы за счет присутствия в данном локусе более одного промотора и альтернативного сплайсинга. Эта ситуация нормальна для множества генов.
Неоднозначность (по терминологии С.Г.Инге-Вечтомова) трансляции проявляется в разных вариантах опознания одного и того же кодона, например стоп-кодона или кодона для включения определенной аминокислоты в синтезируемый белок. Такая трансляция зависит от физиологических условий в клетке и от генотипа.
Согласно теории мутационного процесса М.Е.Лобашева, возникновение мутации связано со способностью клетки и ее наследственных структур к репарации повреждений. Отсюда следует, что появлению мутации предшествует состояние, когда повреждение либо полностью обратимо, либо может реализоваться в виде мутации, понимаемой как “нетождественная репарация”. К началу 70-х годов выяснилось, что стабильность ДНК в клетке не имманентное свойство самих молекул ДНК, — оно поддерживается особой ферментативной системой.
С середины 70-х годов стала проясняться эволюционная роль “ошибок рекомбинации” как индуктора наследственных изменений, причем гораздо более мощного, чем ошибки репликации ДНК.
На молекулярном уровне различают три варианта рекомбинации: общую, сайт-специфичную и репликативную. Для первой, общей, регулярной рекомбинации (кроссинговер) репарация включают разрывы в цепи ДНК, их сшивку и восстановление. Для нее необходимы длинные районы гомологии ДНК. Сайт-специфичная рекомбинация довольствуется короткими, в несколько оснований, участками гомологии, какие, к примеру, имеют ДНК фага l и хромосома бактерии. Аналогично происходит включение в геном мобильных элементов и соматическая локальная рекомбинация в онтогенезе между иммуноглобулиновыми генами, создающая их поразительное разнообразие.
Ошибки общей рекомбинации можно рассматривать как закономерные следствия линейно протяженной структуры генов. Возникает дилемма, о которой писал Хесин: можно считать, что митотические рекомбинации — особый тип мутагенеза или, напротив, некоторые виды мутаций (хромосомные аберрации) — результат “ошибок” митотических рекомбинаций.
Если перемещения мобильных элементов или рекомбинация участков запрограммированы в онтогенезе, классифицировать такие наследственные изменения трудно. Трансформацию пола у дрожжей долгое время считали мутационным событием, но оказалось, что на определенной стадии развития аскоспор она происходит с высокой вероятностью в результате сайт-специфичной рекомбинации.
Вариации генома в ответ на вызов среды
В теории эволюции и в генетике всегда обсуждался вопрос о связи наследственных изменений с направлением отбора. Согласно дарвиновским и постдарвиновским представлениям, наследственные изменения происходят в разных направлениях и лишь затем подхватываются отбором. Особенно наглядным и убедительным оказался метод реплик, изобретенный в начале 50-х годов супругами Ледерберг. С помощью бархатной материи они получали точные копии — отпечатки — опытного посева бактерий на чашке Петри. Затем на одной из чашек вели отбор на устойчивость к фагу и сопоставляли топографию точек появления устойчивых бактерий на чашке с фагом и в контроле. Расположение устойчивых к фагу колоний было одинаковым в двух чашках-репликах. Такой же результат получили и при анализе положительных мутаций у бактерий, дефектных по какому-либо метаболиту.
Открытия в области подвижной генетики показали, что клетка как целостная система в ходе отбора может адаптивно перестраивать свой геном. Она способна ответить на вызов среды активным генетическим поиском, а не пассивно ждать случайного возникновения мутации, позволяющей выжить. А в опытах супругов Ледерберг у клеток не было выбора: либо смерть, либо адаптивная мутация.
В тех же случаях, когда фактор отбора не летален, возможны постепенные перестройки генома, прямо или косвенно связанные с условиями отбора. Это выяснилось с открытием в конце 70-х годов постепенного умножения числа локусов, в которых расположены гены устойчивости к селективному агенту, блокирующему деление клеток. Известно, что метотрексат — ингибитор клеточного деления — широко применяется в медицине для остановки роста злокачественных клеток. Этот клеточный яд инактивирует фермент дигидрофолатредуктазу (ДГФР), работу которого контролирует определенный ген.
Рассмотрим, как в ходе подобного отбора менялся геном у одноклеточного паразитического жгутиконосца лейшмании Leishmania tropica, вызывающего кожные язвы и передающегося человеку москитами от грызунов. До начала опытов ген устойчивости был в геноме лейшмании в одной дозе. В результате отбора число генов устойчивости увеличилось (амплифицировалось). Что же наблюдали при разных вариантах отбора?
Устойчивость клеток лейшмании к яду-цитостатику (метотрексат) возрастала ступенчато, и пропорционально увеличивалась доля амплифицированных сегментов с геном устойчивости. Умножался не только селектируемый ген, но и большие прилежащие к нему участки ДНК, названные ампликонами. Когда устойчивость к яду у лейшмании повысилась в 1000 раз, амплифицированные внехромосомные сегменты составили до 10% ДНК в клетке! Можно сказать, что из одного облигатного гена образовался пул факультативных элементов. Произошла адаптивная перестройка генома в ходе отбора.
Если отбор продолжался достаточно долго, часть ампликонов встраивалась в исходную хромосому, и после прекращения отбора устойчиво сохранялась повышенная устойчивость.
С удалением из среды селективного агента число ампликонов с геном устойчивости постепенно снижалось в ряду поколений и одновременно падала устойчивость. Тем самым был смоделирован феномен длительных модификаций, когда массовые изменения, вызванные средой, наследуются, но постепенно угасают в ряду поколений.
При повторном отборе часть сохранившихся в цитоплазме ампликонов обеспечивала быструю их автономную репликацию, и устойчивость возникала гораздо быстрее, чем в начале опытов. Иными словами, формировалась своеобразная клеточная ампликонная память о прошедшем отборе на основе сохранившихся ампликонов.
Если сопоставить метод реплик и ход отбора на устойчивость в случае амплификации, то оказывается, что именно контакт с селективным фактором вызвал преобразование генома, характер которого коррелировал с интенсивностью и направлением отбора.
Дискуссия об адаптивных мутациях
В 1988 г. в журнале “Nature” появилась статья Дж.Кэйрнса с соавторами о возникновении у бактерии E.coli отборзависимых “направленных мутаций”. Брали бактерии, несущие мутации в гене lacZ лактозного оперона, неспособные расщеплять дисахарид лактозу. Но эти мутанты могли делиться на среде с глюкозой, откуда их через один—два дня роста переносили на селективную среду с лактозой. Отобрав lac+ реверсов, которые, как и ожидалось, возникли еще в ходе “глюкозных” делений, нерастущие клетки оставляли в условиях углеводного голодания. Сначала мутанты отмирали. Но спустя неделю и более наблюдался новый рост за счет вспышки реверсий именно в гене lacZ. Как будто клетки в условиях жесткого стресса, не делясь (!), вели генетический поиск и адаптивно меняли свой геном [10].
В последующих работах Б.Холла использовались бактерии, мутантные по гену утилизации триптофана (trp). Их помещали на среду, лишенную триптофана, и оценивали частоту реверсий к норме, которая повышалась именно при триптофановом голодании. Но причиной этого феномена были не сами условия голодания, ибо на среде с голоданием по цистеину частота реверсий к trp+ не отличалась от нормы.
В следующей серии опытов Холл взял уже двойных недостаточных по триптофану мутантов, несущих одновременно мутации в генах trpA и trpВ, и вновь поместил бактерии на среду, лишенную триптофана. Выжить могли только особи, у которых реверсии возникали одновременно в двух триптофановых генах. Частота появления таких особей была в 100 млн раз выше, чем ожидалось при простом вероятностном совпадении мутаций в двух генах. Холл предпочел называть этот феномен “адаптивные мутации” и впоследствии показал, что они возникают и у дрожжей, т.е. у эвкариот [11].
Публикации Кэйрнса и Холла немедленно вызвали бурную дискуссию. Итогом ее первого раунда стало выступление одного из ведущих исследователей в области подвижной генетики Дж.Шапиро. Он кратко обсудил две основные идеи. Во-первых, клетка содержит биохимические комплексы, или системы “естественной генетической инженерии”, которые способны реконструировать геном. Активность этих комплексов, как и любая клеточная функция, может резко меняться в зависимости от физиологии клетки. Во-вторых, частота возникновения наследственных изменений всегда оценивается не для одной клетки, а для клеточной популяции, в которой клетки могут обмениваться между собой наследственной информацией. Кроме того, межклеточный горизонтальный перенос с помощью вирусов или передачи сегментов ДНК усиливается в стрессовых условиях. Как считает Шапиро, эти два механизма объясняют феномен адаптивных мутаций и возвращают его в русло обычной молекулярной генетики [11]. Каковы же, на его взгляд, итоги дискуссии? “Мы нашли там генетического инженера с впечатляющим набором замысловатых молекулярных инструментов для реорганизации ДНК-молекулы” [12].
За последние десятилетия на уровне клетки открыта такая непредвиденная сфера сложности и координации, которая более совместима с компьютерной технологией, нежели с механизированным подходом, доминировавшим во время создания неодарвинистского современного синтеза. Вслед за Шапиро, можно назвать по крайней мере четыре группы открытий, изменивших понимание клеточных биологических процессов.
Организация генома. У эвкариот генетические локусы устроены по модульному принципу, представляя собой конструкции из регуляторных и кодирующих модулей, общих для всего генома. Это обеспечивает быструю сборку новых конструкций и регуляцию генных ансамблей. Локусы организованы в иерархические сети, во главе с главным геном-переключателем (как в случае регуляции пола или развития глаза). Причем многие из соподчиненных генов интегрированы в разные сети: они функционируют в разные периоды развития и влияют на множество признаков фенотипа.
Репаративные возможности клетки. Клетки вовсе не пассивные жертвы случайных физико-химических воздействий, поскольку в них имеется система репараций на уровне репликации, транскрипции и трансляции.
Мобильные генетические элементы и природная генетическая инженерия. Работа иммунной системы построена на непрерывном конструировании новых вариантов молекул иммуноглобулинов на основе действия природных биотехнологических систем (ферменты: нуклеазы, лигазы, обратные транскриптазы, полимеразы и т.д.). Эти же системы используют мобильные элементы для создания новых наследуемых структур. При этом генетические изменения могут быть массовыми и упорядоченными. Реорганизация генома — один из основных биологических процессов. Природные генноинженерные системы регулируются системами с обратной связью. До поры до времени они пребывают в неактивном состоянии, но в ключевые периоды или во время стресса приводятся в действие.
Клеточный информационный процессинг. Возможно, одно из самых важных открытий в области биологии клетки состоит в том, что клетка непрерывно собирает и анализирует информацию о своем внутреннем состоянии и внешней среде, принимая решение о росте, движении и дифференциации. Особенно показательны механизмы контроля клеточного деления, лежащие в основе роста и развития. Процесс митоза универсален у высших организмов и включает три последовательных этапа: подготовка к делению, репликация хромосом и завершение деления клетки. Анализ генного контроля этих фаз привел к открытию особых точек, в которых клетка проверяет, произошла ли репарация нарушений в структуре ДНК на предыдущем этапе или нет. Если ошибки не будут исправлены, последующий этап не начнется. Когда же ликвидировать повреждения нельзя, запускается генетически запрограммированная система клеточной смерти, или апоптоза.
В условиях вызова среды клетка действует целенаправленно, подобно компьютеру, когда при его запуске шаг за шагом проверяется нормальная работа основных программ, и в случае неисправности работа компьютера останавливается. В целом становится очевидной, уже на уровне клетки, правота нетрадиционного французского зоолога-эволюциониста Поля Грассэ: “Жить — значит реагировать, а отнюдь не быть жертвой”.
Пути возникновения естественных наследственных изменений в системе среда—факультативные элементы—облигатные элементы. Факультативные элементы первыми воспринимают немутагенные факторы среды, а возникающие затем вариации вызывают мутации. На поведение факультативных элементов влияют и облигатные элементы.
Неканонические наследственные изменения, возникающие под влиянием отбора к цитостатикам и приводящие к амплификации генов.
Приобретенные признаки наследуются
“История биологии не знает более выразительного примера многовекового обсуждения проблемы, чем дискуссия о наследовании или о ненаследовании приобретенных признаков”, - эти слова стоят в начале книги известного цитолога и историка биологии Л.Я.Бляхера [12]. В истории, пожалуй, можно вспомнить аналогичную ситуацию с попытками превращения химических элементов. Алхимики верили в эту возможность, но в химии утвердился постулат о неизменности химических элементов. Однако ныне в ядерной физике и химии исследования по превращению элементов и анализ их эволюции - дело обычное. Кто же оказался прав в многовековом споре? Можно сказать, что на уровне химических молекулярных взаимодействий не происходит превращения элементов, а на ядерном уровне оно - правило.
Напрашивается сходная аналогия и с вопросом о наследовании признаков, которые появились в ходе онтогенеза. Если вновь возникающие наследственные изменения сводить лишь к мутациям генов и хромосом, тогда вопрос можно считать закрытым. Но если исходить из обобщенной концепции генома, включая представление о динамической наследственности [2, 3], проблема нуждается в пересмотре. Помимо мутационной существует вариационная и эпигенетическая формы наследственной изменчивости, связанные не с изменениями в тексте ДНК, а в состоянии гена. Такие эффекты обратимы и наследуемы.
Интересно, что вышедший в конце 1991 г. Международный ежегодник по генетике открывается статьей О.Ландмана “Наследование приобретенных признаков” [13]. Автор суммирует уже давно полученные в генетике факты, показывая, что “наследование приобретенных признаков вполне совместимо с современной концепцией молекулярной генетики”. Ландман детально рассматривает около десяти экспериментальных систем, в которых установлено наследование приобретенных признаков. Четыре разных механизма способны привести к нему: изменение структур клеточной оболочки, или кортекса, изученное Т. Соннеборном у инфузорий; ДНК-модификации, т.е. клонально передаваемые изменения в характере локального метилирования ДНК (сюда входит феномен импринтинга); эпигенетические изменения без каких-либо модификаций ДНК; индуцированная утрата либо приобретение факультативных элементов.
Статья Ландмана делает нас как бы свидетелями критического периода смены постулата в генетике, казавшегося неколебимым как скала. Автор спокойно, без ажиотажа и новых сногсшибательных фактов, объединяет старые и новые данные в систему, дает им ясное современное истолкование. Можно сформулировать общий принцип: наследование приобретенных признаков возможно в тех случаях, когда некий фенотипический признак зависит от числа или топографии факультативных элементов.
Приведу два поучительных примера на дрозофиле: первый связан с поведением вируса сигма, второй - мобильных элементов, ответственных за гибридную стерильность самок и сверхмутабильность.
Изучение взаимодействия вируса сигма с геномом дрозофилы началось более 60 лет назад. Сначала в 1937 г. французский генетик Ф.Леритье обнаружил резкие наследственные отличия у разных линий мух по степени чувствительности к углекислому газу (СО2). Признак наследовался причудливым образом: через цитоплазму, но не только по материнской линии, а иногда и через самцов. Чувствительность можно было передать и путем инъекции гемолимфы, причем разным видам дрозофил. В этих случаях признак передавался не стабильно, но в результате отбора наследование становилось устойчивым.
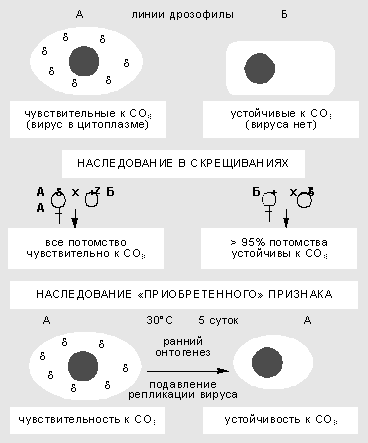
Неменделевское наследование признака у дрозофилы, который зависит от популяции факультативных элементов генома. Признак чувствительности к СО2 вызван присутствием в цитоплазме мухи рабдовируса сигма. В результате температурного шока на ранней стадии развития дрозофилы блокируется размножение вируса, и выросшие особи приобретают устойчивость к нему.
Чувствительность к СО2 оказалась связана с устойчивым размножением в половых и соматических клетках РНК-содержащего пулевидного рабдовируса сигма, сходного по ряду свойств с вирусом бешенства у млекопитающих. Оогонии (клетки, из которых в ходе мейоза и созревания образуются яйцеклетки) у самок стабилизированной линии обычно содержат 10-40 вирусных частиц, а ооциты (зрелые яйцеклетки) - 1-10 млн. Вирус сигма - типичный факультативный элемент. Мутации в его геноме приводят к сложным формам поведения системы. Найдены случаи вирусоносительства, при которых дрозофилы остаются устойчивы к СО2, но вместе с тем иммунны к заражению другими штаммами вируса. Ситуация вполне сравнима с поведением системы фаг-бактерия, что сразу заметили Ф.Жакоб и Э.Вольман.
Взаимоотношения генома дрозофилы и размножающегося в ее цитоплазме вируса подчиняются правилам внутриклеточной генетики. Воздействия в ходе онтогенеза могут вызвать сдвиг в числе и межклеточной топографии частиц и как результат - изменить степень чувствительности к углекислому газу. Так, повышенная температура блокирует репликацию вирусных частиц. Если самок и самцов в период гаметогенеза содержать несколько дней при температуре 30°С, потомство от таких мух будет свободно от вируса и устойчиво к СО2. Значит, приобретенный в ходе индивидуального развития признак наследуется в ряду поколений.
Ситуация с вирусом сигма не единична. Французские генетики изучали факторы стерильности самок, связанные с поведением мобильных элементов типа “I”. Наследование этого признака определяется сложными ядерно-цитоплазматическими взаимодействиями. Если в отцовских хромосомах локализованы активные I-элементы, то на фоне R-цитоплазмы они начинают активироваться, претерпевают множественные транспозиции и в результате вызывают резкие нарушения онтогенеза в потомстве самок с чувствительной цитоплазмой. Такие самки откладывают яйца, но часть эмбрионов гибнет на ранней стадии дробления - еще до образования бластомеры. Линии, выделенные из природных популяций, отличаются по силе действия I-факторов и степени реактивности (или чувствительности) цитоплазмы. Эти показатели можно изменить внешним влиянием. Возраст исходных родительских самок, а также воздействие в ранний период развития повышенной температуры отражаются не только на плодовитости выросших самок, но и на плодовитости их потомства. Вызванные условиями среды изменения реактивности цитоплазмы поддерживаются на протяжении многих клеточных поколений. “Самое замечательное, что эти изменения реактивности цитоплазмы под влиянием негенетических факторов наследуются: наблюдается наследование “благоприобретенных” признаков”, - отмечал Р.Б.Хесин [5].
Наследование через цитоплазму: от бабушек до внуков
В теории развития и феногенетике ХХ в. важное место занимают глубокие и совершенно оригинальные исследования эмбриолога П.Г.Светлова (1892-1972). Остановимся на разработанной им теории квантованности онтогенеза (наличии критических периодов в развитии, когда происходит детерминация морфогенетических процессов и одновременно повышается чувствительность клеток к повреждающим агентам) и на развитой в связи с этим идее, что изучение онтогенеза надо вести не с момента оплодотворения и образования зиготы, а еще с гаметогенеза, включающего оогенез у самок предшествующего поколения - проэмбрионального периода.
На основании этих постулатов Светлов провел в 60-е годы простые и ясные опыты на дрозофиле и мышах. Он убедительно показал, что возможно стойкое неменделевское наследование свойств цитоплазмы, а модификации в выраженности мутантных признаков, возникшие после кратковременного внешнего воздействия в критический период развития организма, тоже передаются в ряду поколений [14].
В одной из серий опытов он сравнивал степень проявления мутантного признака в потомстве двух линий мышей, гетерозиготных по рецессивной мутации микрофтальмии (уменьшенный размер сетчатки и глаз с момента рождения): нормальных по фенотипу гетерозигот, у которых мутантными были матери, и тех, у которых мутантны отцы. Потомство от мутантной бабушки отличалось более сильным проявлением признака. Светлов объяснял этот странный факт тем, что женские гаметы гетерозиготных самок находились еще в теле их мутантных матерей и испытывали с их стороны влияние, которое усилило мутации у внуков.
По существу Светлов установил явление, впоследствии получившее название “геномный импринтинг” - различие в выраженности гена в зависимости от того, пришел он к потомству от матери или от отца. Работы эти, увы, остались недооцененными.
Интересно, что еще в конце 80-х годов импринтинг, как остроумно заметил К.Сапиенца, исследователь этого феномена, было “принято считать генетическим курьезом, затрагивающим лишь очень немногие признаки. Меня неоднократно спрашивали, почему я попросту трачу свое время на столь незначительное явление” [15]. Большинство исследователей безоговорочно принимали одно из главных положений Менделя - “зачаток”, или ген, не может менять свои потенции в зависимости от пола, на чем основано повсеместно наблюдаемое расщепление 3:1. Но Сапиенца совершенно справедливо заметил, что при анализе менделевского расщепления обычно рассматривают только наличие или отсутствие признака, а если он количественный, то границу есть-нет устанавливают по принятому порогу. Если же выявить, какова степень проявления признака, обнаружится влияние геномного импринтинга.
Именно таков был подход Светлова, когда он тщательно изучал, как меняется выраженность признаков у потомства в зависимости от материнского генотипа. Как эмбриолог он видел общность наследственных и особых ненаследственных изменений - фенокопий (имитирующих мутации), если затрагивается один и тот же морфогенетический аппарат, ответственный за осуществление данного признака.
Впервые на разных видах животных (дрозофилах и мышах) Светлов показал возможность наследования через мейоз измененного характера проявления мутантного гена. Недаром эти работы Хесин в своей сводке назвал замечательными [16].
Кратковременное (20 мин) прогревание тела восьмидневного мышонка самки вызывало стойкие изменения ооцитов, ослаблявшие действие вредной мутации у внуков! “Передача улучшения развития глаз, наблюдаемая в опытах с нагреванием, может быть объяснена только передачей свойств, приобретенных ооцитами нагретых самок по наследству” [16]. Этот феномен Светлов связывал с особенностями формирования и строения яйцеклетки у животных, ибо “в ооците имеется как бы каркас, отражающий наиболее общие черты архитектоники строящегося организма”. Для профилактики нарушений развития у человека он обосновал необходимость изучения критических периодов гаметогенеза, в которых повышена чувствительность к повреждениям. Возможно, в патогенезе аномалий развития у человека этап формирования гамет даже более важен, чем эмбриогенез.
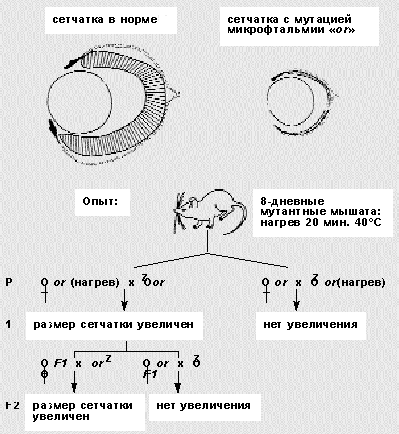
Схема опытов П.Г.Светлова, демонстрирующих передачу в ряду поколений мышей мутации - микрофтальмии. Однократное 20-минутное действие повышенной температуры на мутантных восьмидневных мышат влечет улучшение развития глаз у их потомков (F1 и F2). Этот признак наследуется только по материнской линии и связан с изменением в ооцитах.
Сегодня этот вывод подтвержден молекулярно-генетическими исследованиями последнего десятилетия [17]. У дрозофилы установлены три системы материнских генов, которые формируют осевую и полярную гетерогенность цитоплазмы и градиенты распределения биологически активных генных продуктов. Задолго до начала оплодотворения происходит молекулярная детерминация (предопределение) плана строения и начальных этапов развития. В формировании ооцита большую роль играют генопродукты клеток материнского организма. В некотором смысле это можно сравнить с откармливанием матки в улье группой рабочих пчел.
У человека первичные половые клетки, из которых потом возникают яйцеклетки-гаметы, начинают обособляться у двухмесячного эмбриона. В возрасте 2.5 месяца они вступают в мейоз, но сразу после рождения это деление блокируется. Оно возобновляется через 14-15 лет с началом полового созревания, когда яйцеклетки раз в месяц выходят из фолликул. Но в конце второго деления мейоз снова останавливается и его блокировка снимается только при встрече со спермием. Таким образом, женский мейоз начинается в 2.5 месяца и заканчивается лишь через 20-30 и более лет, сразу после оплодотворения.
Зигота на стадии двух-восьми клеток имеет ослабленный геномный иммунитет. При изучении нестабильных инсерционных мутаций в природных популяциях дрозофилы мы обнаружили, что активация мобильного элемента, сопровождаемая мутационным переходом, происходит часто уже в первых делениях зиготы или в первых делениях первичных половых клеток. В итоге одно мутантное событие захватывает сразу клон первичных половых клеток, пул гамет становится мозаичным, и наследственные изменения в потомстве возникают пучками или кластерами, имитируя семейное наследование.
Эти эксперименты весьма важны для эпидемиологии, когда возникает вопрос о степени влияния той или иной вирусной эпидемии на генофонд потомства. Начатые еще в начале 60-х годов пионерные исследования С.М.Гершензона и Ю.Н.Александрова привели к выводу, что ДНК- и РНК-содержащие вирусы и их нуклеиновые кислоты - мощные мутагенные агенты. Попадая в клетку, они провоцируют геномный стресс, активируют систему мобильных элементов хозяина и вызывают нестабильные инсерционные мутации в группе избранных локусов, специфичных для каждого агента.
Теперь представим, что мы хотим оценить влияние на наследственную изменчивость у человека какой-либо вирусной пандемии (например, гриппа). При этом можно ожидать, что частота разного рода аномалий развития будет повышена в первом поколении у потомства, родившегося в год или спустя год после эпидемии. Оценку же частоты мутационных и вариационных изменений в половых клетках (гаметах) следует проводить во внучатом поколении.
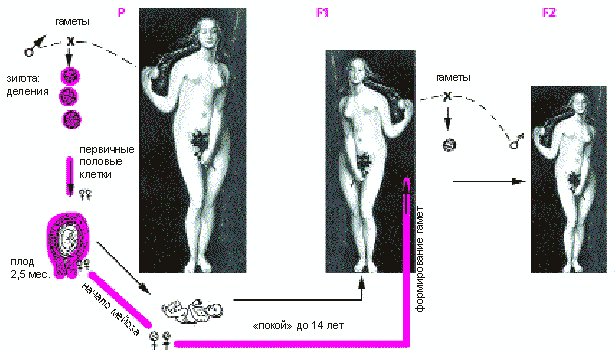
Схема оогенеза в трех последовательных женских поколениях. P - бабушка, F1 - мама, F2 - дочь.
Общий вывод состоит в том, что наследственная изменчивость у внуков может весьма зависеть от условий, в которых происходил оогенез у их бабушек! Представим женщину, которой в 2000 г. было около 25 лет, а матерью она станет в третьем тысячелетии. Оплодотворенная яйцеклетка, из которой она сама появилась на свет, начала формироваться в то время, когда ее мать была еще двухмесячным эмбрионом, т.е. где-то в середине 50-х годов ХХ в. И если в эти годы свирепствовал грипп, то его последствия должны сказаться через поколение. Для оценки последствий глобальной эпидемии на генофонд человечества надо сравнивать внучатое потомство трех групп, или когорт, - тех, у которых бабушки были беременны в год, когда разразилась эпидемия, с теми, чьи бабушки забеременели до и после пандемии (это две контрольные когорты). К сожалению, такие важные для охраны здоровья эпидемиолого-генетические сведения пока отсутствуют.
О призраках и борьбе с чудовищами
Прошло 30 лет после опытов Светлова, несложных по технике, но оригинальных по замыслу и глубоких по своим выводам. В середине 90-х годов произошел психологический перелом: резко возросло число работ в области наследственной изменчивости, в названии которых стоит слово “эпигенетический”.
Разного рода эпимутации (наследственные вариации в характере генной активности, не связанные с изменениями в тексте ДНК и носящие массовый, направленный и обратимый характер) перешли из разряда маргинальных в активно изучаемое явление. Стало очевидно, что живые системы обладают оперативной “памятью”, которая находится в непрерывном контакте со средой и использует средства природной эмбриогенетической инженерии для быстрого наследуемого перехода из одного режима функционирования в другой. Живые системы не пассивные жертвы естественного отбора, а все эволюционные формы жизни вовсе не “помарка за короткий выморочный день”, как писал Мандельштам в своем известном шедевре “Ламарк”.
Оказалось, что эпимутации сплошь и рядом можно обнаружить у обычных “классических генов”, надо только подобрать пригодную экспериментальную систему. Еще в 1906 г., за пять лет до того как Морган стал работать с дрозофилой, французский биолог-эволюционист Л.Кэно открыл у мышей менделевскую мутацию “желтое тело”. Она обладала удивительной особенностью - доминантностью по отношению к нормальной окраске (серо-коричневой) и летальностью в гомозиготе. При скрещивании гетерозиготных желтых по цвету мышей друг с другом из-за гибели гомозигот нормальные мыши появлялись в потомстве в соотношении не 3:1, а 2:1. Впоследствии оказалось, что так ведут себя многие доминантные мутации у разных организмов.
Выяснилось, что в области транскрипции одного из аллелей гена “желтое тело” внедрен мобильный элемент, напоминающий по структуре и свойствам ретровирус. В результате такой вставки ген стал подчиняться знакам пунктуации своего незваного гостя и непредсказуемо активироваться “в ненужное время и в ненужном месте”. У мутантов с инсерциями (вставками) возникают множественные дефекты (желтая окраска меха, ожирение, диабет и др.), а поведение становится нестабильным. Ненужная активность вставки в той или иной степени гасится в разных тканях за счет обратимой модификации или метилирования оснований ДНК. На уровне фенотипа проявление доминантного аллеля сильно колеблется и носит мозаичный характер. Австралийские генетики обнаружили, что у отобранных из гомогенной линии желтых самок в потомстве было больше желтых мышей, а фенотип отца -носителя мутации - не влияет на изменение окраски у потомства. Самки оказались более инерционны, и они, отобранные по фенотипу модификации ДНК, или отпечатки-импринты лучше сохранялись в оогенезе. Другие генетики нашли и чисто материнское влияние, аналогичное обнаруженному в опытах Светлова. В зависимости от диеты беременных самок выраженность мутации “желтое тело” определенным образом менялись в генотипе гетерозигот. Такое измененное состояние нестойко, но наследовалось в потомстве. Степень проявления признака коррелировала со степенью метилирования оснований ДНК во вставке.
Касаясь этих и других подобных опытов, научный обозреватель журнала “Sсience” назвал свою заметку “Был ли все же Ламарк немного прав?” Такая тактичность понятна. Во-первых, осторожность оправдана, когда приходится ревизовать то, что десятилетиями считалось прочно установленным. Во-вторых, наследование приобретенных признаков связывается не только с именем Ламарка, но и с призраком Лысенко (о последнем упоминает автор заметки). Действительно, вольно или невольно тень “мичуринской биологии” всплывает, когда обсуждается проблема наследования приобретенных признаков. И не только в России, где еще так жива память о трагедии в биологии, связанной с господством Лысенко.
Сегодня многие общепринятые положения классической генетики, которые отвергал Лысенко, стали невольно, в пику ему, считаться почти абсолютной истиной. И тем не менее, если тот или иной серьезный исследователь обнаруживал что-либо внешне созвучное взглядам Лысенко, он опасался это обнародовать, боясь остракизма со стороны научного сообщества. И даже если работа публиковалась, она сопровождалась многими оговорками и оставалась на периферии науки.
Познакомившись в 60-е годы со статьями А.А.Любищева (самого близкого друга Светлова), я пытался понять, почему он, будучи одним из самых активных самиздатных критиков лысенкоизма с 1953 по 1965 г. - его статьи и письма были собраны в книге “В защиту науки” (Л., 1990), - тем не менее не считал вопрос о наследовании приобретенных признаков окончательно решенным. Этот всеми признанный знаток эволюционной биологии указывал на незавершенность теории наследственности, на сходство наследственной и модификационной изменчивостей. Теперь мы знаем, как трудно бывает во многих случаях провести между ними границу. Любищев приводил факты массовых, быстрых и упорядоченных преобразований фенотипа в эволюции, явно необъяснимых с позиций моргановских мутаций и дарвиновского отбора. Возвысив свой голос против монополии Лысенко, Любищев выступал в защиту науки как таковой, против утвердившегося в ней аракчеевского режима. В сфере же самой науки он следовал древнему принципу: “Платон мне друг, но истина дороже”. И поэтому не скрывал своих несогласий со многими генетиками и дарвинистами. Да, Любищев оказался прав, древо жизни куда сложнее самонадеянных рассуждений.
Литература
1. Баранов В.С. и др. Геном человека и гены предрасположенности. СПб., 2000.
2. Голубовский М.Д., Чураев Р.Н. Динамическая наследственность // Природа. 1997. №4. С.16—25.
3. Чураев Р.Н. Об одной неканоническкой теории наследственности // Совр. концепции эволюц. генетики. Новосибирск, 2000. С.22—32.
4. Инге-Вечтомов С.Г. Прионы дрожжей и центральная догма молекулярной биологии // Вестн. РАН. 2000. 70(4). С.299—306.
5. Chernov Yu.O. // Mutation Res. 2001. V.488. P.39—64.
6. Хесин Р.Б. Непостоянство геномов. М., 1984.
7. Голубовский М.Д. Век генетики: эволюция идей и понятий. СПб., 2001.
8. Голубовский М.Д. // Успехи соврем. биологии. 1985. Т.100. Вып.6. С.323—339.
9. McClintock B. // Science. 1984. V.226. P.792—801.
10. Cairns J. // Nature. 1988. V.27. P.1—6.
11. Hall D. // Genetics. 1990. V.126. P.5—16
12. Shapiro J. // Science. 1995. V.268. P.373—374.
12. Бляхер Л. Я. Проблема наследования приобретенных признаков. М., 1971.
13. Landman O. // Ann. Rev.Genet. 1991. V.25. P.1-20.
14. Соколова К.Б. Развитие феногенетики в первой половине ХХ века. М., 1998.
15. Сапиенца К. // В мире науки. 1990. ?12. С.14-20.
16. Светлов П. Г. // Генетика. 1966. ?5. С.66-82.
17. Корочкин Л. И. Введение в генетику развития. М., 1999.
Похожие работы
... живые организмы-и удивительное многообразие генов, кодирующих эти белки. В геноме каждого человека есть какие-то области, определяющие его индивидуальность. Некоторые гены человека отличаются от генов крысы всего несколько нуклеотидами-знаками генетического кода. Другие гены у них разные, но одинаковые у двух людей. Изменчивость, связанная с существованием генов , подобных генам группы крови у ...
а» *** Большинство гипотез о происхождении и эволюции основывались на признании глубочайшей древности сообществ растений и животных озера Байкал (20-25 млн лет) [Верещагин, 1940; Кожов, 1973 и др.]. Предполагалось, что животные, населяющие открытый Байкал, заселили 10-15 млн лет назад. При похолоданиях погибали только обитатели мелководий, за пределами глубин 2-3 м в течение ледниковых периодов ...
... , что вполне могут стать ключом к волшебному исцелению возрастных заболеваний сердца, но и тем, что их непосредственное использование в медицине выглядит очень притягательно. Специалистами в области клеточных технологий созданы новейшие методики и соответствующие устройства по получению стволовых клеток не только из ткани костного мозга, но и из периферической крови, плаценты, пуповинной крови. ...
... геномах растений, вызываемые с помощью ФПУ-трансформированной человеческой речи, которая резонансно взаимодействует с хромосомной ДНК in vivo [25,29]. Этот результат, осмысленный нами с позиций семиотико-волновой составляющей генетического кода, имеет существенное методологическое значение и для анализа таких суперзнаковых объектов, как тексты ДНК, и для генома в целом. Открываются принципиально ...
0 комментариев