Навигация
Развертку потенциала должны наблюдать на миллиамперметре (блок БВВ)
13. Развертку потенциала должны наблюдать на миллиамперметре (блок БВВ).
14. По окончании работы необходимо произвести выключение потенциостата в следующем порядке:
· тумблер «подъем / сброс» в положении «сброс»
· переключатель на блоке БУ
| Ячейка откл. | / | Ячейка вкл. | - | в положении ячейка откл. |
· выключить тумблер движения диаграммной ленты на КСП.
Снимаются кривые, для получения характеристик, в частности, величины перенапряжения при выделении газа на катоде и аноде. Из полученных экспериментальных данных проводится расчет энергетических и тепловых затрат.
результаты снятия вольт-амперных характеристик.
1. Анод. Электролит Na2SO4 2г/л
2. Катод. Электролит Na2SO4 2г/л
3. Анод. Электролит Na2SO4 2г/л + 0,05 мл масла
4. Анод. Электролит Na2SO4 2г/л + замасливание анода 0,1 мл масла в 10 мл ССl4.
5. Анод. Электролит Na2SO4 2г/л + замасливание анода 0,2 мл масла в 10 мл ССl4.
6. Анод. Электролит Na2SO4 2г/л + замасливание анода 1 мл масла в 10 мл ССl4.
1. Анод. Электролит Na2SO4 2г/л + 0,1 мл ПАВ
2. Анод. Электролит Na2SO4 2г/л + 0,15 мл ПАВ
3. Анод. Электролит Na2SO4 2г/л + 0,5 мл ПАВ
4. Анод. Электролит Na2SO4 2г/л + 1,5 мл ПАВ
5. Анод. Электролит Na2SO4 2г/л + 3 мл ПАВ
6. Катод. Электролит Na2SO4 2г/л + 3 мл ПАВ
7. Анод. Электролит Na2SO4 2г/л + 0,01 мл скипидара
8. Анод. Электролит Na2SO4 2г/л + 0,01 мл скипидара + 0,05мл масла + 3мл ПАВ
9. Анод. Электролит Na2SO4 2г/л + 0,01 мл скипидара + 0,05мл масла + 3мл ПАВ + K2Cr2O7 2 мг/л
Растворы выбирались с учетом компонентов, присутствующих в сточных водах данного машиностроительного предприятия. Сточные воды содержат маслосодержащие компоненты, ПАВ из ванн промывки, скипидар и масло из камеры окраски, K2Cr2O7 из гальванического цеха хроматирования. Так же они были выбраны с максимально приближенными концентрациями, соответствующими концентрациям веществ, находящихся в сточной воде предприятия. В модельных растворах присутствуют компоненты, содержащиеся в сточной воде.
Обсуждение результатов.
За эталон был принят раствор электролита, не содержащий примесей. Как видно из кривых 1 и 2 анодная и катодная поляризация мало отличаются друг от друга, к тому же при электрофлотации с нерастворимыми электродами наиболее важен анодный процесс выделения кислорода, а катодный является только усиливающим, поэтому в дальнейшем мы будем рассматривать только анодные кривые. Кривая 3 (с полностью растворенным маслом) так же не сильно отличается от эталона. При замасливании электродов (кривые 4, 5 и 6) перенапряжение на электроде увеличивается и качество очистки резко уменьшается с повышением замасливания и степень очистки уменьшается, но при добавлении ПАВ (кривые 1., 2., 3., 4. и 5.) эффективность увеличивается, т.к. ПАВ предотвращает замасливание, и степень очистки так же увеличивается. Присутствие растворителя (кривая 7) ухудшает процесс очистки, по сравнению с эталонной кривой, однако как видно на кривой 8, перенапряжение на аноде при совместном присутствии всех, рассматриваемых ранее, компонентов степень очистки достаточно высокая. Как видно из кривой 9, присутствие хрома в сточной воде не вызывается большой степени перенапряжения, и степень очистки при совместном присутствии компонентов достаточно высока.
расчет основного оборудования и основных операций.
Расчет электрофлотатора.
Материальные потоки в электрофлотаторе.
Исходные данные:
I = 50 А - токовая нагрузка на аппарат;
tоэл=25оС – температура электролита;
Вт=98%;
Расстояние между электродами 5 – 10 мм
Экспериментальные данные по составу воды, поступающей в аппарат:
Na2SO4=2000 мг/л, Скипидар=0,01 мг/л, Масло веретенное=5 мг/л, ПАВ «Брулин»=30 мг/л, K2Cr2O7 =0,02 мг/л
рН=8,5
Катодные реакции
H2O→H2 + ОН- - 2ē
Анодные реакции2H2O→O2+4H++4ē
Определение расхода воды при электрофлотации, GH2O
![]()
где GH2O кг/ч - количество воды, вступившее в электрохимическую реакцию на электроде;
Вт - выход по току, доли единицы;
М = 18 - молекулярная масса воды;
26.8 - количество электричества, равная 1 Р, А-ч;
n = 4, 2 соответственно - количество электронов, участвующих в электрохимической реакции.
G1H2O = 0,0082 кг/ч - количество воды, вступившее в реакцию на аноде.
G2H2O = 0,0165 кг/ч - количество воды, вступившее в реакцию на катоде.
GH2O= G1H2O + G2H2O
GH2O= 0,0247 кг/ч
Определение количества образовавшихся газов
![]()
где ![]() кг/ч- количество образовавшегося водорода,
кг/ч- количество образовавшегося водорода,
МН2 = 2 - молекулярная масса водорода;
n = 2 - количество электронов, участвующих в электрохимической реакции.
![]() = 0,0019 кг/ч
= 0,0019 кг/ч
![]()
где ![]() кг/ч- количество образовавшегося кислорода,
кг/ч- количество образовавшегося кислорода,
МO2 = 32 - молекулярная масса кислорода.
![]() = 0,2195 кг/ч
= 0,2195 кг/ч
Определение количества растворителя (воды), уносимого с газообразными продуктами
а) Определение количества растворителя, уносимого с водородом
![]()
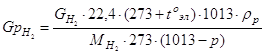
где t0эл = 25 - температура электролита, °С;
22,4 л - объем одного г-моль газа при нормальных условиях;
р = 23,76 мм. рт. ст. = 23,76133 = 3167,2 Па = 31,672 - упругость водяного пара при температуре электролита, гПа;
ρр = 0,02304 - плотность паров растворителя при t0эл, г/л.
![]() = 5,5246 10-4 кг/ч
= 5,5246 10-4 кг/ч
б) Определение количества растворителя, уносимого с кислородом
![]()
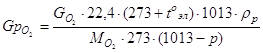
где ![]() - количество образовавшегося кислорода, кг/ч.
- количество образовавшегося кислорода, кг/ч.
![]() = 2,7623 10-4 кг/ч
= 2,7623 10-4 кг/ч
Таким образом суммарный расход воды на электролиз:
![]()
![]() =0,0503 кг/ч
=0,0503 кг/ч
Энергетический баланс электрофлотатора.
Общая формула для расчета напряжения на электрофлотаторе:
(Еа - Ек) + (hа - hк) + DЕконц + DЕдиф + DUэл + DUд + DU1 + DUк ,
где U – напряжение на ячейке электролизера, В
Еа, Ек – термодинамические (обратимые) значения потенциалов анода и катода, В
Еа - Ек = Ет – теоретическое напряжение разложения, В
hа, hк – перенапряжение реакций на аноде и катоде, В
DЕконц – величины концентрационной поляризации на аноде и катоде , В
DЕдиф – диффузионный потенциал между анолитом и католитом (при наличии диафрагмы), В
DUэл – падение напряжения в электролите , В
DUд – падение напряжения в диафрагме, В
DU1 – падение напряжения в электродах и токоподводящих шинах, В
DUк – падение напряжения в контактах, В.
Для данного случая мы исключаем из расчета DЕдиф и DUд в связи с отсутствием диафрагмы. Также мы не рассчитываем DЕконц, так как процесс имеет электрохимическую природу. Величинами DU1 и DUк мы пренебрегаем в связи с малостью их вклада в общую величину напряжения на электрофлотаторе.
Расчет теоретического напряжения разложения, Ет
Расчет проводится по доминирующим реакциям, которые идут с наиболее высокими выходами по току.
на катоде: 2H+ + 2е → H2
на аноде: H2O → 1/2O2+2H+ +2ē
суммарная реакция: H2O → H2 + 1/2О2
В таблице приведены стандартные величины энергии Гиббса (DG0), энтальпии (DН0) и энтропии S° для компонентов и продуктов реакции.
Таблица
| Вещество | H2O | (H+) H2O | Н2(газ) | О2(газ) | |
| Терм. функция | DG0, кДж/моль | -237,531 | 0 | 0 | 0 |
| DН0, кДж/моль | -286,248 | 0 | 0 | 0 | |
| S°, Дж/моль град | 70,040 | 0 | 130,761 | 205,322 |
Теоретическое напряжение разложения реализуется при совершении системой максимально полезной работы. Оно вычисляется из изменения изобарно-изотермического потенциала при протекании реакции.
DG0 = nFЕт = -Амах,
где DG0 – стандартный изобарно-изотермический потенциал электродной реакции (энергия Гиббса),
DG0 = (Dni DG0 i)п – (Dni DG0 i)р,
где DG0 i – энергия Гиббса образования компонентов реакции
ni - стехиометрический коэффициент компонента реакции. Индекс "п" означает продукты реакции; индекс "р" означает реагенты реакции.
Для реакции на катоде:
DG0к= DG0 н2– 2DG0 Н+,
DG0к= 0 кДж/моль
Величина стандартного потенциала на катоде:
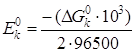 Е0к = 0
Е0к = 0
Для реакции на аноде:
В соответствии с правилом термодинамических расчетов, анодную реакцию следует представить в обратном направлении:
1/2O2+2H+ +2ē → H2O. Тогда DG0а= DG0 Н2О– 1/2DG0 О2– 2DG0 Н+,
DG0а= -237,531 кДж/моль
Величина стандартного потенциала на аноде:
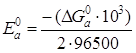 Е0а = 1,231 В
Е0а = 1,231 В
Теоретическое напряжение разложения в стандартных условиях
Е0т = Е0а - Е0к Е0т = 1,231 В
По уравнению Гиббса-Гельмгольца:
Ет = -(DН/nF) + Т(¶Е/¶Т)р,
где ¶Е/¶Т - температурный коэффициент, В/град.
Величина (¶Е/¶Т)р вычислена из следующего уравнения, получающегося из уравнения Гиббса-Гельмгольца:
(¶Е/¶Т)р = DS° /(2×96500), В/град
Вычислим DS°к катодной реакции:
DS°к = DS°Н2 - DS°Н+
DS°к = 130,761 Дж/моль град
Аналогично находим DS°а анодной реакции:
DS°а = DS°Н2О - 1/2DS0О2- 2DS°Н+
DS°а = -32,621 Дж/моль град
Далее находим DS° суммарной реакции и температурный коэффициент
DS° = DS°а - DS°к DS° = -163,328 Дж/моль град
Ет = 1.231 В
Определение перенапряжения на электродах
Перенапряжение возникает вследствие замедленной одной (или нескольких) стадий переноса заряженных частиц через фазовую границу раздела электрод/раствор и описывается теорией замедленного разряда.
hа = fа – Ет,
где fа = 0,9 В. Величина fа определена из поляризационной кривой по кислороду для ОРТА при плотности тока i = 244,14 А/м2.
hа = 0,46 В
hк = fк – Ет,
где fк = 1,0001 В. Величина fк определена из парциальной поляризационной кривой по водороду для стального электрода при плотности тока
i = 244,14 А/м2.
hк = 0,52 В.
Расчет падения напряжения в электролите
Падение напряжения в электролите может быть рассчитано по закону Ома:
DUэл = I∙Rэл, Rэл = ρ∙(1/S)
где I - ток, проходящий через электрофлотатор, А;
Rэл - сопротивление электролита с учетом газонаполнения, Ом;
ρ - удельное сопротивление электролита с учетом газонаполнения, Ом-м;
l = 0,005 м- расстояние между электродами;
S = 0,02 - м2 площадь поверхности электрода. Поскольку на электродах выделяется некоторое количество газов электролит, содержащий газовые пузырьки имеет большее сопротивление, чем без них. Удельное сопротивление, таким образом, зависит от степени газонаполнения и может быть определено как
Ρ = K∙ρ0
где К – коэффициент, учитывающий увеличение сопротивления электролита из-за наличия в нем газовых пузырьков;
ρ0 - удельное сопротивление электролита без газовых пузырьков, причем
ρ0 = 1/к
где к - удельная электропроводность раствора электролита, Ом-1-м-1.
Таким образом DUэл можно рассчитать по формуле:
DUэл = I∙K∙ρ0∙(1/S)
Величину К определим по формуле:
K = 1/ (1-1,78∙Г+Г2)
где Г = 2 % - газонаполнение электролита, принятое для наших условий.
К =1,036
Величину к определим по формуле:
к = α∙с(λо++λо-)1000
где α = 1 - степень электролитической диссоциации Н2SО4
с = 0,01 г-экв/л - концентрация Н2SО4 (вычислено из значения рН=8,5);
λ=λо++λо-- эквивалентная (молекулярная электропроводность), Ом-1 гэкв-1 м2;
λо+ = 0,03368 Ом-1 гэкв-1 м2 - электролитическая подвижность ионов водорода.
На общий коэффициент электропроводности влияет наличие в электролите солей. Принимаем солесодержание раствора 440 мг/л в пересчете на К2SО4. Концентрация СК2SО4 = 0,005 г-экв/л.
λо- = 0,02203 Ом-1 гэкв-1 м2 - электролитическая подвижность ионов SО42-. Таким образом
к = 0,557 Ом-1 м-1
ρ0 =1,795 Ом м
DUэл = I∙K∙ρ0∙(1/S)
DUэл = 2,269 В
Таким образом общее напряжение на электрофлотаторе
U = ET+(ηа – ηк)+ DUэл
U = 3,715 В
Таблица
Баланс напряжений на электрофлотаторе
| Напряжение на клеммах электрофлотатора, В | Составляющие баланса, В | Доля составляющей, % | |
| Определенное экспериментально 4.09 | ET | 1,231 | 33,14 |
| ηа | 0,704 | 18,95 | |
| ηк | 0,489 | -13,16 | |
| DUэл | 2,269 | 61,08 | |
Расход электроэнергии постоянного тока на одну тонну получаемого продукта производится по уравнению:
Wп = U∙I∙(1/Vэл)
где Wп - расход электроэнергии постоянного тока, кВт-ч/м3;
I - токовая нагрузка на электрофлотатор. А;
U - напряжение на электрофлотаторе, В.
Wп = 3,715 кВт-ч/м3
[29]
оборотная вода
КАМЕРА ОКРАСКИ ДВУХСЕКЦИОННАЯ.
Состоит из корпуса камеры, 2х гидрофильтров с вытяжными вентиляторами и центробежными насосами и двумя подъемными кабинами (поз.10).
Гидрофильтр служит для отсасывания воздуха, в котором находится во взвешенном состоянии окрасочная пыль. Работа гидрофильтра заключается в следующем: воздух из рабочей камеры проходит в гидрофильтре через две водяные завесы, создаваемые переливными лотками, увлажняясь, воздух освобождается от окрасочной пыли, проходит через влагоотделитель (поз.8) который предохраняет воздуховод и вентилятор от попадания влаги и выбросов в атмосферу.
Циркуляцию воды в гидрофильтре обеспечивает центробежный насос (поз.2), приводимый во вращение электродвигателем (поз.1). Вода из нижнего бака (поз.13) через вентиль (поз.4.1) подается в распределительные трубы (поз.14) через запорные вентили (поз.3.1, 3.2) верхняя труба служит для заполнения верхнего бака (поз.15) из которой вода, стекая по щиту (поз.16) образует водяную завесу 1ой ступени гидрофильтра. Нижняя распределительная труба с щитами (поз.17) образует водяную завесу 2ой ступени гидрофильтра. Вентиль (поз.6.1) служит для промывки нижней распределительной трубы. Для смены воды, очистки от грязи и осадков, для предупреждения переполнения бака служит система труб слива и перелива (поз.18) с вентилем (поз.5.1)
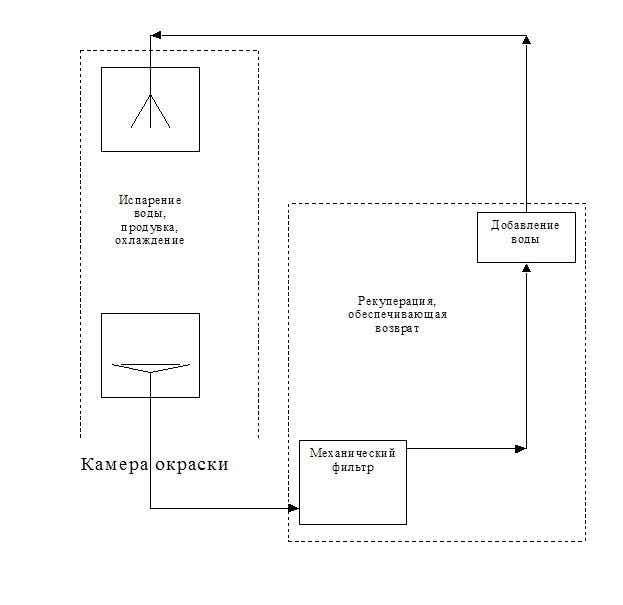
Для обеспечения эффективной работы водяной завесы, после того, как вода попадает в переливной лоток, она проходит рекуперацию, обеспечивающую возврат воды в рабочую камеру водяной завесы. По трубопроводу направляется в механический фильтр. Затем добавляется чистая вода. После чего направляется в камеру завесы. При работе камеры вода насыщается мелкодисперсными частицами краски и растворителя. Не исключено и попадание крупнодисперсных частиц. При распылении и продувке вода испаряется и охлаждается. Затем загрязненная вода собирается в переливном лотке.
Изменение состава воды.
1. Физический процесс – испарение воды.
2. Сорбция компонентов растворителя и органических компонентов краски.
3. Не исключено так же механическое попадание красящих компонентов в занавес.
Необходимо добавление воды, регенерация, оценка повторного испарения воды. Реальное число оборотных циклов будет определено в период опытной эксплуатации.
Расчет оборотна воды в камере окраски.
Данные для расчета:
V= 3м3 - объем камеры водяной завесы;
С0=1,5 г/л – начальная концентрация не выпадающих в осадок растворенных в воде солей;
Сц=15 ;20 г/л – концентрация солей в циркуляционной воде;
Qоб=0,1м3/ч – количество воды, находящейся в обороте;
Сд=С0 – концентрация солей в добавляемой воде;
Расчет производится для нормальных условий (20оС, 760 мм рт. ст.)
Расчет величины испарения и количества добавляемой водыСц=С0+![]()
qд – количество добавляемой в систему воды, компенсирующее испарение
t – время работы системы
![]()
![]()
Ку – коэффициент (степень) упаривания
р1 – величина испарения воды в оборотной системе, выраженная в долях от общего количества воды, находящегося в обороте.
1) Расчет величины испарения и количества добавляемой воды для концентрации циркуляционной воды Сц=15 г/л
Ку=10
![]() л/ч
л/ч
![]()
2) Расчет величины испарения и количества добавляемой воды для концентрации циркуляционной воды Сц=20 г/л
Ку=13,33
![]() л/ч
л/ч
![]()
Расчет продувки системы
![]()
рпр – величина продувки [%]
![]()
qпр – количество воды, выводимое из системы продувкой (унос и продувка).
1) Определение величины продувки системы для концентрации циркуляционной воды Сц=15 г/л
![]()
![]() м3/ч
м3/ч
2) Определение величины продувки системы для концентрации циркуляционной воды Сц=20 г/л
![]()
![]() м3/ч
м3/ч
[30].
выводы.
1. Проанализированы технологические процессы нанесения гальванических покрытий и окраски деталей с точки зрения образования жидких отходов и воздействия на окружающую среду.
2. Обоснована схема обезвреживания и очистки гальванического производства с финишной обработкой на электрофлотаторе, обеспечивающем обработку до ПДС.
3. Выполнен поверочный расчет электрофлотатора с токовой нагрузкой 50 А/ч и определены расходы энергии на обработку 1 куб.м воды.
4. Проведено экспериментальное определение вольт-амперных кривых и получены необходимые данные для расчета энергетического баланса электрофлотатора. Проведена оценка влияния присутствия компонентов на электрохимические показатели работы электрофлотатора.
Похожие работы
... схем «ухода» от налогов. Такие налоговые разработки, не направленные на уравнивание возможностей налогоплательщиков по использованию схем минимизации, исключающие тиражирование примененных методик, представляют особую ценность для развития бизнеса. 8 Труды молодых ученых № 1, 2008 Таким образом, общие принципы налоговой оптимизации можно сформулировать следующим образом: - законность, ...
... , солнечное освещение увеличивает производительность труда в среднем на 10%, а искусственное на 13%, при этом возможность брака снижается на 20-25%. 4. Техника безопасности при монтаже, эксплуатации, наладке и ремонте проектируемого объекта. При выполнении монтажных работ и ремонтных работ необходимо соблюдать требования СНиП и ССБТ, а также согласовывать все работы с действующими стандартами, ...
щения, и требования к физическим, химическим и биологическим факторам внешней среды, а также к электрической и пожарной безопасности. Основные требования к учету факторов рабочей среды заключаются в том, что они при их комплексном воздействии на человека не должны оказывать отрицательного влияния на его здоровье при профессиональной деятельности в течении длительного времени, и кроме того, не ...
... отраженного лазерного излучения. Баллоны как правило имеют темную окраску и шероховатую поверхность, что способствует высокой степени поглощения инфракрасного и других излучений. Меры по обеспечению безопасности при работе с сосудами, работающими под давлением: Каждый сосуд, работающий под давлением, находится на специальной платформе препятствующей опрокидыванию баллона. Все газопроводы ...
0 комментариев