Навигация
Клеточная инженерия. Получают гибридные антибиотики, например, с новыми комбинациями агликона и Сахаров
4. Клеточная инженерия. Получают гибридные антибиотики, например, с новыми комбинациями агликона и Сахаров.
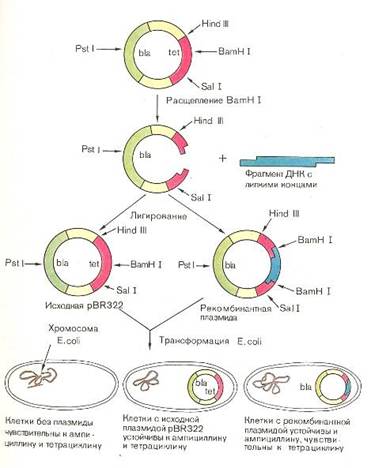
5. Генетическая инженерия — введение в геном микроорганизма информации о ферменте, необходимом для модификации продуцируемого антибиотика, например его метилирования при помощи метилаз.
Важной задачей является повышение эффективности биосинтеза известных антибиотиков. Значительных результатов удалось добиться за десятилетия селекции штаммов-продуцентов с применением индуцированного мутагенеза и ступенчатого отбора. Например, продуктивность штаммов Penicillium по синтезу пенициллина увеличена в 300—350 раз. Определенные перспективы открываются в связи с возможностью клонирования генов «узких мест» биосинтеза антибиотика или в случае, если все биосинтетические ферменты кодируются единым опероном.
Многообещающим подходом служит инкапсулирование антибиотиков, в частности их включение в лигюсомы, что позволяет прицельно доставлять препарат только к определенным органам и тканям, повышает его эффективность и снижает побочное действие. Этот подход применим и для других лекарственных препаратов. Например, кала-азар, болезнь, вызываемая лейгшма-нией, поддается лечению препаратами сурьмы. Однако лечебная доза этих препаратов токсична для человека. В составе липосом препараты сурьмы избирательно доставляются к органам, пораженным лейшманией, — селезенке и печени.
Вместо антибиотика в организм человека может вводиться его продуцент, антагонист возбудителя заболевания. Этот подход берет начало с работ И. И.Мечникова о подавлении гнилостной микрофлоры в толстом кишечнике человека посредством молочнокислых бактерий. Важную роль в возникновении кариеса зубов, по-видимому, играет обитающая во рту бактерия Streptococcus mutans, которая выделяет кислоты, разрушающие зубную эмаль и дентин. Получен мутант Strept. mutans, который при введении в ротовую полость почти не образует коррозивных кислот, вытесняет дикий патогенный штамм и выделяет летальный для него белковый продукт.
Гормоны.Биотехнология предоставляет медицине новые пути получения ценных гормональных препаратов. Особенно большие сдвиги произошли в последние годы в направлении синтеза пеп-тидных гормонов.
Раньше гормоны получали из органов и тканей животных и человека (крови доноров, удаленных при операциях органов, трупного материала). Требовалось много материала для получения небольшого количества продукта. Так, человеческий гормон роста (соматотропин) получали из гипофиза человека, каждый гипофиз содержит его не более 4 мг. В то же время для лечения одного ребенка, страдающего карликовостью, требуется около 7 мг соматотропина в неделю; курс лечения должен продолжаться несколько лет. С применением генноинже-нерного штамма Е. coli в настоящее время получают до 100 мг гормона роста на 1 л среды культивирования. Открываются перспективы борьбы не только с карликовостью, но и с низкорос-лостью — более слабой степенью дефицита соматотропина. Соматотропин способствует заживлению ран и ожогов, наряду с каль-цитонином (гормоном щитовидной железы) регулирует обмен Са2+ в костной ткани.
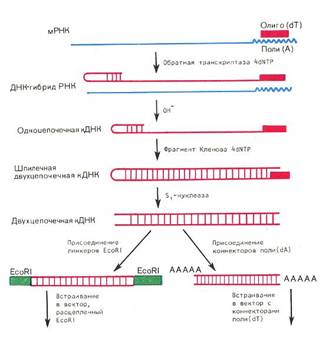
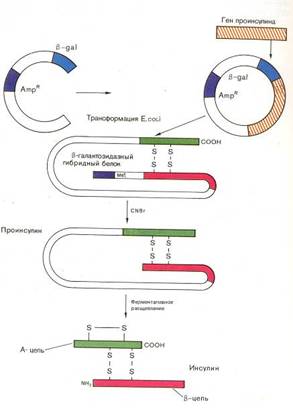
Инсулин, пептидный гормон островков Лангерганса поджелудочной железы, представляет основное средство лечения при сахарном диабете. Эта болезнь вызвана дефицитом инсулина и проявляется повышением уровня глюкозы в крови. До недавнего времени инсулин получали из поджелудочной железы быка и свиньи. Препарат отличался от человеческого инсулина 1—3 аминокислотными заменами, так что возникала угроза аллергических реакций, особенно у детей. Широкомасштабное терапевтическое применение инсулина сдерживалось его высокой стоимостью и ограниченностью ресурсов. Путем химической модификации инсулин из животных удалось сделать неотличимым от человеческого, но это означало дополнительное удорожание продукта.
Компания Eli Lilly с 1982 г. производит генноинженерный инсулин на основе раздельного синтеза Е. coli его А- и В-цепей. Стоимость продукта значительно снизилась, получаемый инсулин идентичен человеческому. С 1980 г. в печати имеются сообщения о клонировании у Е. сой гена проинсулина — предшественника гормона, переходящего в зрелую форму при ограниченном протеолизе.
К лечению диабета приложена также технология инкапсули-рования: клетки поджелудочной железы в капсуле, введенные однократно в организм больного, продуцируют инсулин в течение года.
Компания Integrated Genetics приступила к выпуску фолли-кулостимулирующего и лютенизирующего гормонов. Эти пептиды составлены из двух субъединиц. На повестке дня вопрос о промышленном синтезе олигопептидных гормонов нервной системы — энкефалинов, построенных из 5 аминокислотных остатков, и эндорфинов, аналогов морфина. При рациональном применении эти пептиды снимают болевые ощущения, создают хорошее
настроение, повышают работоспособность, концентрируют внимание, улучшают память, приводят в порядок режим сна и бодрствования. Примером успешного применения методов генетической инженерии может служить синтез р-эндорфина по технологии гибридных белков, описанной выше для другого пептидного гормона, соматостатина.
Значителен вклад биотехнологии и в промышленное производство непептидных гормонов, в первую очередь стероидов. Методы микробиологической трансформации позволили резко сократить число этапов химического синтеза кортизона, гормона надпочечников, применяемого для лечения ревматоидного артрита. При производстве стероидных гормонов широко используют иммобилизованные микробные клетки, например Arthrobacter globiformis, для синтеза преднизолона из гидрокортизона. Имеются разработки по получению гормона щитовидной железы тироксина из микроводорослей.
Интерфероны, интерлейкины, факторы крови.Интерфероны выделяются клетками человека и животных в ответ на инфици-рование вирусами. Они обладают антивирусной активностью. Механизм действия интерферонов до конца не выяснен. Предполагается, в частности, что Интерфероны препятствуют проникновению вирусных частиц в клетку. Интерфероны стимулируют деятельность иммунной системы и препятствуют размножению клеток раковых опухолей. Все аспекты действия интерферонов важны с точки зрения их терапевтического применения.
Различают a-, b-, g- и e-интерфероны, образуемые соответственно лейкоцитами, фибробластами соединительной ткани, Т-лимфоцитами и эпителиальными клетками. Наибольшее значение имеют первые три группы. Интерфероны состоят из 146—166 аминокислотных остатков, b - и g-интерфероны связаны с остатками Сахаров (гликозилированы). До введения методов генетической инженерии интерфероны получали из донорской крови — до 1 мкг неочищенного интерферона из 1 л крови, т. е. примерно одну дозу для инъекции.
В настоящее время a-, b- и g-интерфероны успешно получают с применением генноинженерных штаммов Е. coli, дрожжей, культивируемых клеток насекомых (Drosophila) и млекопитающих. Генно-инженерные интерфероны могут быть очищены с использованием моноклональных антител. В случае у- и р-интерферонов предпочтительно применение эукариотических продуцентов, так как прокариоты не гликозилируют белки. Некоторые фирмы, например Bioferon (ФРГ), используют не генноинженерные мутанты, а культивируемые in vitro фибропласты человека.
Интерфероны используются для лечения болезней, вызываемых вирусами герпеса, бешенства, гепатитов, цитомегаловиру-сом, вирусом, вызывающим опасное поражение сердца, а также для профилактики вирусных инфекций. Вдыхание аэрозоля интерферонов позволяет предупредить развитие острых респираторных заболеваний. Несколько курьезной проблемой является то что интерфероны, в частности a-интерфероны, сами могут вызывать у пациентов простудные симптомы (насморк, повышение температуры и т.д.). Проблема побочного действия стоит особенно остро при длительном терапевтическом применении интерферонов, необходимом для лечения злокачественных опухолей.
Интерфероны оказывают лечебное воздействие на организм больных раком груди, кожи, гортани, легких, мозга, рассеянной миеломе и саркоме Капоци — два последних заболевания характерны для лиц, страдающих приобретенными иммунодефицитами (см. ниже). Интерфероны полезны также при лечении рассеянного склероза.
Методы генетической инженерии позволяют получать модифицированные Интерфероны. Антивирусная активность интерферонов варьирует при аминокислотных заменах (J. Werenne, 1983). Американская компания Cetus Corporation производит b-интер-ферон, в аминокислотной последовательности которого цистеин в положении 17 замещен на серии. Это приводит к повышению терапевтической активности препарата, так как предотвращает наблюдаемое in vitro формирование неактивного димера b-интер-ферона за счет дисульфидных связей между остатками цистеина в положении 17. Определенные надежды возлагают на модификацию интерферонов путем получения гибридных молекул (Е. Д. Свердлов, 1984).
Интерлейкины—сравнительно короткие (около 150 аминокислотных остатков) полипептиды, участвующие в организации иммунного ответа. Интерлейкин-1, образующийся определенной группой лейкоцитов крови — макрофагами, в ответ на введение антигена стимулирует размножение (пролиферацию) Т-хелперов (субпопуляции Т-лимфоцитов), продуцирующих, в свою очередь, интерлейкин-2. Последний вызывает пролиферацию различных субпопуляций Т-лимфоцитов — Т-киллеров, Т-хелперов, Т-супрессоров, а также В-лимфоцитов, продуцентов антител. Под влиянием интерлейкина-2 из Т-лимфоцитов высвобождаются регуляторные белки — лимфокины, активирующие звенья иммунной системы; синтезируются также Интерфероны.
Интерлейкины, основные лечебные средства при иммунных расстройствах, получают путем клонирования соответствующих генов в Е. coll или культивирования лимфоцитов in vitro. Английская компания Celltech Ltd и японская Sakyo Company предлагают синтезированный генноинженерными бактериями интерлей-кин-1 наряду с другим тюлипептидным агентом —фактором некроза опухолей -- для лечения ряда опухолевых заболеваний (В. Sikyta el al., 1986).
Получаемые биотехнологическим путем факторы свертывания крови, особенно фактор VIII (с помощью культивируемых клеток млекопитающих) и фактор IX (с помощью генноинженер-ного штамма Е. coli), необходимы для терапии форм гемофилии наследственной болезни, при которой кровь теряет способность свертываться. К числу ценных с клинической точки зрения факторов, полученных в биореакторах с культурами животных клеток, следует отнести фактор роста В-лимфоцитов, фактор активации макрофагов, Т-заместительный фактор, активатор тканевого плазминогена.
Моноклокальные антитела и ДНК-или РНК-пробы.Моноклональные антитела — продукты В-гибридомных клеток — используют для диагностики различных заболеваний. Обладая высокой специфичностью действия, они обеспечивают идентификацию не только вида возбудителя, но и его серотипа. С помощью моноклональных антител можно тестировать различные гормоны, метаболиты, белковые факторы. Наиболее быстрый метод индикации основан на применении антител, иммобилизованных на мембранных электродах — аналогах ферментных биосенсоров. Они позволяют диагностировать беременность, выявлять предрасположенность к диабету, ревматоидному артриту (J. Col-lins et al., 1986), идентифицировать наследственные заболевания, сопровождающиеся утратой тех или иных ферментов и других белковых компонентов. Моноклональные антитела широко используют для диагностики рака и определения его форм.
Трудности связаны с тем, что специфических «раковых» антигенов, по-видимому, не бывает, и характерные для злокачественно переродившейся клетки детерминанты могут быть с некоторой, пусть небольшой, вероятностью обнаружены и в здоровых клетках. Перспективна диагностика рака при помощи моноклональ-ных антител к вырабатываемым злокачественной опухолью особым гормонам, аутокринам, ведущим к самостимуляции роста раковых клеток.
Моноклональные антитела имеют не только диагностическое, но и лечебное значение. При аутоиммунных заболеваниях, когда иммунные клетки «ополчаются» против собственных органов и тканей, моноклональные антитела соответствующей специфичности могут связывать антитела, наносящие вред организму больного. Для лечения рака предлагают использовать моноклональные антитела, конъюгированные с токсичными для раковых клеток соединениями. Моноклональные антитела доставляют яд точно по адресу, избегая поражения здоровых клеток. Поэтому к моноклональным антителам можно присоединять очень сильные токсины, например рицин — яд из клещевины, одной молекулы которого достаточно для поражения одной клетки. В современной фармацевтической промышленности моноклональные антитела используют для очистки лекарственных препаратов.
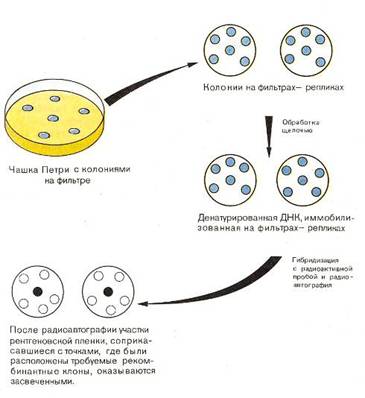
Диагностическое значение имеют короткие фрагменты ДНК и РНК, несущие радиоактивную или иную метку, так называемые ДНК/РНК-пробы. С их помощью можно установить наличие в организме определенных типов нуклеиновых кислот, соответствующих болезнетворным агентам, злокачественным опухолям, а также проверить геном пациента на наличие у него тех или иных генетических аномалий. Метод основан на комплементарном взаимодействии проб с участками ДНК или РНК, выделенными из исследуемых клеток и фиксированными на носителе. Взаимодействия нуклеотидных цепочек пробы с ДНК (РНК) из образца регистрируют по радиоактивной метке или иным способом.
Моноклональные антитела и ДНК/РНК-пробы используют для диагностики болезней животных и растений. В частности, с помощью этих проб проводят индикацию зараженности картофеля вирусом. Диагностические средства из арсенала биотехнологов предлагают применять для быстрого определения пола у цыплят.
Рекомбинантные вакцины и вакцины-антигены.Вакцинация — один из основных способов борьбы с инфекционными заболеваниями. Путем поголовной вакцинации ликвидирована натуральная оспа, резко ограничено распространение бешенства, полиомиелита, желтой лихорадки. На повестке дня — изготовление вакцин против гриппа, гепатитов, герпесов, свинки, кори, острых респираторных заболеваний. Большое экономическое значение имеет разработка вакцин против болезней сельскохозяйственных животных — ящура, африканской болезни лошадей, овечьей бо-
лезни «синего языка», трипаносомозов и др. Традиционные вакцинные препараты изготовляют на основе ослабленных, инактивиро-ванных или дезинтегрированных возбудителей болезней.
Современные биотехнологические разработки предусматривают создание рекомбинантных вакцин и вакцин-антигенов. Вакцины обоих типов основаны на генноинженерном подходе.
Для получения рекомбинантных вакцин обычно используют хорошо известный вирус коровьей оспы (осповакцины). В его ДНК встраивают чужеродные гены, кодирующие иммуногенные белки различных возбудителей (гемагглютинин вируса гриппа, гликопротеин D вируса герпеса, поверхностный антиген вируса гепатита В, антиген малярийного плазмодия). Получаются вакцины против соответствующих инфекций, хорошо зарекомендовавшие себя в опытах на животных. К их достоинствам относится возможность создания поливалентных вакцинных препаратов на основе объединения участков ДНК различных патогенов «под эгидой» ДНК вируса осповакцины. Открывается возможность одномоментной комплексной иммунизации, скажем, крупного рогатого скота против всех опасных инфекций данной местности.
Вакцины-антигены получают, клонируя гены возбудителя болезни в Е. colt, дрожжах, клетках насекомых и млекопитающих. Клонирован ген поверхностного антигена HBS-вируса гепатита В (сывороточного гепатита), ген белка оболочки УРЬвируса ящура. Вирус ящура существует в виде многих серотипов, методом белковой инженерии удалось скомбинировать иммуногенные компоненты различных серотипов в рамках одной вакцины-антигена.
Вакцины-антигены высокостабильны при хранении и перевозке, сравнительно просты в изготовлении (в том числе и при крупномасштабном производстве), содержат минимальное количество белка и поэтому малоопасны как аллергены. Они гарантированы от остаточной инфекционности — способности вызывать инфекционную болезнь вместо того, чтобы предохранять от нее. Проблемой является низкая иммуногенность вакцин-антигенов. Одной из причин может быть то, что вакцина не включает всех компонентов возбудителя, необходимых для создания иммунитета к нему. Так, вирус, покидая клетку, часто «одевается» ее мембраной. Компоненты этой мембраны, отсутствующие в генноинженерном белке, могут обладать иммуноген-ными свойствами. К повышению иммуногенности вакцин-антигенов ведет добавление адьювантов, иммобилизация вакцин на носителях или их включение в липосомы.
Ферменты медицинского назначения.Многообразно применение ферментных препаратов в медицине. Их используют для растворения тромбов, лечения наследственных заболеваний (вместо отсутствующих эндогенных ферментов), удаления не-
жизнеспособных, денатурированных структур, клеточных и тканевых фрагментов, освобождения организма от токсических веществ (Н. Ф. Казанская и др., 1984). Яркий пример-спасение жизни больных с тромбозом конечностей, легких, коронарных сосудов сердца при помощи громболитически.х ферментов (стрсптокиназы, урокиназы). В СССР такие препараты созданы в иммобилизованной форме под руководством Е. И. Чазова и И. В. Березина. Ген урокнназы клонирован в бактериях (S. Prentis, 1984). В современной медицине протеазы применяются для очистки очагов гнойно-некротических процессов от патологических продуктов, а также для лечения ожогов Лечение рака связано с использованием L-аспарагиназы, кото рая лишает раковые клетки ресурсов необходимого для их раз вития аспарагина, поступающего с током крови. Здоровые клетки в отличие от раковых (некоторых типов) способны к самостоятельному синтезу аспарагина.
Известно около 200 наследственных заболеваний, обуслов ленных дефицитом какого-либо фермента или иного белкового фактора. В настоящее время делают попытки лечения этих заболеваний с применением ферментов. Так, пытаются лечить болезнь Готе, при которой организм не способен расщеплять, глюкоцереброзиды (S. Prentis, 1984).
В последние годы все больше внимания уделяют ингибиторам ферментов. Ингибиторы протеаз, получаемые из актино мицетов (лейпептин, антипаин, химостатин и др.) и генноинже нерных штаммов Е. coil (эглин) и дрожжей a-1 антитрипсин) оказываются полезными при септических процессах, инфаркте миокарда, эмфиземе легких, панкреатите. Уменьшение концентрации глюкозы в крови больных диабетом может быть достигнуто при исполь зовании ингибиторов кишечных инвертаз и амилаз, отвечающих за превращение крахмала и сахарозы в глюкозу. Особой задачей является поиск ингибиторов ферментов, с помощью которых патогенные микроорганизмы разрушают антибиотики, вводимые в организм больного.
Таковы основные направления биотехнологических разработок в области медицины. Без преувеличения можно сказать что центральное приложение новейших биотехнологических подходов — медицина. Одной из проблем, связанных с белками медицинского назначения, является наличие у них побочных эффектов. Например, аллергические реакции возникают как против генноинженерных белков, так и против моноклональных антител, даже если их получают на основе человеческих гибридом. Эта проблема не нова для медицины и не является непреодолимой.
4. Биотехнология и пищевая промышленностьМикроорганизмы, культуры растительных клеток могут дать пищевые добавки, выгодно отличающиеся своей «натуральностью» от синтетических продуктов, преобладающих в настоящее время. В будущем кулинар сможет добавить в изделие аромат земляники или винограда, масло чеснока или мяты — продукты, образуемые в биореакторах с растительными клетками.
Все большее значение приобретают низкокалорийные, не опасные для больных диабетом заменители сахарозы, в первую очередь фруктоза — продукт превращения глюкозы при участии иммобилизованной глюкоизомеразы. В некоторых продуктах применяют глицин, дающий в комбинации с аспарагиновой кислотой различные оттенки сладкого и кислого. Планируют пищевое применение очень сладкого дипептида аснартама и особенно 100—200-звенных пептидов тауматина и монеллина, которые слаще сахарозы в 10 тыс. раз. В виде мультимера аспартам получен с помощью генноинженерных мутантов Е. coli, недавно клонирован также ген тауматина.
Немаловажную роль играют ныне в пищевой промышленности ферменты. С их помощью осветляю! фруктовые соки, производят безлактозное (диетическое) молоко, размягчают мясо. Большие возможности в плане повышения питательной ценности представляет добавление в продукты питания витаминов и аминокислот. Ряд аминокислот производят с применением микробов-сверхпродуцентов, полученных с применением методов генетической инженерии. Так, генноинженерный штамм E. coli синтезирует до 30 г/л L-треонина за 40 ч культивирования. Важный аспект биотехнологии — улучшение штаммов промышленных микроорганизмов. Основные приложения биотехнологии к пищевой промышленности суммированы в табл. 3.
Биомасса одноклеточных в перспективе может употребляться как пищевая добавка. Основные принципы получения белка в пищу те же, что и для производства кормового белка, однако крут допустимых субстратов более ограничен, в требования к компонентному составу биомассы более жесткие. В пищевой биомассе должно содержаться не менее 80% белка сбалансированного аминокислотного состава, не более 2% нуклеиновых кислот и 1% липидов (М. Г. Безруков, 1985). Необходимы детальные токсикологические и медико-биологические исследования с последующим клиническим испытанием пищевых препаратов биомассы (В. Г. Высоцкий, 1985)
Психологический барьер, на который наталкивается произ водство «микробной пиши» в странах Европы и Японии, связан не только с прямым риском подвергнуться интоксикации, но и с сомнительными вкусовыми достоинствами этой «пищи будущего». Эксперт по проблемам питания, попробовав образец бактериальной биомассы, заметил: «Она имеет все те свойства, которыми должна обладать новая человеческая пища: не имеет ни запаха, ни цвета, ни структуры, ни вкуса».
Остается выразить надежду на то, что в эпоху, когда белок одноклеточных войдет в употребление, биотехнология сможет в полной мере использовать созданный ею же потенциал растительных и микробных клеток как продуцентов вкусовых, ароматизирующих и структурирующих пищу добавок. Перспективным представляется культивирование грибов (Fusarium), цианобак-терий (Spirulina), зеленых водорослей (Chlorella, Scenedesmus), имеющих консистенцию и другие органолептические свойства, более привычные для человека. Волокнистую массу Fusarium на базе картофельного или пшеничного крахмала как источник пищи для человека производит ныне компания Rank Hovis Me. Dougall.
Таблица 3. Перспективы использования биотехнологических продуктов в пищевой промышленности (по П. П. Клесову, 1984; М. Haas, 1984; J. Kas, 1984; О. Volfova, 1984; О. Sahai, M. Knuth, 1985)
| Продукт | Примеры | Применение в пищевой промышленности |
| Аминокислоты | Цистеин, метионин, лизин | Повышение питательной ценности пищи (в том числе белка одноклеточных) |
| Глутамат | Усиление аромата мясных, рыбных, грибных изделий | |
| Глицин, аспартат | Придание кондитерским изделиям и напиткам кисло-сладкого вкуса | |
| Олигопептиды | Аспартам, тауматин, монеллин | Низкокалорийные, очень сладкие вещества |
| Ферменты | a-Амилаза | Гидролиз крахмала при производстве спирта, вин, в пивоварении, хлебопечении, изготовлении кондитерских изделий и детского питания |
| Глюкоамилаза | Получение глюкозы, удаление остаточных декстринов из пива | |
| Инвертаза | Производство кондитерских изделий | |
| Пуллуланаза | Производство мальтозных (в сочетании с a-амилазой) или глюкозных (в сочетании с глюкоамилазой) сиропов из крахмала, предварительно обработанного a-амилазой | |
| b-Галактози-даза | Производство безлактозного молока, освобождение молочной сыворотки от лактозы, приготовление мороженого | |
| Целлюлозы | Приготовление растворимого кофе, морковного джема, улучшение консистенции грибов и овощей, обработка цитрусовых | |
| Пектиназы | Осветление вин и фруктовых соков, обработка цитрусовых | |
| Микробные протеазы | Сыроварение, ускорение созревания теста, производство крекеров | |
| Пепсин, па-паин | Осветление пива | |
| Фицин, трипсин, бромелаин | Ускорение маринования рыбы, удаление мяса с костей | |
| Липазы | Придание специфического аромата сыру, шоколаду, молочным продуктам, улучшение качества взбитых яичных белков | |
| Глюкозооксидаза в сочетании с каталазой | Удаление кислорода из сухого молока, кофе, пива, майонезов, лимонных, апельсиновых и виноградных соков | |
| Витамины | А, В1, В2, В6, В12, С, D, Е, никотиновая кислота С, Е | Повышение питательной ценности пищевых продуктов Антиоксиданты |
| Терпены и родственные соединения | Гераниол, нерол | Ароматизаторы |
| Органические кислоты | Уксусная, бен-зойная, молочная, глюконовая, лимонная | Консерванты, ароматизаторы |
Приложения биотехнологии к добыче, обогащению и перераработке руд, отделению и концентрированию металлов из сточных вод как вторичного сырья, экстракции остаточных порций нефти из иссякающих месторождений относятся к области биогео-технологии. Большую роль в этих процессах играют микроорганизмы, способные жить в недрах Земли и осуществлять там химические превращения.
Способностью переводить металлы в растворимые соединения (выщелачивание металлов из руд) обладают различные бактерии. Например, Thiobacillus ferrooxydans выщелачивает железо, медь, цинк, уран и другие металлы, окисляя их серной кислотой, которая образуется этой бактерией из сульфида (Г. И. Ка-равайко, 1984). Chromobacterium violaceum растворяет золото по схеме Au-vAu(CN)2 (A. D. Smith, R. J. Hunt, 1985). Технологии подобных процессов подкупают своей простотой: для извлечения остатков меди, урана, никеля из «пустых пород» горнорудного производства их обливают водой и собирают вытекающие продукты жизнедеятельности микроорганизмов — растворимые соединения (CuSO4, UO|+ и т. д.). Метод бактериального выщелачивания позволяет рассматривать разработку бедных месторождений как экономически выгодное предприятие. В США бедные никелевые руды, содержащие всего около 1 кг Ni на 1 т породы, предполагают «выдать на гора» с применением бактериального выщелачивания.
Если речь идет об извлечении металлов из сточных вод, то большое значение придается таким микроорганизмам, как Citrobacter sp. (L. Е. Macaskie, А. С. R. Dean, 1985), Zoogloea ramigera, клетки и внеклеточные полисахариды которой извлекают U, Си, Cd (Г. И. Каравайко, 1984). Велика хелирующая способность грибной биомассы, что, учитывая сравнительную дешевизну ее наработки в больших количествах, открывает
перспективы не только для концентрирования металлов (РЬ, Hg, Zn, Cu, Ni, Co, Mn, Cr, Ag, Au, Pt, Pd) из растворов, где они присутствуют в следовых количествах (Г'. И. Каравайко, 1984), но и для освобождения растворов от радиоактивных примесей (дезактивации).
Ксантан, внеклеточный полисахарид бактерии Xanthomonas campestris, может применяться для извлечения нефти из иссякающих месторождений. Остаточные порции нефти обычно адсорбируются на различных породах, содержащихся в нефтеносных пластах, и не вымываются из них водой. Раствор ксантана в воде обладает, однако, высокой вязкостью и при закачке в пласты под повышенным давлением высвобождает капли нефти из всех трещин и углублений нефтеносных пород (S. Prentis,
1984). Бактерии-деэмульгаторы, например Nocardia sp, Rhodoco-сеик rhodochrous, разделяют водную и нефтяную фазы, что может быть использовано как для конценгрирования нефти, так и для очистки сточных вод от нефтяных примесей, создающих угрозу для окружающей среды.
Пересечение различных сфер приложения биотехнологии (в нашем примере — биогеотехнологической и природоохранной) составляет характерную особенность ее современного этапа развития. Генноинженерные штаммы псевдомонад, утилизирующие сырую нефть, допускают, по меньшей мере, две сферы применения: получение биомассы на базе необ работанной нефти и предотвращение нефтяного загрязнения окружающей среды, в частности устранения нефтяных пленок на поверхности вод морей и океанов.
ЗАКЛЮЧЕНИЕНет сомнения, потенциал биотехнологии в наши дни велик. Ей дано — пусть в определенных границах — перевивать поновому «нить жизни» — ДНК — методами генетической и клеточной инженерии, создавать биообъекты по заранее заданным параметрам и, как обычно добавляют, на благо человечества.
Всегда ли на благо? Думается, что уже из основного текста ясно: что накопленный разносторонний потенциал современной биотехнологии — это обоюдоострый меч, который, подобно другим новым отраслям научно-технического прогресса, сформировавшимся в XX в. (ядерная энергетика, компьютерная электроника, космонавтика), может принести не только пользу, но и вред при бесконтрольном, неосторожном и тем более злонамеренном применении. Так, в распространении методов генетической инженерии видели угрозу заражения людей невиданными болезнетворными «генетическими монстрами», создания новых разновидностей злостных сорняков и даже выведения «стандартных людей» по заранее заданным программам. Потенциальную угрозу, заключающуюся в развитии биотехнологии, нельзя ни преувеличивать, ни преуменьшать, она в значительной мере определяется не чисто научно-техническими, а этическими и социально-политическими факторами. Как отмечено в материалах XXVII съезда КПСС, в разных общественно-политических системах научно-техническая революция оборачивается разными ее гранями и последствиями.
Биотехнология представляется «страной контрастов», сочетания самых передовых достижений научно-технического прогресса с определенным возвратом к прошлому, выражающимся в использовании живой природы как источника полезных для человека продуктов вместо химической индустрии.
Значительные контрасты характерны для биотехнологии и в отношении необходимых для ее развития финансовых средств, сырьевых материалов и кадров. Есть биотехнологические разработки, требующие весьма внушительных капиталовложений, концентрации усилий крупных коллективов научных работников, инженерно-технических и управленческих кадров, дорогостоящего сырья и оборудования (многие генноинженерные разработки, биотехнологические процессы с применением автоматизированных систем управления). Это так называемая «большая
биотехнология». Ей противостоит «малая биотехнология» (получение биогаза, выращивание микроводорослей в прудах), обходящаяся во многом даровыми источниками энергии и сырья, низкими капиталовложениями, небольшими затратами труда.
Все направления современной биотехнологии должны служить всему человечеству, а не только тем, кто способен финансировать развитие той или иной отрасли. В частности, развивающиеся страны должны получить доступ к «большой биотехнологии», которая им пока во многом «не по карману». Генно-инженерная вакцина против малярии необходима для стран Африки, где от малярии погибает более миллиона детей в год. Но могут ли развивающиеся страны Африки финансировать массовое производство генно-инженерных вакцин? Настоятельной необходимостью является международная координация усилий биотехнологов, всех заинтересованных стран. В рамках государств — участников СЭВ такая координация предусмотрена в Комплексной программе научно-технического прогресса, рассчитанной на период до 2000 г.
Биотехнология — междисциплинарная область научно-технического прогресса. Она весьма гетерогенна по своему теоретическому базису, потому что призвана исследовать не какой-либо класс объектов, а решать определенный круг комплексных проблем. Одной из них является, например, поиск дешевого заменителя тростникового (свекловичного) сахара, и армия биотехнологов берется за дело, сочетая в своей деятельности элементы различных наук: методы микробиологии, необходимые для выращивания микроорганизма, биохимии — для выделения глюкоизомеразы (дающей глюкозо-фруктозный сироп при использовании глюкозы как субстрата), органического синтеза— для получения полимерного носителя, а при регулировке параметров системы с иммобилизованным ферментом необходимы физико-химические расчеты. Можно добавить еще, что для повышения эффективности биосинтеза глюкоизомеразы могут быть использованы методы генетической и клеточной инженерии.
Круг вопросов, к решению которых привлекают биотехнологические разработки, весьма широк. Однако большинство из них прямо или косвенно связано с глобальными проблемами, стоящими перед современной цивилизацией: загрязнение окружающей среды, угроза экологического кризиса; истощение запасов полезных ископаемых, в первую очередь источников энергии, угроза мирового энергетического кризиса; нехватка продовольствия, особенно ощутимая в развивающихся странах.
Слова «биология» и «биотехнология» различаются лишь тем, что в слове «биотехнология» есть вставка «техно». И биология, и биотехнология имеют дело с живыми объектами, но как различны их подходы к живому! Биотехнолог изучает живое не из чисто познавательного интереса, он пытается «заставить» работать живые объекты, производить нужные человеку продукты. «Зачем брать на себя труд изготовления химических соедине-
ний, если микроб может сделать это за нас?», — говорил Дж. Б. С. Холдейн еще в 1929 г., предвосхищая грядущий расцвет биотехнологии. В современной биотехнологии живое рассматривается как средство производства в ряду всех прочих средств; например, при биологической трансформации органических соединений микроорганизмам отводят роль химических реагентов. Не случайна и стандартная для инженерной энзи-мологии метафора, уподобляющая иммобилизованные биообъекты «закованным в цепи рабам». Биообъект, таким образом, понижают в ранге, переводя из категории самостоятельной целостной живой системы в категорию реагентов, датчиков, реле, компьютерных деталей, прочих орудий модернизированного производства.
Эта тенденция современной биотехнологии имеет не только философское, но и практическое значение. Она порождает чересчур грубый, примитивный, чисто эмпирический подход к такому сложному объекту, как живое, что ведет к его низкоэффективному функционированию в условиях биотехнологического процесса. Не оправдал себя, в частности, лобовой метод оптимизации подобного процесса, оптимизация «грубой силой», проводимый без детальных знаний физиологии используемого организма. Недостаточно надежен в биотехнологии и метод кибернетического моделирования, упрощающий биологический объект до «черного ящика».
Существует и другая тенденция в биотехнологии. Ее приверженцы относятся с «пониманием» к тонкости и слаженности систем регуляции процессов жизнедеятельности в клетке биообъекта. В полушутливой форме эти мысли выражены журналистом и популяризатором биотехнологии Фишлоком в предисловии к книге «Биотехнологический бизнес» (1982): «Микробы намного умнее и способнее микробиологов, генетиков и инженеров». Речь нередко идет о повышении ранга биообъекта в биотехнологии.
Описанные особенности подхода биотехнологии к объекту выделяют ее среди традиционных естественно-научных дисциплин.
Биотехнология — типичное порождение нашего бурного, динамичного XXI в. Она открывает новые горизонты перед человеческим разумом. Проблемы биотехнологии чрезвычайно многообразны, начиная от чисто технических (например, снижение каталитической активности ферментов при их иммобилизации) и кончая тонкими интеллектуальными проблемами, связанными с обеднением фундаментальной науки в связи с доминированием чисто проблемно-прикладных разработок.
В условиях социализма открываются широкие перспективы и возможности для использования новых научных исследований и разработок на благо человека и общества.
Список используемой литературы. ''Биотехнология: свершения и надежды'' – Сассон А., Москва, «Мир» 1987г. ''Биотехнология проблемы и перспективы'' – Егоров Н.С., Москва, «Высшая школа» 1987г. ''Биотехнология: что это такое?'' Вакула В.Л., Москва, «Молодая гвардия» 1989г.
Похожие работы
... олигонуклеотидов—одну полуавтоматическую, а вторую в комплексе с компьютером. В 1982 г. цена этих приборов на американском рынке составляла 36000—39500 долл.[2]. К открытиям связанным с достижениями генной инженерии нужно прибавить то, что огромный генетический «чертеж» многоклеточного существа просчитан полностью. Я думаю это можно назвать достижением века. После восьми лет работы многих ...
... живых организмов, биологических процессов и систем в производстве, включая превращение различных видов сырья в продукты. По определению академика Ю.А. Овчинникова, биотехнология - комплексная, многопрофильная область научно - технического прогресса, включающая разнообразный микро - биологический синтез, генетическую и клеточную инженерную энзимологию, использование знаний, условий и ...
... 1972 год, когда в Стенфордском университете П. Берг и С. Коэн с сотрудниками создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса SV40, бактериофага и E. coli. Генетическая инженерия Одним из разделов молекулярной генетики и молекулярной биологии, который нашел наибольшее практическое приложение, является генная инженерия. Генная инженерия – это сумма методов, позволяющих ...
... инженерию. Необходимо отметить, что если базовый стандарт по химии не предусматривает изучение вопросов биотехнологии, то таковой по биологии содержит наиболее общие её аспекты: достижения генной инженерии и перспективы биотехнологии. 2.2 Межпредметные связи по изучению аспектов биотехнологии в средней школе По программе Р.Г. Ивановой и Л.А. Цветкова в 10 классе предусмотрено изучение темы ...
0 комментариев