Навигация
Признаки определяются отдельными наследственными факторами, которые передаются через половые клетки;
1. признаки определяются отдельными наследственными факторами, которые передаются через половые клетки;
2. отдельные признаки организмов при скрещивании не исчезают, а сохраняются в потомстве в том же виде, в каком они были у родительских организмов.
Для теории эволюции эти принципы имели кардинальное значение. Они раскрыли один из важнейших источников изменчивости, а именно механизм сохранения приспособленности признаков вида в ряду поколений. Если бы приспособительные признаки организмов, возникшие под контролем отбора, поглощались, исчезали при скрещивании, то прогресс вида был бы невозможен.
Все последующее развитие генетики было связано с изучением и расширением этих принципов и приложением их к теории эволюции и селекции.
Из установленных принципиальных положений Менделя логически вытекает целый ряд проблем, которые шаг за шагом получают свое разрешение по мере развития генетики. В 1901 г. де Фриз формулирует теорию мутаций, в которой утверждается, что наследственные свойства и признаки организмов изменяются скачкообразно – мутационно.
В 1903 г. датский физиолог растений В. Иоганнсен публикует работу «О наследовании в популяциях и чистых линиях», в которой экспериментально устанавливается, что относящиеся к одному сорту внешне сходные растения являются наследственно различными - они составляют популяцию. Популяция состоит из наследственно различных особей или родственных групп – линий. В этом же исследовании наиболее четко устанавливается, существование двух типов измен6чивости организмов: наследственной, определяемой генами, и ненаследственной, определяемой случайным сочетанием факторов, действующих на проявление признаков.
На следующем этапе развития генетики было доказано, что наследственные формы связаны с хромосомами. Первым фактом, раскрывающим роль хромосом в наследственности, было доказательство роли хромосом в определении пола у животных и открытие механизма расщепления по полу 1:1.
С 1911 г. Т. Морган с сотрудниками в Колумбийском университете США начинает публиковать серию работ, в которой формулирует хромосомную теорию наследственности. Экспериментально доказывая, что основными носителями генов являются хромосомы, и что гены располагаются в хромосомах линейно.
В 1922 г. Н.И. Вавилов формулирует закон гомологических рядов в наследственной изменчивости, согласно которому родственные по происхождению виды растений и животных имеют сходные ряды наследственной изменчивости. Применяя этот закон, Н.И. Вавилов установил центры происхождения культурных растений, в которых сосредоточено наибольшее разнообразие наследственных форм.
В 1925 г. у нас в стране Г.А. Надсон и Г.С. Филиппов на грибах, а в 1927 г. Г. Мёллер в США на плодовой мушке дрозофиле получили доказательство влияния рентгеновых лучей на возникновение наследственных изменений. При этом было показано, что скорость возникновения мутаций увеличивается более чем в 100 раз. Этими исследованиями была доказана изменчивость генов под влиянием факторов внешней среды. Доказательство влияния ионизирующих излучений на возникновение мутаций привело к созданию нового раздела генетики – радиационной генетики, значение которой еще более выросло с открытием атомной энергии.
В 1934 г. Т. Пайнтер на гигантских хромосомах слюнных желез двукрылых доказал, что прерывность морфологического строения хромосом, выражающаяся в виде различных дисков, соответствует расположению генов в хромосомах, установленному ранее чисто генетическими методами. Этим открытием было положено начало изучению структуры и функционирования гена в клетке.
В период с 40-х годов и по настоящие время сделан ряд открытия (в основном на микроорганизмах) совершенно новых генетических явлений, раскрывших возможности анализа структуры гена на молекулярном уровне. В последние годы с введением в генетику новых методов исследования, заимствованных из микробиологии мы подошли к разгадке того, каким образом гены контролируют последовательность расположения аминокислот в белковой молекуле.
Прежде всего, следует сказать о том, что теперь полностью доказано, что носители наследственности являются хромосомы, которые состоят из пучка молекул ДНК.
Были проведены довольно простые опыты: из убитых бактерий одного штамма, обладающего особым внешним признаком, выделили чистую ДНК и перенесли в живые бактерии другого штамма, после чего размножающиеся бактерии последнего приобрели признак первого штамма. Подобные многочисленные опыты показывают, что носителем наследственности является именно ДНК.
В 1953 г. Ф. Крик (Англия) и Дж. Уотстон (США) расшифровали строение молекулы ДНК. Они установили, что каждая молекула ДНК слагается из двух полидезоксирибонуклеиновых цепочек, спирально закрученных вокруг общей оси.
В настоящее время найдены подходы к решению вопроса об организации наследственного кода и экспериментальной его расшифровке. Генетика совместно с биохимией и биофизикой вплотную подошла к выяснению процесса синтеза белка в клетке и искусственному синтезу белковой молекулы. Этим начинается совершенно новый этап развития не только генетики, но и всей биологии в целом.
Развитие генетики до наших дней – это непрерывно расширяющийся фонт исследований функциональной, морфологической и биохимической дискретности хромосом. В этой области сделано уже много сделано уже очень много, и с каждым днем передний край науки приближается к цели – разгадки природы гена. К настоящему времени установлен целый ряд явлений, характеризующих природу гена. Во-первых, ген в хромосоме обладает свойством самовоспроизводится (авторепродукции); во-вторых, он способен мутационно изменяться; в-третьих, он связан с определенной химической структуры дезоксирибонуклеиновой кислоты – ДНК; в-четвертых, он контролирует синтез аминокислот и их последовательностей в белковой молекулы. В связи с последними исследованиями формируется новое представление о гене как функциональной системе, а действие гена на определение признаков рассматривается в целостной системе генов – генотипе.
Раскрывающиеся перспективы синтеза живого вещества привлекают огромное внимание генетиков, биохимиков, физиков и других специалистов.
Нуклеиновые кислоты.Нуклеиновые кислоты, как и белки, необходимы для жизни. Они представляют собой генетический материал всех живых организмов вплоть до самых простых вирусов. Выяснение структуры ДНК открыло новую эпоху в биологии, так как позволило понять, каким образом живые клетки точно воспроизводят себя и как в них кодируется информация, необходимая для регулирования их жизнедеятельности. Нуклеиновые кислоты состоят из мономерных единиц, называемых нуклеотидами. Из нуклеотидов строятся длинные молекулы – полинуклеотиды. Молекула нуклеотида состоит из трех частей: пятиуглеродного сахара, азотистого основания и фосфорной кислоты. Сахар, входящий в состав нуклеотидов, представляет собой пентозу.
Различают два типа нуклеиновых кислот – рибонуклеиновые (РНК) и дезоксирибонуклеиновые (ДНК). В обоих типах нуклеиновых кислот содержатся основания четырех разных видов: два из них относятся к классу пуринов, другие - к классу пиримидинов. Азот, содержащийся в кольцах, придает молекулам основные свойства. Пурины – это аденин (А) и гуанин (Г), а пиримидины – цитозин (Ц) и тимин (Т) или урацил (У). В молекулах пуринов имеется два кольца, а в молекулах пиримидинов – одно. В РНК вместо тимина содержится урацил. Тимин химически очень близок к урацилу, а точнее 5-метилурацил.
Нуклеиновые кислоты являются кислотами потому, что в их молекулах содержится фосфорная кислота. В результате соединения сахара с основанием образуется нуклеозид. Соединение происходит с выделением молекулы воды. Для образования нуклеотида требуется еще одна реакция конденсации, в результате которой, между нуклеозидом и фосфорной кислотой возникает фосфоэфирная связь. Разные нуклеотиды отличаются друг от друга природой сахаров и оснований, которые входят в их состав. Роль нуклеотидов в организме не ограничивается тем, что они служат строительными блоками нуклеиновых кислот; некоторые важные коферменты также представляют собой нуклеотиды или их производные.
Два нуклеотида, соединясь, Образуют динуклеотид путем конденсации. В результате которой между фосфатной группой одного нуклеотида и сахара другого возникает фосфодиэфирный мостик. При синтезе полинуклеотидов этот процесс повторяется несколько миллионов раз. Фосфодиэфирные мостики возникают за счет прочных ковалентных связей, и это сообщает всей нуклеотидной цепи прочность и стабильность, что очень важно, так как в результате этого уменьшается риск «поломок» ДНК, при ее репликации.
РНК имеет две формы: транспортную (тРНК) и рибосомную (рРНК). Они имеют довольно сложную структуру. Третья форма - это информационная, или матричная, РНК (мРНК). Все эти формы участвуют в синтезе белка. МРНК – это одноцепочная молекула, образующаяся на одной из цепей ДНК в процессе транскрипции. При синтезе мРНК копируется только одна цепь молекулы ДНК. Нуклеотиды, из которых синтезируются мРНК, присоединяются к ДНК в соответствии с правилами спаривания оснований и при участии фермента РНК – полимеразы. Последовательность оснований в мРНК представляет собой комплиментарную копию цепи ДНК – матрицу. Длина ее может быть различной, в зависимости от длины полипептидной цепи, которую она кодирует. Большинство мРНК существует в клетке в течение короткого времени.
Рибосомная РНК кодируется особыми генами, находящимися в нескольких хромосомах. Последовательность в рРНК сходная у всех организмов. Она содержится в цитоплазме, где образует вместе с белковыми молекулами клеточные органеллы, называемые рибосомами. На рибосомах происходит синтез белка. Здесь «код», заключенный в мРНК, транслируется в аминокислотную последовательность строящейся полипептидной цепи. Группы, образуемые рибосомами – полирибосомы (полисомы) – делают возможным одновременный синтез нескольких молекул полипептидов при участии одной молекулы мРНК.
Для каждой аминокислоты имеется специфическая тРНК, и все они доставляют содержащиеся в цитоплазме аминокислоты к рибосомам. Таким образом, тРНК играют роль связующих звеньев между триплетным кодом, содержащимся в мРНК и аминокислотной последовательностью в полипептидной цепи. Так как многие аминокислоты кодируются несколькими триплетами, число тРНК значительно больше 20 (идентифицировано уже 60). Каждая аминокислота присоединяется к одной из своих тРНК. В результате образуется аминоацил – тРНК, в котором энергия связи между концевым нуклеотидом А и аминокислотой достаточна для того, чтобы в дальнейшем могла образоваться пептидная связь с карбоксильной группой соседней аминокислоты.
Генетический код.Последовательность оснований в нуклеотидах ДНК должна определять аминокислотную последовательность белков. Эта зависимость между основаниями и аминокислотами является генетическим кодом. С помощью четырех типов нуклеотидов записаны параметры для синтеза белковых молекул. В код, состоящий из троек оснований, входит четыре разных триплета. Доказательство триплетности кода представил Ф. Крик в 1961 г. Для многих аминокислот существенное значение имеет только первые буквы. Одна из особенностей генетического кода состоит в том, что он универсален. У всех живых организмов имеются одни и те же 20 аминокислот и пять азотистых оснований.
В настоящее время успехи молекулярной биологии достигли такого уровня, что стало возможно определить последовательность оснований в целых генах. Эта серьезная веха в развитии науки, так как теперь можно искусственно можно синтезировать целые гены. Это нашло применение в генной инженерии.
Биосинтез белков.Единственные молекулы, которые синтезируются под прямым контролем генетического материала клетки, - это белки (если не считать РНК). Белки могут быть структурными (кератин, коллаген) или играть функциональную роль (инсулин, фибриноген и, главное, ферменты, ответственные за регуляцию клеточного метаболизма). Именно набор содержащихся в данной клетке ферментов определяет, к какому типу клеток она будет относиться. В 1961 году два французских биохимика Жакоб и Моно, исходя из теоретических соображений, постулировали существование особой формы РНК, выполняющей в синтезе белка роль посредника. В последствии этот посредник получил название мРНК.
Данные, полученные с помощью различных методов в экспериментах, показали, что процесс синтеза РНК состоит из двух этапов. На первом этапе (транскрипция) относительно слабые водородные связи между комплиментарными основаниями полинуклеотидных цепей разрываются, что приводит к раскручиванию двойной спирали ДНК и освобождению одиночных цепей. Одна из этих цепей избирается в качестве матрицы для построения комплиментарной одиночной цепи мРНК. Молекулы мРНК образуются в результате связывания друг с другом свободных рибонуклеотидов. Синтезированные молекулы мРНК, несущие генетическую информацию, выходят из ядра и направляются к рибосомам. После того, как образовалось достаточное число молекул мРНК, транскрипция прекращается и две цепи ДНК на этом участке вновь соединяются, восстанавливая двойную спираль. Второй этап – это трансляция, которая происходит на рибосомах. Несколько рибосом могут прикрепиться к молекуле мРНК, подобно бусинам на нити, образуя структуру, называемую полисомой. Преимущество такого комплекса состоит в том, что при этом на одной молекуле мРНК становится возможным одновременный синтез нескольких полипептидных цепей. Как только новая аминокислота присоединилась к растущей полипептидной цепи, рибосома перемещается по нитям мРНК. Молекула тРНК покидает рибосому и возвращается в цитоплазму. В конце трансляции полипептидная цепь покидает рибосому.
Хромосомный комплекс человека.На Земле не существует двух совершенно одинаковых людей, за исключением однояйцовых близнецов. Причины этого многообразия нетрудно понять с генетических позиций.
Число хромосом у человека – 46 (23 пары). Если допустить, что родители отличаются по каждой паре хромосом лишь по одному гену, то общее количество возможных генотипических комбинаций – 223. На самом деле количество возможных комбинаций будет намного больше, так как в этом расчете не учтен перекрест между гомологичными хромосомами. Следовательно, уже с момента зачатия каждый человек генетически уникален и неповторим.
Половые хромосомы человека.Гены, находящиеся в половых хромосомах, называются сцепленными с полом. Явление сцепления генов, локализированных в одной хромосоме, известно под названием закона Моргана. В Х-хромосоме имеется участок, для которого в У-хромосоме нет гомолога. Поэтому у особи мужского пола признаки, определяемые генами этого участка, проявляются даже в том случае, если они рецессивны. Эта особая форма сцепления позволяет объяснить наследование признаков, сцепленных с полом, например цветовой слепоты, раннего облысения и гемофилии у человека. Гемофилия – сцепленный с полом рецессивный признак, при котором нарушается свертывание крови. Ген, детерминирующий этот процесс, находится в участке Х-хромосомы, не имеющем гомолога, и представлен двумя аллелями – доминантным нормальным и рецессивным мутантным.
Особи женского пола, гетерозиготных по рецессиву или по доминанту, называют носителем соответствующего рецессивного гена. Они фенотипически нормальны, но половина их гамет несет рецессивный ген. Несмотря на наличие у отца нормального гена, сыновья матерей-носителей с вероятностью 50% будут страдать гемофилией.
Свойства человеческого генома: Мутабельность.Изменчивость организмов является одним из главных факторов эволюции. Она служит основным источником для отбора форм, наиболее приспособленных к условиям существования.
Изменчивость является сложным процессом. Обычно биологи делят ее на наследственную и ненаследственную. К наследственной изменчивости относят такие изменения признаков и свойств организмов, которые при половом размножении не исчезают, сохраняются в ряду поколений. К ненаследственной изменчивости – модификациям, или флюктуациям, относят изменения свойств и признаков организма, которые возникают в процессе его индивидуального развития под влиянием факторов внешней среды, сложившейся специфическим образом для каждого индивидуума, и при половом размножении не сохраняются.
Наследственная изменчивость представляет собой изменение генотипа, ненаследственная – изменение фенотипа организма.
Термин «мутация» впервые был предложен Гуго де Фризом в его классическом труде «Мутационная теория» (1901 – 1903). Мутацией он называл явление скачкообразного, прерывного изменения наследственного признака. Основные положения теории Г. де Фриза до сих пор не утратили своего значения, и поэтому их следует здесь привести:
1) мутация возникает внезапно, без всяких переходов;
2) новые формы вполне константны, т.е. устойчивы;
3) мутации в отличие от ненаследственных изменений (флюктуаций) не образуют непрерывных рядов, не группируются вокруг среднего типа (моды). Мутации являются качественными изменениями;
4) мутации идут в разных направлениях, они могут быть как полезными, так и вредными;
5) выявление мутаций зависит от количества особей, проанализированных для обнаружения мутаций.
6) Одни и те же мутации могут возникать повторно.
Однако Г. де Фриз допустил принципиальную ошибку, противопоставив теорию мутаций теории естественного отбора. Он неправильно считал, что мутации могут сразу давать новые виды, приспособленные к внешней среде, без участия естественного отбора. На самом деле мутации являются лишь источником наследственных изменений, служащих материалом для естественного или искусственного отбора.
термин "ген" был впервые применен для обозначения наследственно-обусловленного признака Иогансеном в 1911 г. Связь между геном и белком, структура которого определяется структурой гена впервые была сформулирована в виде гипотезы "1 ген - 1 фермент" Бидлом и Татумом. Прямые доказательства того, что мутации гена человека вызывают изменение в первичной структуре белков получены в 1949 г. Полингом при исследовании наследственных гемоглобинопатий. Исследую первичную структуру гемоглабина, выделенного из эритроцитов больных с серповидно клеточной анемией Полинг показал, что подвижность аномального гемоглобина в электрическом поле (электрофорез) изменена по сравнению с нормальной. Далее им было установлено, что этот эффект связан с заменой аминокислоты валина на глютаминовую кислоту. С этого открытия началась новая эра открытий в человеческой биохимической генетики наследственных болезней обмена. Они вызываются мутациями генов , которые продуцируют белки с аномальной структурой, что приводит к изменению их функций.
Большинство организмов хранят генетическую информацию в ДНК - линейном полимере, состоящем из 4ех различных мономерных единиц - дезоксирибонуклеотидами, которые сцеплены друг с другом в цепь фосфодиэфирными связями. Как было доказано Уотсоном и Криком, Типичная молекула ДНК состоит из 2ух плинуклеотидных цепей, каждая из которых содержит от нескольких тысяч до нескольких миллионов молекул. Каждый нуклеотид в одной цепи специфически связан водородной связью с нуклеотидом другой цепи. Только 2 типа спаривания нуклеотидов найдены в ДНК: дезоксиаденозинмонофосфат с тимидинмонофосфатом (А-Т пара) и дезоксигуанидинмонофосфат с дезоксицитидинмонофосфатом (Г-Ц пара). Таким образом последовательность нуклеотидов одной цепи точно определяет последовательность в другой, и обе цепи являются комплиментарными одна другой. Последовательность четырех нуклеотидов вдоль полинуклеотидной цепи варьирует среди ДНК неродственных организмов и является молекулярной базой их генетического расхождения. Поскольку большинство наследственных характеристик стабильно передается от родителей к потомству, последовательность нуклеотидов в ДНК должна точно копироваться при репродукции организма. Это имеет место в обеих цепях. Последовательность нуклеотидов и отсюда генетическая информация консервируется в ходе процесса репликации. Так как каждый нуклеотид в дочерних цепях спарен специфически с комплиментарным нуклеотидом в родительских или матричных цепях до того, как произойдет процесс полимеризации. ДНК высших организмов регулярно упаковано в структуру, называемую хромосомами, состоящих из нуклеопротеиновых элементов (нуклеосом). Хромосомы отделены от всех других клеточных компонентов ядерной мембраной. Каждый из нуклеосомных элементов состоит из четырех, иногда пяти белковых субъединиц, называемых гистонами, которые образуют стержневую структуру, вокруг которого "наматывается" примерно 140 пар нуклеотидов геномной ДНК. Структура гистонов характеризуется высокой консервативностью в царстве эукариотов. Двуспиральная модель ДНК определяет способ, путем которого гены могут быть реплицированы для передачи потомства. Процесс репликации является сложным, но концептуально простым. Две нити ДНК разделяются, и каждая копируется серией ферментов, которые вставляют комплиментарные основания напротив каждого основания на исходной (родительской) цепи ДНК. Таким образом две идентичные двойные спирали образуются из одной – в этом состоит процесс репликации. ДНК "делает" РНК, этот процесс называется транскрипцией, а РНК "делает" белок, этот процесс называется трансляцией. Последовательность основания в специфическом гене ультимативно диктует последовательность аминокислот в специфическом белке это коллинеарность между молекулой ДНК и белком достигается посредством генетического кода. Четыре типа оснований ДНК собранные в группы из трех образует триплет, каждый из которых образует кодовое слово, или кодон, который определяет включение одной аминокислоты в структуру кодируемого белка, таким способом определяется включение каждой из 20 аминокислот, которые встречаются в белках. 64 различных триплета существуют для 20 аминокислот, что определяет свойства генетического кода. Таким образом большинство аминокислот определяется более чем одним кодоном, но каждый кодон полностью специфичен.
Хотя в настоящее время вопрос о природе гена выяснен не окончательно, тем не менее прочно установлен ряд общих закономерностей мутирования гена. Мутации генов возникают у всех классов и типов животных, высших и низших растений, многоклеточных и одноклеточных организмов, у бактерий и вирусов. Мутационная изменчивость как процесс качественных скачкообразных изменений является всеобщей для всех органических форм.
Свойства человеческого генома: Изменчивость.Изменчивостью называют всю совокупность различий по тому или иному признаку между организмами, принадлежащими к одной и той же природной популяции или виду. Поразительное морфологическое разнообразие особей в пределах любого вида привлекло внимание Дарвина и Уоллеса во время их путешествий. Закономерный, предсказуемый характер передачи таких различий по наследству послужил основой для исследований Менделя. Дарвин установил, что определенные признаки могут развиваться в результате отбора, тогда как Мендель объяснил механизм, обеспечивающий передачу из поколения в поколение признаков, по которым ведется отбор.
Мендель описал, каким образом наследственные факторы определяют генотип организма, который в процессе развития проявляется в структурных, физиологических и биохимических особенностях фенотипа. Если фенотипическое проявление любого признака обусловлено в конечном счете генами, контролирующими этот признак, то на степень развития определенных признаков может оказывать влияние среда.
Изучение фенотипических различий в любой большой популяции показывает, что существуют две формы изменчивости - дискретная и непрерывная. Для изучения изменчивости какого-либо признака, например роста у человека, необходимо измерить этот признак у большого числа индивидуумов в изучаемой популяции. Результаты измерений представляют в виде гистограммы, отражающей распределение частот различных вариантов этого признака в популяции. На рис. 4 представлены типичные результаты, получаемые при таких исследованиях, и они наглядно демонстрируют различие между дискретной и непрерывной изменчивостью.
Дискретная изменчивостьНекоторые признаки в популяции представлены ограниченным числом вариантов. В этих случаях различия между особями четко выражены, а промежуточные формы отсутствуют; к таким признакам относятся, например, группы крови у человека, длина крыльев у дрозофилы, меланистическая и светлая формы у березовой пяденицы (Biston betularia), длина столбика у первоцвета (Primula) и пол у животных и растений. Признаки, для которых характерна дискретная изменчивость, обычно контролируются одним или двумя главными генами, у которых может быть два или несколько аллелей, и внешние условия относительно мало влияют на их фенотипическую экспрессию.
Поскольку дискретная изменчивость ограничена некоторыми четко выраженными признаками, ее называют также качественной изменчивостью в отличие от количественной, или непрерывной, изменчивости.
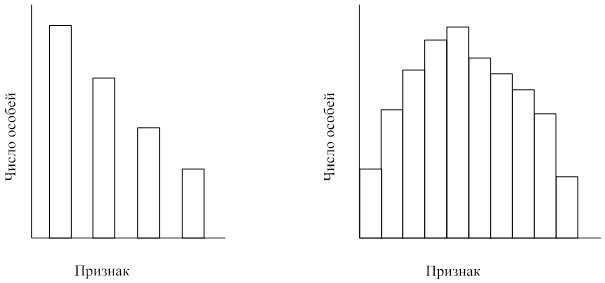
А Б
Рисунок 1. Гистограммы, отражающие распределение частот в случае прерывистой (А) и не прерывистой (Б) изменчивости.
Непрерывная изменчивостьПо многим признакам в популяции наблюдается полный ряд переходов от одной крайности к другой без всяких разрывов. Наиболее яркими примерзлая служат такие признаки, как масса (вес), линейные размеры, форма и окраска организма в целом или отдельных его частей. Частотное распределение по признаку, проявляющему непрерывную изменчивость, соответствует кривой нормального распределения. Большинство членов популяции попадает в среднюю часть кривой, а на ее концах, соответствующих двум крайним значениям данного признака, находится примерное одинаковое (очень малое) число особей. Признаки, для которых характерна непрерывная изменчивость, обусловлены совместным воздействием многих генов (полигенов) и факторов среды. Каждый из этих генов в отдельности оказывает очень небольшое влияние на фенотип, но совместно они создают значительный эффект.
Влияние средыГлавный фактор, детерминирующий любой фенотипический признак, - это генотип. Генотип организма определяется в момент оплодотворения, но степень последующей экспрессии этого генетического потенциала в значительной мере зависит от внешних факторов, воздействующих на организм во время его развития. Так, например, использованный Менделем сорт гороха с длинным стеблем обычно достигал высоты 180 см. Однако для этого ему необходимы были соответствующие условия - освещение, снабжение водой и хорошая почва. При отсутствии оптимальных условий (при наличии лимитирующих факторов) ген высокого стебля не мог в полной мере проявить свое действие. Эффект взаимодействия генотипа и факторов среды продемонстрировал датский генетик Иогансен. В ряде экспериментов на карликовой фасоли он выбирал из каждого поколения самоопылявшихся растений самые тяжелые и самые легкие семена и высаживал их для получения следующего поколения. Повторяя эти эксперименты на протяжении нескольких лет, он обнаружил, что в пределах «тяжелой» или «легкой» селекционной линии семена мало различались по среднему весу, тогда как средний вес семян из разных линий сильно различался. Это позволяет считать, что на фенотипическое проявление признака оказывают влияние как наследственность, так и среда. На основании этих результатов можно определить непрерывную фенотипическую изменчивость как «кумулятивный эффект варьирующих факторов среды, воздействующих на вариабельный генотип». Кроме того, эти результаты показывают, что степень наследуемости данного признака определяется в первую очередь генотипом. Что касается развития таких чисто человеческих качеств, как индивидуальность, темперамент и интеллект, то, судя по имеющимся данным, они зависят как от наследственных, так и от средовых факторов, которые, взаимодействуя в различной степени у разных индивидуумов, влияют на окончательное выражение признака. Именно эти различия в тех и других факторах создают фенотипические различия между индивидуумами. Мы пока еще не располагаем данными, которые твердо указывали бы на то, что влияние каких-то из этих факторов всегда преобладает, однако среда никогда не может вывести фенотип за пределы, детерминированные генотипом.
Источники изменчивостиНеобходимо ясно представлять себе, что взаимодействие между дискретной и непрерывной изменчивостью и средой делает возможным существование двух организмов с идентичным фенотипом. Механизм репликации ДНК при митозе столь близок к совершенству, что возможности генетической изменчивости у организмов с бесполым размножением очень малы. Поэтому любая видимая изменчивость у таких организмов почти наверное обусловлена воздействиями внешней среды. Что же касается организмов, размножающихся половым путем, то у них есть широкие возможности для возникновения генетических различий. Практически неограниченными источниками генетической изменчивости служат два процесса, происходящие во время мейоза:
1. Реципрокный обмен генами между хромата- дамп гомологичных хромосом, который может происходить в профазе 1 мейоза. Он создает новые группы сцепления, т.е. служит важным источником генетической рекомбинации аллелей.
2. Ориентация пар гомологичных хромосом (бивалентов) в экваториальной плоскости веретена в метафазе I мейоза определяет направление, в котором каждый член пары будет перемещаться в анафазе I. Эта ориентация носит случайный характер. Во время метафазы II пары хроматид опять- таки ориентируется случайным образом, и этим определяется, к какому из двух противоположных полюсов направится та или иная хромосома во время анафазы II. Случайная ориентация и последующее независимое расхождение (сегрегация) хромосом делают возможным большое число различных хромосомных комбинаций в гаметах; число это можно подсчитать.
Третий источник изменчивости при половом размножении - это то, что слияние мужских и женских гамет, приводящее к объединению двух гаплоидных наборов хромосом в диплоидном ядре зиготы, происходит совершенно случайным образом (во всяком случае, в теории); любая мужская гамета потенциально способна слиться с любой женской гаметой.
Эти три источника генетической изменчивости и обеспечивают постоянную «перетасовку» генов, лежащую в основе происходящих все время генетических изменений. Среда оказывает воздействие на весь ряд получающихся таким образом фенотипов, и те из них, которые лучше всего приспособлены к данной среде, преуспевают. Это ведет к изменениям частот аллелей и генотипов в популяции. Однако эти источники изменчивости не порождают крупных изменений в генотипе, которые необходимы, согласно эволюционной теории, для возникновения новых видов. Такие изменения возникают в результате мутаций.
Наследственные болезни (диагностика, профилактика, лечение)Известное общее положение о единстве внутреннего и внешнего в развитии и существовании нормального и больного организмов не теряет своего значения применительно к наследственным, передающимся от родителей к детям, болезням, как бы ни казались такие болезни заранее детермированным патологическими наследственными задатками. Однако это положение требует более детального разбора, поскольку оно не столь однозначно по отношению к разным формам наследственных болезней и в то же время применимо в определенной степени даме к таким формам патологии, которые кажутся обусловленными только болезнетворными факторами внешней среды. Наследственность и среда оказываются этиологическими факторами или играют роль в патогенезе любого заболевания человека, но доля их участия при каждой болезни своя, причем чем больше доля одного фактора, тем меньше другого. Все формы патологии с этой точки зрения можно разделить на четыре группы, между которыми нет резких границ.
Первую группу составляют собственно наследственные болезни, у которых этиологическую роль играет патологический ген, роль среды заключается в модификации лишь проявлений заболевания. В эту группу входят моногенно обусловленные болезни (такие как, например, фенилкетонурия, гемофилия), а также хромосомные болезни.
Вторая группа - это тоже наследственные болезни, обусловленные патологической мутацией, однако для их проявления необходимо специфическое воздействие среды. В некоторых случаях такое "проявляющее" действие среды очень наглядно, и с исчезновением действия средового фактора клинические проявления становятся менее выраженными. Таковы проявления недостаточности гемоглобина HbS у его гетерозиготных носителей при пониженном парциальном давлении кислорода. В других случаях (например, при подагре) для проявления патологического гена необходимо длительное неблагоприятное воздействие среды (особенности питания) .
Третью группу составляет подавляющее число распространенных болезней, особенно болезней зрелого и преклонного возраста (гипертоническая болезнь, язвенная болезнь желудка, большинство злокачественных образований и др.). Основным этиологическим фактором в их возникновении служит неблагоприятное воздействие среды, однако, реализация действия фактора зависит от индивидуальной генетически детерминируемой предрасположенности организма, в связи с чем эти болезни называют мультифакториальными, или болезнями с наследственным предрасположением. Необходимо отметить, что разные болезни с наследственным предрасположением неодинаковы по относительной роли наследственности и среды. Среди них можно было бы выделить болезни со слабой, умеренной и высокой степенью наследственного предрасположения.
Четвертая группа болезней - это сравнительно немногие формы патологии, в возникновении которых исключительную роль играет фактор среды. Обычно это экстремальный средовой фактор, по отношению к действию которого организм не имеет средств защиты (травмы, особо опасные инфекции). Генетические факторы в этом случае играют роль в течении болезни, влияют на ее исход.
Рассмотрим более подробно все эти четыре группы.
К хромосомным болезням относят формы патологии, которые клинически выражаются множественными пороками развития, а в качестве генетической основы имеют отклонения от нормального содержания в клетках организма количества хромосомного материала, т.е. обусловлены геномными или хромосомными мутациями.
Большинство хромосомных болезней являются спорадическими, возникающими заново вследствие геномной (хромосомной) мутации в гамете здорового родителя или в первых делениях зиготы, а не наследуемыми в поколениях, что связано с высокой смертностью больных в дорепродуктивном периоде. Фенотипическую основу хромосомных болезней составляют нарушения раннего эмбрионального развития. Поэтому патологические изменения складываются еще в пренатальном периоде развития организма и либо обусловливают гибель эмбриона или плода, либо создают основную клиническую картину заболевания уже у новорожденного. Роль хромосомной патологии в пренатальной гибели эмбрионов или плодов у человека велика. В среднем около 40% диагностируемых спонтанных абортов обусловлены хромосомным дисбалансом. Около 6% всех мертворожденных имеют хромосомные изменения. На 1000 живорожденных младенцев 3-4 имеют хромосомные болезни. Если все случаи множественных пороков развития среди новорожденных принять за 100%, то 35-40% будут составлять вызванные нарушением состояния хромосом.
Все хромосомные болезни по этому признаку можно разделить на две большие группы: вызванные изменением числа хромосом при сохранении структуры последних (геномные мутации) и обусловленные изменением структуры хромосомы (хромосомные мутации). У человека описаны все известные виды мутаций обоих типов.
Численные нарушения могут состоять в изменении плоидности хромосомного набора и в отклонении числа хромосом от диплоидного по каждой их паре в сторону уменьшения (моносомия) или увеличения (полисемия). Геномные мутации по отдельным хромосомам многочисленны, они составляют основную массу хромосомных болезней. Полные моносомии наблюдаются по Х-хромосоме, приводя к развитию синдрома Шэрешевского-Тернера.
Этот синдром развивается при полной Х-моносомии, когда все клетки или их большинство имеют хромосомный набор. К Клиническими проявлениями этого синдрома являются отсутствие у женщин обычных вторичных половых признаков, низкий рост, сближенные соски, нарушения скелета, бесплодие, разнообразные пороки внутренних органов.
Наиболее полно изучена трисомия по 21-ой хромосоме или, как ее еще называют, болезнь Дауна. Эта аномалия, названная так по имени врача, впервые описавшего ее в 1866 году, вызывается не расхождением хромосом.
К числу ее симптомов относятся задержка умственного развития, пониженная сопротивляемость болезням, врожденные сердечные аномалии, короткое коренастое туловище и толстая шея, а также характерные складки кожи над внутренними углами глаз, что создает внешнее сходство с представителями монголоидной расы. Синдром Дауна и другие сходные аномалии чаще встречаются у детей, рожденных немолодыми женщинами. Точная причина этого неизвестна, но, по-видимому, она как-то связана с возрастом яйцеклеток матери. Число Х-хромосом у индивида может доходить до 5 с сохранением его жизнеспособности.
Структурные перестройки хромосом, какого бы вида они ни были, вызывают нарушения развития организма вследствие или недостатка части материала по данной хромосоме (частичная моносомия) или его избытка (частичная трисомия).
Как пример можно привести Х-полисомию при отсутствии У-хромосомы. Такие организмы имеют хромосомный набор 47,XXX и хотя внешне женщины выглядят нормально и они плодовиты, но у них отмечается умственная отсталость.
При синдроме Клайнфельтера (47,ХХУ) мужчина обладает некоторыми вторичными женскими подовыми признаками, бесплоден, яички слабо развиты, волос на лице мало, иногда развиваются молочные железы, обычно низкий уровень умственного развития.
При хромосомном наборе 47.ХУУ мужчины имеют высокий рост, различный уровень умственного развития, иногда обладают психопатическими чертами или проявляют склонность к мелким правонарушениям.
Генные болезни делятся на две большие группы: болезни с выясненным первичным биохимическим дефектом и болезни с невыясненным первичным биохимическим дефектом. К первой группе принадлежат наследственные болезни обмена веществ, биосинтеза белка, ферментов.
Примером наследственных дефектов обмена углеводов является галактоземия. Одним из путей обмена моносахаридов в организме является превращение 0-галактозы, которая поступает в организм с пищей (образуется в кишечнике при ферментивном гидролизе пищевой лактозы), в 0"глюкозу. Процесс превращения состоит из нескольких этапов и может прерваться при недостаточности фермента галактоэо-1-фосфатуридилтрансфераэы. Чаще всего мутация ведет к недостаточной активности фермента (10-12% нормального уровня). Биохимический патогенез болезни включает накопление галактозы в разных тканях и в крови, что ведет к нарушению использования глюкозы в печени, почках и головном мозгу. Галактоземия встречается среди новорожденных с частотой 1 на 35-150 тыс. рождений. Заболевание развивается после рождения при вскармливании младенца, поскольку с молоком поступает лактоза - источник неметаболируемой галактозы. В результате у ребенка возникают рвота и понос, приводящие к обезвоживанию организма, и постепенное развитие умственной отсталости на фоне общей дистрофии. Если с помощью соответствующей диеты, в которой предусмотрено полное исключение молочного сахара, ребенок поправляется, в дальнейшем с возрастом появляется второй метаболический путь превращения галактозы в глюкозу - при участии фермента уридилтрансфераэы.
Наследственные аминоацидопатии (наследственные дефекты обмена аминокислот) составляют самую большую группу наследственных дефектов обмена. К началу 1985 года их список насчитывал около 60 различных нозологических единиц, и хотя каждая из них встречается редко (1:20000 - 1:100000 новорожденных) , в сумме они составляют значительную часть наследственных дефектов обмена.
Фенилкетонурия. Клинически эта болезнь была впервые описана в 1934 году, однако лишь спустя 19 лет было установлено, что этот наследственный дефект связан с недостаточностью фенилаланин-4-гидроксилаэы. В норме избыток фенилаланина, поступившего с пищей и не использованного для синтеза белка, с помощью указанного фермента превращается в тирозин. У больных фенилкетонурии эта аминокислота накапливается в крови. Повышение уровня содержания фенилаланина само по себе не опасно, но оно стимулирует необычные реакции, в результате которых в организме накапливается кетопроизводные фенилаланина. Они и вызывают повреждения нервной ткани у новорожденных и развитие умственной отсталости в дальнейшем. Поэтому если вовремя обнаружить наличие этой болезни и исключить из пищи фенилаланин, ребенок будет развиваться нормально. Существует несколько методов диагностики фенилкетонурии. Наибольшее распространение получили микробиологические тесты.
Витамины выполняют роль кофакторов, простетических групп, многих ферментов. Недостаточное поступление их с пищей резко снижает активность соответствующих обменных процессов. Возникающие при этом заболевания называют авитаминозом и легко лечат с помощью введения в организм недостающих витаминов. Однако существуют витаминонезависимые авитаминозы, при которых такие меры не оказывают эффекта. Причины таких заболеваний, а они, как правило, являются наследственными, были раскрыты после тщательного изучения метаболизма витаминов. Прежде чем выступить в качестве кофермента, витамин специальными транспортными белками должен быть извлечен из кишечника и переправлен в кровяное русло. Там он подвергается ферментативной модификации и только потом может связаться с апоферментом (если его структура не изменена), превратив его в активный фермент. Каждый из генов, кодирующих белки, ответственные за эти превращения, может быть инактивирован соответствующей мутацией. Эти генетические нарушения порождают заболевания, для лечения которых необходимо вводить в организм готовые коферменты. Разработка методов лечения должна базироваться на точном знании путей метаболизма данного витамина. Самая трудная ситуация возникает при поражении апофермента. Сейчас нет эффективных способов, позволяющих справиться с такой патологией.
Примером наследственных дефектов циркулирующих белков является серповидно-клеточная анемия. Белковая часть любых гемоглобинов (НЬ) человека состоит из двух цепей глобина, причем каждый построен из двух полипептидных цепей. Гемоглобин человека построен из двух альфа- и двух бетацепей. При серповидно-клеточной анемии валин в бета-положении заменяется на глуталиновую кислоту. Эта замена обуславливает пониженную растворимость гемоглобина. Гетерозиготные носители НЬS в обычных условиях клинически здоровы, т. к. в крови содержится и нормальный HbA; аномалия начинает проявлять себя лишь в условиях пониженного давления (в горах). У гомозигот с ранних лет развивается характерная картина хронической анемии с расстройствами кровообращения и тромбозами. Гемоглобин HbS часто обнаруживается у населения регионов, где распространена малярия, так как он является нечувствительным к малярийному плазмодию.
Примером наследственной болезни с невыясненным первичным биохимическим дефектом является ахондроплазия. Она представляет собой пример наследственной болезни с твердо установленным доминантным типом наследования. Однако из-за резко сниженной способности больных иметь потомство практически в 80-95% случаев это заболевание связано с новыми возникающими мутациями.
Ахондроплаэия - одна из наследственных болезней костной системы клиническая картина ее обусловлена аномальным ростом и развитием хрящевой ткани, главным образом в эпифизах трубчатых костей и основания черепа. О биохимической природе этой болезни ничего не известно, если не считать сведений о различных отклонениях в активности ряда ферментов, значение которых остается пока невыясненным.
Патология роста указанных костей определяет характерную клиническую картину, полностью вырешенную у больных в половозрелом возрасте: 1) низкий рост (обычно до 120 см) при сохранении нормальной длины туловища; 2) макроцефалия, бугристая мозговая часть черепа и характерное лицо; 3) резкое укорочение верхних и нижних конечностей, особенно за счет бедренной и плечевой кости, с их деформацией и утолщением.
К мультифакториальным, или болезням с наследственным предрасположением относится шизофрения. Она занимает среди эндогенных функциональных психозов ведущее место по частоте (более 1%). Семейный характер заболеваемости шизофренией и участие наследственных факторов в ее этиологии давно не вызывает сомнений, однако, как и для других болезней с наследственным предрасположением, генетическая природа предрасположения остается до конца не расшифрованной. В последние годы генетические закономерности шизофрении активно изучались советскими исследователями под руководством М. Е. Вартаняна, и эти исследования продолжаются и поныне.
Как уже подчеркивалось, по мере развития медицины наследственные заболевания составляют все большую долю в общей патологии человека. Большинство наследственных болезней имеет хроническое течение, вследствие чего повторная обращаемость таких больных высока. В то же время, как показывает анализ контингента больных, наследственные формы диагностируются не всегда даже в клинических условиях. В определенной степени это понятно, поскольку диагностика наследственной патологии - это очень сложный и трудоемкий процесс.
Трудности диагностики обусловлены прежде всего тем, что нозологические формы наследственных болезней очень многообразны (около 2000) и каждая из них характеризуется большим разнообразием клинической картины. Так, в группе нервных болезней известно более 200 наследственных форм, а в дерматологии их более 250. Некоторые формы встречаются крайне редко, и врач в своей практике может не встретиться с ними. Поэтому он должен знать основные принципы, которые помогут ему заподозрить нечасто встречающиеся наследственные заболевания, а после дополнительных консультаций и обследований поставить точный диагноз.
Диагностика наследственных болезней основывается на данных клинического, параклинического и специального генетического обследования.
При общем клиническом обследовании любого больного постановка диагноза должна завершиться одним из трех заключений:
1. четко поставлен диагноз ненаследственного заболевания;
2. четко поставлен диагноз наследственного заболевания;
3. имеется подозрение, что основная или сопутствующая болезнь является наследственной.
Первые два заключения составляют подавляющую часть при обследовании больных. Третье заключение, как правило, требует применения специальных дополнительных методов обследования, которые определяются врачом-генетиком.
Полного клинического обследования, включая параклиническое, обычно достаточно для диагностики такого наследственного заболевания, как ахондроплаэия.
В тех случаях, когда диагноз больному не поставлен и необходимо уточнить его, особенно при подозрении на наследственную патологию, используют следующие специальные методы:
1. Подробное клинико-генеалогическое обследование проводится во всех случаях, когда при первичном клиническом осмотре возникает подозрение на наследственное заболевание. Здесь следует подчеркнуть, что речь идет о подробном обследовании членов семьи. Это обследование заканчивается генетическим анализом его результатов.
2. Цитогенетическое исследование может проводиться у родителей, иногда у других родственников и плода. Хромосомный набор изучается при подозрении на хромосомную болезнь для уточнения диагноза. Большую роль цитогенетического анализа составляет пренатальная диагностика.
3. Биохимические методы широко применяются в тех случаях, когда имеется подозрение на наследственные болезни обмена веществ, на те формы наследственных болезней, при которых точно установлены дефект первичного генного продукта или патогенетическое звено развития заболевания.
4. Иммуногенетические методы применяют для обследования пациентов и их родственников при подозрении на иммунодефецитные заболевания, при подозрении на антигенную несовместимость матери и плода, при установлении истинного родительства в случаях медико-генетического консультирования или для определения наследственного предрасположения к болезням.
5. Цитологические методы применяются для диагностики пока еще небольшой группы наследственных болезней, хотя возможности их достаточно велики. Клетки от больных можно исследовать непосредственно или после культивирования цитохимическими, радиоавтографическими и другими методами.
6. Метод сцепления генов применяется в тех случаях, когда в родословной имеется случай заболевания и надо решить вопрос, унаследовал ли пациент мутантный ген. Это необходимо знать в случаях стертой картины заболевания или позднего его проявления.
Длительное время диагноз наследственной болезни оставался как приговор обреченности больному и его семье. Несмотря на успешную расшифровку формальной генетики многих наследственных заболеваний, лечение их оставалось лишь симптоматическим. Впервые С. Н. Давиденков еще в 30-х годах указал на ошибочность точки зрения о неизлечимости наследственных болезней. Он исходит из признания роли факторов внешней среды в проявлении наследственной патологии. Однако отсутствие сведений о патогенетических механизмах развития заболеваний в тот период ограничивало возможности разработки методов, и все попытки, несмотря на правильные теоретические установки, оставались длительное время эмпирическими. В настоящее время благодаря успехам генетики в целом (всех ее разделов) и существенному прогрессу теоретической и клинической медицины можно утверждать, что уже многие наследственные болезни успешно лечатся. Общие подходы к лечению наследственных болезней остаются теми же, что и подходы к лечению болезней другого происхождения. Тут можно выделить три подхода: симптоматическое, патогеническое, этиологическое.
Симптоматическое лечение применяют при всех наследственных болезнях, даже и там, где имеются методы патогенической терапии. Для многих форм патологии симптоматическое лечение является единственным.
Лекарственная симптоматическая терапия - наиболее часто используемый прием, разнообразный в зависимости от форм наследственных болезней: применение анальгина при наследственных формах мигрени, специфических транквилизаторов при психических заболеваниях, пилокарпина при глаукоме, специальных мазей при кожных болезнях и т. д. Успехи этого раздела терапии связаны с прогрессом фармакологии, обеспечивающей все более широкий выбор лекарств. О другой стороны, расшифровка патогенеза каждой болезни позволяет понять причину возникновения симптомов, а на этой основе лекарственная коррекция симптомов становится более тонкой. В качестве примера можно привести симптоматическое лечение муковисцидоза.
Когда было выяснено, что при муковисцидоэе образуется очень густая слизь в протоках эндокринных желез бронхов, то для облегчения состояния таким больным стали назначать вещества, разжижающие слизь (муколитические вещества).
Хирургическое симптоматическое лечение занимает существенное место в лечении наследственной патологии, особенно выражающейся в виде врожденных пороков развития или системных поражений скелета. Так, например, переливание крови при талассемиях, пластические операции при незаращении верхней губы, удаление катаракты - все это примеры симптоматического лечения.
В общей форме виды хирургической помощи больным с наследственной патологией могут быть трех видов: удаление (опухоли и др.); коррекция (незаращение верхней губы, врожденные пороки сердца и др.); трансплантация (комбинированная иммунная недостаточность и др.).
В некоторых случаях хирургическая помощь выходит за рамки симптоматического лечения, приближаясь по своему характеру к патогенетическому.
Многие виды физических методов лечения (теплолечение, разные виды электротерапии и др.) применяются при наследственных заболеваниях нервной системы, наследственных болезнях обмена веществ, заболеваниях скелета. К симптоматическому лечению можно отнести и рентгенорадиологическое облучение при наследственно обусловленных опухолях до и после хирургического вмешательства.
Возможности симптоматического лечения для многих болезней еще далеко не исчерпаны, особенно в области лекарственной, диетической и хирургической помощи.
Лечение многих болезней по принципу вмешательства в патогенез болезней всегда эффективнее симптоматического. Однако следует понимать, что ни один из существующих ныне методов не устраняет причину заболевания, так как не восстанавливает структуру поврежденных генов. Действие каждого из них продолжается сравнительно короткое время, поэтому лечение должно быть непрерывным. Кроме того, приходиться признать ограниченность возможностей современной медицины: еще многие наследственные болезни не поддаются эффективному купированию. Особые надежды в связи с этим возлагают на использование методов генной инженерии для введения нормальных, неизмененных генов в клетки больного человека. Таким путем можно будет добиться кардинального излечения данного больного, но, однако это дело будущего.
В настоящее время существуют следующие основные направления терапии наследственных болезней.
1. Полное или частичное устранение из пищи субстрата или предшественника субстрата блокированной метаболической реакции. Этот прием используется в случаях, когда избыточное накопление субстрата оказывает токсичное действие на организм. Иногда (особенно когда субстрат не является жизненнонеобходимым и может синтезироваться в достаточном количестве обходными путями) такая диетотерапия оказывает очень хороший эффект. Типичный пример - галактоземия. Несколько сложнее дело обстоит при фенилкетонурии. Фенилаланин - незаменимая аминокислота, поэтому ее нельзя полностью исключать из пищи, а надо индивидуально подбирать для больного минимально необходимую дозу фенилаланина.
2. Восполнение кофакторов извне с целью повышения активности фермента. Чаще всего речь идет о витаминах. Дополнительное их введение больному с наследственной патологией дает положительный эффект, когда мутация нарушает способность фермента соединяться с активированной формой витамина при витаминчувствительных наследственных авитаминозах.
3. Нейтрализация и устранение экскреции токсических продуктов, накапливающихся в случае блокирования их дальнейшего метаболизма. К числу таких продуктов относится, например, медь при болезни Вильсона-Коновалова. Для нейтрализации меди больному вводят пеницилламин.
4. Искусственное введение в организм больного продукта блокированной у него реакции. Например, прием цитидиловой кислоты при оротоацидурии (заболевание, при котором страдает синтез пиримидинов) устраняет явления мегалобластической анемии.
5. Воздействие на "испорченные" молекулы. Этот метод применяется для лечения серповидно-клеточной анемии и направлен на уменьшение вероятности образования кристаллов гемоглобина 3. Ацетилсалициловая кислота усиливает ацетилирование HbS и таким путем снижает его гидрофобность, обусловливающую агрегацию этого белка.
6. Введение отсутствующего гормона или фермента. Первоначально этот метод был разработан и до сих пор успешно применяется для лечения сахарного диабета введением в организм больного инсулина. Позднее для подобных целей стали применять другие гормоны. Использование заместительной ферментотерапии, однако, несмотря на всю ее привлекательность, наталкивается на ряд трудностей: 1) далеко не во всех случаях имеется способ доставить фермент в нужные клетки и одновременно защитить его от деградации; 2) если синтез собственного фермента полностью подавлен, экзогенный фермент при длительном ведении инактивируется иммунной системой больного; 3) получение и очистка достаточного количества ферментов зачастую само по себе является сложной задачей.
7. Блокирование патологической активности ферментов с помощью специфических ингибиторов или конкурентное торможение аналогами субстратов данного фермента. Этот метод лечения применяется при избыточной активации систем свертывания крови, фибринолиза, а также при освобождении из разрушенных клеток лизосомальных ферментов.
Сопоставление молекулярных механизмов, поражаемых при наследственных заболеваниях, с используемыми для их лечения терапевтическими методами показывает , что еще далеко не все основные симптомы генетически обусловленных болезней человека в настоящее время могут быть устранены. Можно надеяться, что дальнейшее изучение молекулярных процессов, лежащих в основе наследственных заболеваний, в будущем приведет к значительному расширению арсенала методов лечения.
Несмотря на успехи симптоматического и патогенетического лечения наследственных болезней, вопрос о возможности их этиологического лечения не снимается. И чем больше будет прогресс теоретической биологии, тем чаще будет подниматься вопрос о радикальном, т. е. этиологическом, лечении наследственных болезней.
Этиологическое лечение любых наследственных болезней является наиболее оптимальным, поскольку оно устраняет первопричину заболевания и полностью излечивает его. Однако устранение причины наследственного заболевания означает такое серьезное "маневрирование" с генетической информацией в живом организме человека, как "включение" нормального гена (или подсадку его), "выключение" мутантного гена, обратная мутация патологического аллеля. Эти задачи достаточно трудны даже для манипулирования с прокариотами. К тому же, чтобы провести этиологическое лечение какого-либо наследственного заболевания, надо изменить структуру ДНК не в одной клетке, а во всех функционирующих клетках (и только функционирующих!). Прежде всего, для этого нужно знать, какое изменение в ДНК произошло при мутации, т.е. наследственная болезнь должна быть записана в химических формулах. Сложности этой задачи очевидны, хотя методы для их решения уже имеются в настоящее время.
Принципиальная схема для этиологического лечения наследственных заболеваний как бы составлена. Например, при наследственных болезнях, сопровождающихся отсутствием активности фермента (альбинизм, фенилкетонурия), необходимо синтезировать данный ген и ввести его в клетки функционирующего органа. Выбор способов синтеза гена и его доставки в соответствующие клетки широкий, и они будут пополняться с прогрессом медицины и биологии. Вместе с тем необходимо отметить важность соблюдения большой осторожности при применении методов (именно при применении, а не при разработке? ) генетической инженерии для лечения наследственных болезней, даже если будут сделаны решительные прорывы в синтезе соответствующих генов и способах их доставки в клетки-мишени. Генетика человека еще не располагает достаточными сведениями обо всех особенностях функционирования генетического аппарата человека. Пока еще неизвестно, как он будет работать после введения дополнительной генетической информации. Есть еще и другие нерешенные вопросы, которые не позволяют предполагать" быстрое применение методов этиологического лечения наследственных болезней.
Профилактика наследственной патологии в целом, несомненно, является важнейшим разделом современной медицины и организации здравоохранения. Речь при этом идет не просто о предотвращении, как правило, тяжелого заболевания у конкретного индивида, но и во всех его последующих поколениях. Именно из-за этой особенности наследственной патологии, сохраняющейся из поколения в поколение, в прошлом уже не раз предлагались методы профилактики, имеющие в своей основе евгенические подходы в одних случаях более гуманные, в других - менее. Только прогресс медицинской генетики принципиально изменил подходы к профилактике наследственной патологии; пройден путь от предложений стерилизации супругов или категорических рекомендаций воздержания от деторождения до пренатальной диагностики, профилактического лечения (лечение здоровых носителей патологических генов, предупреждающее развитие болезни) и индивидуально адаптивной среды для носителей патологических генов.
Наследственные болезни обмена.Одним из проявлений беспрецедентного прорыва в накоплении медико-генетической информации во второй половине XX в. явилось открытие большого числа новых наследственных болезней обмена (НБО) с примерной скоростью 100 новых единиц в 10 лет. Скорость их открытия, выраженная генетическая гетерогенность, клинический полиморфизм, низкая частота большинства из них чрезвычайно затрудняют утилизацию этой информации клиницистами в их диагностической практике, клинические проявления НБО столь многообразны, что нет такой медицинской специализации, которая бы не имела дела со своим специфическим спектром НБО. Между тем в отечественной медицине не имеется на сегодняшний день современного руководства по этому обширному классу заболеваний, НБО являются не только заболеваниями (преимущественно очень тяжелыми), требующими решения всего комплекса медицинских проблем – диагностики, лечения, профилактики. Они являются также уникальными биологическими моделями естественных ошибок метаболизма, которые являются бесценным инструментом познания сложнейшего метаболизма человека в норме. Именно на этих моделях в последние десятилетия была уяснена роль - как физиологическая, так и патологическая - огромного числа метаболитов, установлена множественная связь метаболических путей друг с другом, расшифрованы или уточнены многие метаболические пути.
Согласно современным концепциям медицинской генетики к наследственным болезням обмена веществ человека (синоним - "молекулярные болезни") относят обширный класс моногенно наследующихся заболеваний, обусловленных мутациями структурных генов, под контролем которых осуществляется синтез белков, выполняющих различные функции: структурные, транспортные, ферментного катализа, иммунной защиты. Исходя из того, что к 1988 году было известно около 4500 моногенных болезней человека (каталог Маккьюсика), а первичный биохимический дефект для первой НБО (метгемоглобинемия) был расшифрован только в 1946 года и в 1952 году - для второй (недостаточность глюкозо-6-фосфатазы при болезни Гирке) очевидно, что исследование НБО является бурно развивающейся ветвью современной медицинской генетики. На организменном уровне исследований НБО объектом изучения является клинико-биохимический фенотип больного, на клеточном – мутантные белки, на молекулярном – мутантные гены.
Исследования эволюции и полиморфизма на молекулярном уровне в течение последних 20 лет показали, что мутации в популяциях могут накапливаться, если их селективные недостатки невелики, по сравнению с частотой мутации.
На частоту и спектр мутантных аллелей по каждому гену в популяциях оказывают влияние следующие факторы: частота мутаций, естественный отбор, генный дрейф, миграции. По первому из этих факторов межпопуляционных различий не выявлено и трудно предположить их существование. Что же касается трех остальных факторов, то их влияние на генофонд разных популяций крайне неравномерно. Существование географических, языковых, родовых, национальных и других барьеров способствовало подразделенности населения земного шара и формированию региональных особенностей груза наследственной патологии, сказавшихся на частоте и спектре НБО. Для тех НБО. чья распространенность оценена с помощью достаточно достоверных методов, показано, что НБО характеризуются выраженной неравномерностью их этнического распространения, что проявляется и на генном и на аллельном уровне. Следует подчеркнуть, что в настоящее время распространенность большинства НБО либо не оценена, либо оценена приблизительно. Это объясняется рядом причин: свойствами НБО. затрудняющими их клиническую диагностику, отсутствием или дороговизной методических подходов и организационными трудностями, Разработан ряд организационно-методических подходов к оценке распространенности НБО, которые могут быть подразделены на косвенные и прямые.
Точные оценки распространенности НБО (прямые) были получены с помощью массового скрининга, массовый скрининг новорожденных позволил точно определить частоту фенилкетонурии, адреногенитального синдрома (21-гидроксилазной недостаточности), галактоземии. ряда аминоацидопатий и др. в большом числе регионов мира преимущественно с европеоидным населением (исключение составляет Япония). Другим подходом к оценке-распространенности НБО являются программы проспективного скрининга (разновидность массового) на выявление биохимическими методами гетерозиготных носителей некоторых некурабельных летальных или сублетальных НБО. распространенных с высокой частотой в ряде популяций. Таким образом была оценена частота болезни Тея-Сакса у евреев-ашкенази во многих странах мира и ряда гемоглобинопатий в странах средиземноморского региона и выходцев из них в Англии и США. В ряде стран образцы капиллярной крови новорожденных, полученные для массового скрининга, использовались для оценки частот НБО, на которые массовый скрининг не учрежден. Сопоставление частот между популяциями, между регионами одной популяции и между популяциями одной расы выявило большую разницу в распределении частот мутантных генов. Своеобразие генетико-автоматических процессов и особенности исторического развития отдельных популяций, по-видимому, объясняют это интересное явление. В литературе были сделаны попытки объяснить понижающийся градиент частот фенилкетонурии в странах Сев. Европы - от Ирландии до Финляндии -кельтским происхождением мутантного аллеля и связать его распространение с набегами викингов.
Летальные геныИзвестны случаи, когда один ген может оказывать влияние на несколько признаков, в том числе на жизнеспособность. У человека и других млекопитающих определенный рецессивный ген вызывает образование внутренних спаек легких, что приводит к смерти при рождении. Другим примером служит ген, который влияет на формирование хряща и вызывает врожденные уродства, ведущие к смерти плода или новорожденного.
У кур, гомозиготных по аллелю, вызывающему «курчавость» перьев, неполное развитие перьев влечет за собой несколько фенотипических эффектов. У таких кур теплоизоляция недостаточна, и они страдают от охлаждения. Для компенсации потери тепла у них появляется ряд структурных и физиологических адаптаций, но эти адаптации малоэффектны и среди таких кур высока смертность.
Воздействие летального гена ясно видно на примере наследования окраски шерсти у мышей. У диких мышей шерсть обычно серая, типа агути; но у некоторых мышей шерсть желтая. При скрещиваниях между желтыми мышами в потомстве получаются как желтые мыши, так и агути в отношении 2:1. Единственное возможное объяснение таких результатов состоит в том, что желтая окраска шерсти доминирует над агути и что все желтые мыши гетерозиготны. Атипичное менделевское отношение объясняется гибелью гомозиготных желтых мышей до рождения. При вскрытии беременных желтых мышей, скрещенных с желтыми же мышами, в их матках были обнаружены мертвые желтые мышата. Если же скрещивались желтые мыши и агути, то в матках беременных самок не оказывалось мертвых желтых мышат, поскольку при таком скрещивании не может быть потомства, гомозиготного по гену желтой шерсти.
Медико-генетическое консультирование.
Наиболее распространенным и эффективным подходом к профилактике наследственных болезней является медико-генетическая консультация. С точки зрения организации здравоохранения медико-генетическое консультирование - один из видов специализированной медицинской помощи. Суть консультирования заключается в следующем: 1) определение прогноза рождения ребенка с наследственной болезнью; 2) объяснение вероятности этого события консультирующимся; 3) помощь семье в принятии решения.
При большой вероятности рождения больного ребенка правильными с профилактической точки зрения могут быть две рекомендации: либо воздержание от деторождения, либо пренатальная диагностика, если она возможна при данной нозологической форме.
Первый кабинет по медико-генетическому консультированию был организован в 1941 году Дж. Нилом в Мичиганском университете (США). Больше того, еще в конце 50-х годов крупнейший советский генетик и невропатолог С. К Давиденков организовал медико-генетическую консультацию при Институте нервно-психиатрической профилактики в Москве. В настоящее время во всем мире насчитывается около тысячи генетических консультаций, в России их 80.
Основная причина, которая заставляет людей обращаться к врачу-генетику, - это желание узнать прогноз эдоровья будущего потомства относительно наследственной патологии. Как правило, в консультацию обращаются семьи, где имеется ребенок с наследственным или врожденным заболеванием (ретроспективное консультирование) или его появление предполагается (проспективное консультирование) в связи с наличием наследственных заболеваний у родственников, кровнородственным браком, возрастом родителей (старше 35-40 лет), облучением и по другим причинам.
Эффективность консультации как врачебного заключения зависит в основном от трех факторов: точности диагноза, точности расчета генетического риска и уровня понимания генетического заключения консультирующимися. По существу это три этапа консультирования.
Первый этап консультирования всегда начинается с уточнения диагноза наследственного заболевания. Точный диагноз является необходимой предпосылкой любой консультации. Он зависит от тщательности клинического и генеалогического исследования, от знания новейших данных по наследственной патологии, от проведения специальных исследований (цитогенических, биохимических, электрофизиологических, сцепления генов и т.д.).
Генеалогическое исследование является одним из основных методов в практике медико-генетического консультирования. Все исследования обязательно подтверждаются документацией. Информацию получают не меньше чем от трех поколений родственников по восходящей и боковой линии, причем данные должны быть получены обо всех членах семьи, включая и рано умерших.
В ходе генеалогического исследования может возникнуть необходимость направления объекта или его родственников на дополнительное клиническое обследование с целью уточнения диагноза.
Необходимость постоянного знакомства с новой литературой по наследственной патологии и генетике продиктована диагностическими потребностями (ежегодно открываются по несколько сотен новых генетических вариаций, в том числе аномалий) и профилактическими с целью выбора наиболее современных методов пренатальной диагностики или лечения.
Цитогенетическое исследование применяется не менее чем в половине консультируемых случаях. Это связано с оценкой прогноза потомства при установленном диагнозе хромосомного заболевания и с уточнением диагноза в неясных случаях при врожденных пороках развития.
Биохимические, иммунологические и другие клинические методы не являются специфическими для генетической консультации, но применяются так же широко, как и при диагностике ненаследственных заболеваний.
Второй этап консультирования - определение прогноза потомства. Генетический риск определяется двумя способами: 1)путем теоретических расчетов, основанных на генетических закономерностях с использованием методов генетического анализа и вариационной статистики; 2) с помощью эмпирических данных для мультифакториальных и хромосомных болезней, а также для заболеваний с неясным механизмом генетической детерминации. В некоторых случаях оба принципа комбинируются, т. е. в эмпирические данные вносятся теоретические поправки. Сущность генетического прогноза состоит в оценке вероятности появления наследственной патологии у будущих или уже родившихся детей. Консультирование по прогнозу потомства, как указывалось выше, бывает двух видов: проспективное и ретроспективное.
Проспективное консультирование - это наиболее эффективный вид профилактики наследственных болезней, когда риск рождения больного ребенка определяется еще до наступления беременности или в ранние ее сроки. Наиболее часто такие консультации проводятся в следующих случаях: при наличии кровного родства супругов; когда по линии мужа или жены имели место случаи наследственной патологии; при воздействии вредных средовых факторов на кого-либо из супругов незадолго до наступления беременности или в первые недели ее (лечебное или диагностическое облучение, тяжелые инфекции и ДР.)
ретроспективное консультирование - это консультирование после рождения больного ребенка в семье относительно здоровья будущих детей. Это наиболее частые причины обращения в консультации.
Методически определение прогноза потомства при заболеваниях с разным типом наследования различается. Если для моногенных (менделирующих) болезней теоретические основы оценки генетического риска достаточно четко разработаны, то для полигенных заболеваний, а тем более мультифакториальных, консультирование часто основано на чистом эмпиризме, отражающем недостаточную генетическую изученность данной патологии.
При менделируюших заболеваниях задача в основном сводится к лабораторной идентификации или вероятностной оценке у консультирующихся определенного дискретного генотипа, лежащего в основе заболевания.
При неменделируюших заболеваниях в настоящее время невозможно выделение специфических и дискретных патологических генотипов, обусловливающих развитие заболевания, поскольку в его формировании может участвовать множество генетических и средовых факторов, неспецифических по своим эффектам, т. е. один и тот же эффект (болезнь) может быть вызван разными генами и/или факторами внешней среды. Это и создает многочисленные трудности при генетическом анализе неменделируюших признаков и болезней.
Третий этап консультирования является заключительным. После постановки диагноза у объекта, обследования родственников, решения генетической задачи по определению генетического риска врач-генетик объясняет семье в доступной форме смысл генетического риска или сущность пренатальной диагностики и помогает ей в принятии решения.
Принято считать специфический генетический риск до 5% низким, до 10% - повышенным в легкой степени, до 20% - средним и выше 20% - высоким. Можно пренебречь риском, не выходящим за пределы повышенного в легкой степени, и не считать его противопоказанием к дальнейшему деторождению. Лишь генетический риск средней степени расценивается как противопоказание к зачатию или как показание к прерыванию уже имеющейся беременности, если семья не хочет подвергаться риску.
С социальной точки зрения целью генетического консультирования в целом является уменьшение частоты патологических генов в популяциях человека, а целью конкретной консультации - помощь семье в решении вопроса о возможности деторождения. При широком внедрении генетического консультирования может быть достигнуто некоторое уменьшение частоты наследственных болезней, а также смертности, особенно детской. Однако уменьшение частоты тяжелых доминантных заболеваний в популяциях в результате медико-генетического консультирования не будет существенным, потому что 80-90% из них составляют новые мутации.
Эффективность медико-генетического консультирования зависит от степени понимания консультирующихся той информации, которую они получили. Она зависит также от характера юридических законов в стране, относящихся к прерыванию беременности, социальному обеспечению больных и т. д.
Генетический мониторинг.
Загрязнение природной среды вредными отходами производства, продуктами неполного сгорания, ядохимикатами и другими мутагенами, повышение фона ионизирующей радиации, вызываемое испытаниями атомного оружия, бесконтрольным использованием химических и радиоактивных веществ в энергетике, промышленности, сельском хозяйстве – все это ведет к значительному увеличению генетических нарушений.
Генетический груз, подразумевающий собой эти генетические нарушения, подрывающие наследственное здоровье населения, растет. Так в СССР с восьмидесятого года рождалось 200 000 детей с серьезными генетическими дефектами и около 30 000 мертвых. Около 25% беременностей не донашивается по генетическим причинам. На данный момент у 10% всего населения существует нарушение психики. Увеличивается также число онкологических заболеваний. И при этом, в большинстве случаев, болезни связаны с загрязнением окружающей среды. По данным ВОЗ 80% болезней вызвано состоянием экологического напряжения. Поэтому проблемы генетики, экологии и адаптации человека становятся особенно острыми.
Наиболее целесообразным на данный момент для решения проблем экологии человека является использование мониторинга окружающей среды и социально-трудовой потенциал людей. Цель мониторинга заключается в выявлении физического, химического, биологического загрязнения окружающей среды. Мониторинг окружающей среды проводится на основе оценки структур здоровья населения в различных территориально-производственных комплексах. При этом нельзя считать полученные статистические данные абсолютно точными, так как они могут констатировать лишь рост заболеваний. Мешает также и отсутствие четких критериев здоровья и эффективных средств его оценки. Несомненно, мониторинг окружающей среды, а также другие методы решения экологических проблем так или иначе затрагивают генетику. А между тем, генетическое загрязнение нашей планеты опаснее всех других. Становится необходимым прогнозирование изменений роста заболеваний. Поэтому особое значение имеет генетический мониторинг, позволяющий проводить контроль за мутационным процессом у человека, выявлять и предотвращать всю возможность генетической опасности, связанную с еще необнаруженными мутагенами.
На данный момент, однако, исследования мутаций трудно осуществимы.
Возникшие трудности исследования мутаций прежде всего связаны с проблемой обнаружения их в организме человека. Так, например, дело обстоит с регистрацией рецессивной аномалии, так как такой мутантный ген проявляется в организме в гомозиготном состоянии, для достижения которого требуется некоторое время. Значительно проще дело обстоит с регистрацией доминантных генных и хромосомных мутаций, особенно, если их появление в фенотипе легко обнаружимо.
Благодаря биоэкологическому мониторингу через типизацию климатогеографических и производственных районов по структурам здоровья, (то есть по соотношениям между группами с различными уровнями здоровья) возможно более эффективное улучшение условий окружающей среды, а также повышение уровня здоровья населения. Хотя остается большое количество проблем. Так, например, показатели рождаемости, заболеваемости и смертности довольно инертно «откликаются» на изменение окружающей среды, и выявляются лишь последствия экологического неблагополучия, что не дает возможности оперативного управления экологической ситуацией.
Еще не разработан ряд необходимых экономических механизмов для стимулирования мероприятий по охране окружающей среды. Хотя генетический мониторинг – дело сложное, он просто необходим для решения экологических проблем человека, а также уменьшения роста заболеваний, в том числе наследственных.
Заключение.Генетика - сравнительно молодая наука. Но перед ней стоят очень серьезные для человека проблемы. Так генетика очень важна для решения многих медицинских вопросов, связанных прежде всего с различными наследственными болезнями нервной системы (эпилепсия, шизофрения), эндокринной системы (кретинизм), крови (гемофилия, некоторые анемии), а также существованием целого ряда тяжелых дефектов в строении человека: короткопалость, мышечная атрофия и другие. С помощью новейших цитологических методов, цитогенетических в частности, производят широкие исследования генетических причин различного рода заболеваний, благодаря чему существует новый раздел медицины - медицинская цитогенетика.
Разделы генетики, связанные с изучением действия мутагенов на клетку (такие как радиационная генетика), имеют прямое отношение к профилактической медицине.
Особую роль генетика стала играть в фармацевтической промышленности с развитием генетики микроорганизмов и генной инженерии. Несомненно, многое остается неизученным, например, процесс возникновения мутаций или причины появления злокачественных опухолей. Именно своей важностью для решения многих проблем человека вызвана острая необходимость в дальнейшем развитии генетика. Тем более что каждый человек ответственен за наследственное благополучие своих детей, при этом важным фактором является его биологическое образование, так как знания в области аномалии, физиологии, генетики предостерегут человека от совершения ошибок.
Использованная литература. А.О. Рувинский «Наследственная изменчивость человека» Ю.Я. Керкис «Лечение и предупреждение некторых наследственных болезней человека» Д.К. Беляяв «Общая биология» Н. Грин, У. Стаут «Биология» С. Котов «Медицинская генетика» М.Д. Франк-Каменецкий «Самая главная молекула»
Похожие работы
... неизменными являются вопросы о сущности и природе человека, смысле его существования. Целью данной работы является: рассмотреть основные аспекты проблемы человека в философии. 1. Проблема антропогенеза Антропогенез (от греч. anthropos — человек и греч. genesis — происхождение) — учение о происхождении человека. Антропогенез в современной научной картине мира предстает как процесс со ...
... придется смириться с определенным числом химически индуцированных мутаций, поскольку общество не может отказаться от тех преимуществ, которые дают ему достижения современной химии. В будущем человечеству придется столкнуться с увеличением частоты спонтанных мутаций. Оно приведет к соответствующему увеличению численных и структурных хромосомных аберраций и наследственных заболеваний, ...
... идеализма" [36]. Другим ответом на сессию было расширенное заседание президиума Академии медицинских наук СССР 9-10 сентября (см.: "Медицинский работник", 15.IX.1948), которое объявило формальный запрет генетики человека. После десятилетия полного молчания были созданы лаборатории В.П.Эфроимсона, А.А.Прокофьевой-Бельговской, Е.Э.Погосян, М.А.Арсеньевой, которые включали в свою тематику проблемы ...
... активных факторов в биосфере. Поэтому генетико-гигиеническое нормирование содержания подобных факторов в окружающей среде является обязательным компонентом профилактики заболеваемости человека. Генетика человека на этапе ее становления обозначалась в нашей стране в духе времени – евгеникой. Обсуждение возможностей евгеники, совпавшее по времени со стартом и быстрым развитием генетических ...
0 комментариев