Навигация
Металлургия цветных металлов
Курсовая работа на тему:
Металлургия цветных металлов
Содержание
1. Введение
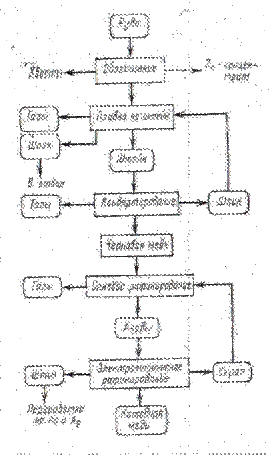
2. Описание технологии получения катодной меди
3. Выбор технологии плавки на штейне
4. Теоретические основы процесса Ванюкова
5. Расчет материального и теплового баланса
6. Заключение
ВведениеМеталлургия меди, а также других тяжелых цветных металлов является ведущим звеном отечественной цветной металлургии. На долю тяжелых цветных металлов в РФ приходится значительная часть валовой продукции отрасли.
Значение меди из года в год возрастает, особенно в связи с бурным развитием энергетики, электроники, машиностроения, авиационной, космической и атомной техники. Дальнейшее развитие и технический уровень медного и никелевого производств во многом определяют технический прогресс многих отраслей народного хозяйства нашей страны, в том числе микропроцессорной техники. Для получения меди используются всевозможные способы плавок, например, плавка медных концентратов в электрических, отражательных, шахтных печах, при использовании процесса конвертирования медных штейнов, благодаря автогенным плавкам во взвешенном состоянии, на штейне и др. На сегодняшний день существует несколько основных процессов автогенных плавок : процесс «Норанда», «Уоркра», «Мицубиси» и Ванюкова. К сожалению, разработка новый конструкций печей и различных процессов требует значительных капиталовложений, а свободный средств у Российских предприятий недостаточно. В данной курсовой работе будет рассмотрена технология А.В. Ванюкова или ПЖВ.
Технология получения катодной медиЭлектролитическое рафинирование меди преследует две цели:
1) получение меди высокой чистоты (99,90—99,99% Си), удовлетворяющей требованиям большинства потребителей;
2) извлечение попутно с рафинированием благородных и других ценных компонентов (Se, Те, Ni, Bi и др.).
Следует отметить, что чем выше в исходной меди содержание благородных металлов, тем ниже будет себестоимость электролитной меди. Именно поэтому при конвертировании медных штейнов стремятся использовать в качестве флюса золотосодержащие кварциты.
Для осуществления электролитического рафинирования меди аноды, отлитые после огневого рафинирования, помещают в электролизные ванны, заполненные сернокислым электролитом. Между анодами в ваннах располагаются тонкие медные листы — катодные основы.
При включении ванн в сеть постоянного тока происходит электрохимическое растворение меди на аноде, перенос катионов через электролит и осаждение ее на катоде. Примеси меди при этом в основном распределяются между шламом (твердым осадком на дне ванн) и электролитом.
В результате электролитического рафинирования получают катодную медь; шлам, содержащий благородные металлы; селен;
теллур и загрязненный электролит, часть которого иногда используют для получения медного и никелевого купоросов. Кроме того, вследствие неполного электрохимического растворения анодов получают анодные остатки (анодный скрап).
Электролитическое рафинирование меди основано на различии ее электрохимических свойств и содержащихся в ней примесей. В таблице приведены нормальные электродные потенциалы меди и наиболее часто встречающихся в ней примесей.
Медь относится к группе электроположительных металлов, ее нормальный потенциал +0,34 В, что позволяет осуществлять процесс электролиза в водных растворах (обычно в сернокислых).
На катоде протекают те же электрохимические реакции, но в обратном направлении. Соотношение между одновалентной и двухвалентной медью в растворе определяется равновесием реакции диспропорционирования.
Следовательно, в состоянии равновесия концентрация в растворе ионов Сu+ примерно в тысячу раз меньше, чем концентрация ионов Си2+. Тем не менее реакция имеет существенное значение для электролиза. Она в частности определяет переход меди в шлам. В начальный момент вблизи анода в растворе соотношение двух- и одновалентной меди соответствует константе равновесия. Однако вследствие большего заряда и меньшего ионного радиуса скорость перемещения двухвалентных ионов к катоду превышает скорость переноса ионов одновалентных. В результате этого в прианодном слое концентрация ионов Си2+ становится выше равновесной и реакция начинает идти в сторону образования тонкого порошка меди, выпадающего в шлам.
Как указывалось выше, электролитическое рафинирование осуществляют в сернокислых растворах. Электроположительный потенциал меди позволяет выделить медь на катоде из кислых растворов без опасения выделения водорода. Введение в электролит наряду с медным купоросом свободной серной кислоты существенно повышает электропроводность раствора. Объясняется это большей подвижностью ионов водорода по сравнению с подвижностью крупных катионов и сложных анионных комплексов.
Для улучшения качества катодной поверхности в электролиты для рафинирования меди на всех заводах обязательно вводят разнообразные поверхностно-активные (коллоидные) добавки:
клей (чаще столярный), желатин, сульфитный щелок. В процессе электролиза на поверхности катода могут образовываться дендриты, что уменьшает в данном месте расстояние между катодом и анодом. Уменьшение межэлектродного расстояния ведет к уменьшению электрического сопротивления, а следовательно, к местному увеличению плотности тока. Последнее в свою очередь обусловливает ускоренное осаждение меди на дендрите и ускоренный его рост. Начавшийся рост дендрита в конечном итоге может привести к короткому замыканию между катодом и анодом. При наличии дендритов сильно развитая поверхность катода удерживает большое количество электролита и плохо промывается, что не только ухудшает качество товарных катодов, но и может вызвать брак катодной меди по составу. Одно из объяснений механизма действия поверхностно-активных веществ заключается в том, что они адсорбируются на наиболее активных частях поверхности и при этом вызывают местное повышение электрического сопротивления, что и препятствует росту дендрита. В результате поверхность катодов получается более ровной, а катодный осадок более плотным. После выравнивания катодной поверхности коллоидная добавка десорбирует в электролит.
Растворы коллоидных добавок непрерывно вводят в циркулирующий электролит. Вид и расход поверхностно-активных веществ различны для каждого предприятия. Обычно применяют одновременно две добавки. На 1 т получаемой катодной меди расходуют 15—40 г клея, 15—20 г желатина, 20—60 г сульфитных щелоков или 60—100 г тиомочевины.
Основными требованиями, предъявляемыми к электролиту, являются его высокая электропроводность (низкое электрическое сопротивление) и чистота. Однако реальные электролиты, помимо сульфата меди, серной кислоты, воды и необходимых добавок, обязательно содержат растворенные примеси, содержащиеся до этого в анодной- меди. Поведение примесей анодной меди при электролитическом рафинировании определяется их положением в ряду напряжений. По электрохимическим свойствам примеси можно разделить на четыре группы:
I группа — металлы более электроотрицательные, чем медь (Ni, Fe, Zn и др.);
II группа — металлы, близко стоящие в ряду напряжений к-меди (As, Sb, Bi);
III группа — металлы более электроположительные, чем медь (Au, Ag и платиноиды);
IV группа — электрохимически нейтральные в условиях рафинирования меди химические соединения (Cu2S, Cu2Se, Cu2Te, AuTe2, Ag2Te).
Примеси первой группы, обладающие наиболее электроотрицательным потенциалом, практически полностью переходят в электролит. Исключение составляет лишь никель, около 5% которого из анода осаждается в шлам в виде твердого раствора никеля в меди. Твердые растворы по закону Нернста становятся даже более электроположительными, чем медь, что и является причиной их перехода в шлам.
Особо по сравнению с перечисленными группами примесей-ведут себя свинец и олово, которые по электрохимическим свойствам относятся к примесям I группы, но по своему поведению в процессе электролиза могут быть отнесены к примесям III и IV групп. Свинец и олово образуют нерастворимые в сернокислом растворе сульфат свинца PbS04 и метаоловянную кислоту H2SnO3. Электроотрицательные примеси на катоде в условиях электролиза меди практически не осаждаются и постепенно накапливаются в электролите. При большой концентрации в электролите металлов первой группы электролиз может существенно расстроиться.
Накопление в электролите сульфатов железа, никеля и цинка снижает концентрацию в электролите сульфата меди. Кроме того, участие электроотрицательных металлов в переносе тока через электролит усиливает концентрационную поляризацию у катода.
Электроотрицательные металлы могут попадать в катодную медь в основном в виде межкристаллических включений . раствора или основных солей, особенно при их значительной концентрации в электролите. В практике электролитического рафинирования меди не рекомендуется допускать их концентрацию в растворе свыше следующих значений, г/л: 20 Ni; 25 Zn; 5 Fe.
Примеси II группы (As, Sb, Bi), имеющие близкие к меди электродные потенциалы, являются наиболее вредными с точки зрения возможности загрязнения катода. Будучи несколько более электроотрицательными по сравнению с медью, они полностью растворяются на аноде с образованием соответствующих сульфатов, которые накапливаются в электролите. Однако сульфаты этих примесей неустойчивы и в значительной степени подвергаются гидролизу, образуя основные соли (Sb и Bi) или мышьяковистую кислоту (As). Основные соли сурьмы образуют плавающие в электролите хлопья студенистых осадков («плавучий» шлам), которые захватывают частично и мышьяк.
В катодные осадки примеси мышьяка, сурьмы и висмута могут попадать как электрохимическим, так и механическим путем в результате адсорбции тонкодисперсных частичек «плавучего» шлама. Таким образом, примеси II группы распределяются между электролитом, катодной медью и шламом. Предельно допустимые концентрации примесей II группы в электролите составляют, г/л:
Похожие работы
... другая продукция. Таким образом, цветная металлургия производит продукцию, которая используется практически всеми отраслями промышленности. 5. Основные технико-экономические показатели, характеризующие добычу цветных металлов Себестоимость - совокупность материальных и трудовых затрат предприятия в денежном выражении, необходимых для изготовления и реализации. Планирование и учет ...
... и красивых защитно-декоративных пленок на латунных и стальных поверхностях ювелирных изделий, корпусов наручных часов и других товаров. ЗАКЛЮЧЕНИЕ Представленный реферат посвящен товароведной характеристике цветных металлов и изделий из них. В первом разделе реферата нами изучены подходы к классификации цветных металлов и какие металлы вообще относят к цветным (коротко изложим суть): Медь ...
... 17-25 кг/т алюминия, что на ~ 10-15 кг/т выше по сравнению с результатами для песчаного глинозёма. В глинозёме, используемом для производства алюминия, должно содержаться минимальное количество соединений железа, кремния, тяжелых металлов с меньшим потенциалом выделения на катоде, чем алюминий, т.к. они легко восстанавливаются и переходят в катодный алюминий. Нежелательно также присутствие в ...
... . Поэтому считают нормальным возникновение в электролизере одного-двух анодных эффектов в сутки. Изучением природы анодного эффекта занималось много исследователей. На основе исследований, проведенных в Московском институте цветных металлов и золота под руководством проф.А.И. Беляева, можно сделать вывод, что причиной, вызывающей анодный эффект, является различная смачиваемость угольного анода ...



0 комментариев