Навигация
Области применения протеаз
Реферат выполнил: студент гр. 50-11 Кашапов Р.Р.
Казанский государственный технологический университет
Кафедра промышленной биотехнологии
Казань 2004
Введение.
Важнейшим свойством белков является их каталитическая активность. Вещества белковой природы, способные каталитически ускорять химические реакции, называют ферментами.
Роль ферментов в жизнедеятельности животных, растений и микроорганизмов колоссальна. Благодаря каталитической функции разнообразные ферменты обеспечивают быстрое протекание в организме или вне его огромного числа химических реакций. В настоящее время в биологических объектах обнаружено несколько тысяч индивидуальных ферментов, а несколько сотен из них выделено и изучено. Подсчитано, что одна живая клетка может содержать до тысячи различных ферментов, каждый из которых ускоряет ту или иную химическую реакцию.
Будучи выделены из организма, ферменты не утрачивают способность осуществлять каталитическую функцию. На этом основано их практическое применение в химической, пищевой, легкой и фармацевтической промышленности. Особое значение для химического производства имеет специфичность ферментов: ведь до 80% затрат в производстве многих химических веществ приходится на отделение примесей, возникших в результате побочных реакций. Кроме того, ферменты позволяют осуществлять ряд процессов, выполнение которых обычными методами органического синтеза остается пока нерешенной проблемой.
Протеазы относят к классу пептид-гидролаз – ферментов, ускоряющих реакции гидролиза белков, пептидов и других соединений, содержащих пептидные связи. Далее подробно рассматриваются основные области применения протеаз в различных областях промышленности.
1. Основные области применения протеаз
Пищевая промышленность
В сочетании с амилазой протеиназы, выделяемые из грибов, относящихся к роду Aspergillus, применяют в хлебопекарной промышленности. Будучи добавлены в количестве 20-50 г на 1 т муки, они улучшают качество и аромат хлеба, ускоряют созревание теста на 30%, сокращают расход сахара на производство высших сортов булочных изделий вдвое, увеличивают пористость мякиша и объем хлеба на 20%.
В кулинарии применение пептид-гидролаз (протелин и проназа) для обработки мяса перед его приготовлением резко улучшает качество мясных блюд.
В мясной промышленности протеолитические ферменты применяют для ускорения созревания мяса и повышения выхода мяса 1-го сорта с 15% до 40%.
В молочной промышленности использование протеаз ускоряет созревание сыров вдвое и снижает их себестоимость на 10%.
Легкая промышленность
В кожевенном и меховом производстве для ускорения снятия волоса со шкур и размягчения кожевенного сырья применяют препараты протеиназ (протелин и протофрадин), являющихся внеклеточными протеазами стрептомицетов. При этом время, необходимое на осуществление необходимых процессов сокращается в несколько раз, сортность и качество шерсти и кож повышается, а условия труда в этой отрасли производства резко улучшаются.
В текстильной промышленности процесс расшлихтовки тканей ферментными препаратами класса протеаз грибного происхождения ускоряется в 7-10 раз; эти же препараты служат для удаления серицина при размотке коконов тутового шелкопряда в производстве натурального шелка.
Применение в бытовой химии
Протеазы растительного происхождения, выдерживающие нагревание до 90°С без заметной потери активности, являются компонентами стиральных порошков и моющих средств. Некоторые протеазы вместе с глюкозооксидазой и каталазой добавляют в зубную пасту – они обеспечивают их антимикробное действие и предохранение зубов от кариеса.
2. Применение протеаз в легкой промышленности.
В ферментативных процессах кожевенного и мехового производства чаще всего используются ферменты, относящиеся к классу протеаз. Наиболее широко применяются следующие ферменты.
Трипсин
Выделяется поджелудочной железой в виде трипсиногена, активируется автокаталитически при рН 7-9 или энтерокиназой, вырабатываемой слизистой оболочкой тонких кишок. Трипсин не является ферментом первичного действия, т.е. или совсем не расщепляет нативные белки, или действует на них слабо и медленно. Белки, денатурированные нагреванием, обработанные кислотами, солями, щелочами и пепсином, легко подвергаются действию трепсина.
Трипсин гидролизует связи (пептидные, амидные, сложноэфирные), в которых карбоксильная группа принадлежит основным аминокислотам лизину и аргинину.
Трипсин играет основную роль при мягчении голья панкреатином и его препаратами в кожевенном производстве.
Пепсин
Фермент желудочного сока, выделяемый клетками слизистой оболочки желудка в виде неактивного пепсиногена, активируется автокаталитически в присутствии соляной кислоты, превращаясь в пепсин. Пепсин является ферментом первичного воздействия, т.е. расщепляет почти все нативные белки, гидролизуя при продолжительном действии около 30% пептидных связей, однако, действует медленнее, чем другие протеиназы. Пепсин гидролизует связи аминокислот, содержащих ароматические кольца в боковой цепи и свободные карбоксильные группы.
Пепсин не действует на кератин, протамины и продукты гидролиза белков с низкой молекулярной массой. Растворы пепсина подвергаются медленному автолизу. В процессах кожевенного и мехового производства не используется, однако применяется для обработки коллагенсодержащих отходов с целью их дальнейшего растворения.
Катепсин
Фермент, находящийся в виде катепсиногена во всех животных тканях. В наибольших количествах содержится в печени, селезенке и почках. Вместе с ним присутствует естественный активатор зоокиназа, который можно отделить от катепсина. Катепсин действует на соединения, содержащие ароматическую аминокислоту, и расщепляет пептиды с N-конца пептидной связи. Обычно катепсин катализирует гидролиз белков при автолизе. В нейтральной среде он неактивен, оптимальный рН действия 4-5.
После смерти животного в тканях, в том числе в кожевенном и меховом сырье, накапливаются молочная и другие кислоты, т.е. образуется кислая среда. В результате этого катепсин приобретает способность каталитического действия на гидролиз тканевых белков. Это нужно учитывать при первичной обработке сырья, в частности нужно своевременно его консервировать.
Коллагеназа
Это специфический фермент, расщепляющий нативный коллаген на пептиды без образования аминокислот. Другие белки не расщепляет.
Коллагеназа действует на коллаген сильнее, чем на синтетические пептиды, построенные по типу коллагена. Выделяется из культур различных бактерий.
Похожие работы
... продукции, а значит, дает значительный экономический эффект. 2. Объекты и методы исследования Целью дипломной работы являлось изучение свойств бактериальной суспензии, с последующим применением в подготовительных процессах переработки мехового сырья. Для выполнения эксперимента был составлен сетевой график, представленный на рисунке 1. Применение ферментов в кожевенной и ...
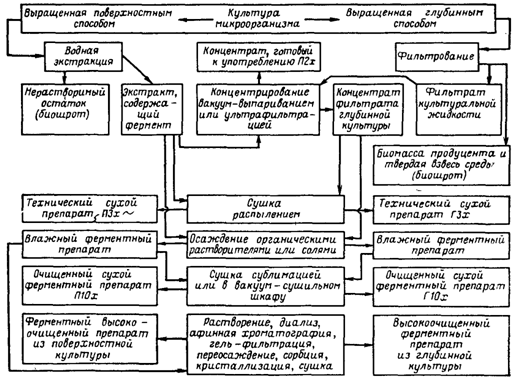
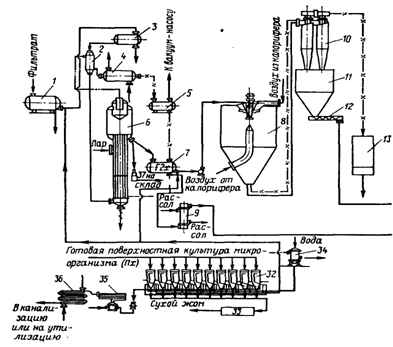
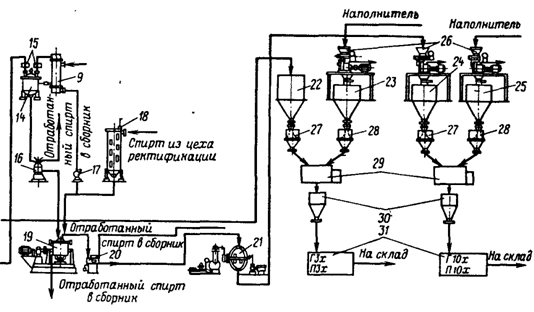
... инактивация ферментов. Из сборника 29 охлажденная жидкость по мере необходимости подается на фильтровальную установку. 1.3 Получение ферментных препаратов из культур микроорганизмов Культура микроорганизмов, выращенная поверхностным способом, и культуральная жидкость после глубинного культивирования содержат большое количество балластных веществ. Выделение и очистка ферментов – трудоёмкий и ...
... 70-80°С. Клетки, включенные в такого рода пористый материал, сохраняют активность и способны функционировать в течение нескольких месяцев. 64. Приведите примеры микробных ферментов, использующихся вместо растительных и животных. Микробные ферменты все активнее заменяют растительные и животные ферменты. Так, амилазы из Bacillus и Aspergillus заменили аналогичные ферменты из ...
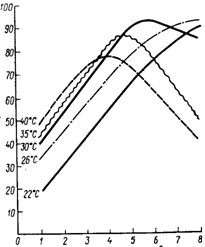
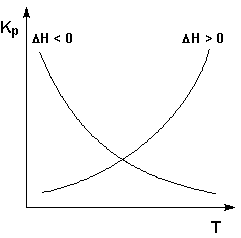
... сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры. Экзотермические реакции: ΔH° < 0 (ΔU° < 0). В этом случае, согласно (I.106, I.107), температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. ...

0 комментариев