Навигация
Безопасность антиоксидантных витаминов
3.31 Безопасность антиоксидантных витаминов
В большинстве стран, витамины были обычно доступны в течение многих лет и связываются с несколькими основными боковыми эффектами. Предшествующие краткосрочные испытания и эпидемиологические опыты считают, что антиоксидантное дополнение витаминов (в дозах значительно ниже чем те, что были протестированны на испытаниях) - безопасны. На РАП испытаниях, было замечено явное увеличение рака легких и смертей от сердечно-сосудистой болезни с добавками b-каротина, и избыточный гемморагический удар был замечен с дополнением витамина E. Тем не менее, неясно что это - реальные или случайные данные.
Различные крупномасштабные перемешанные испытания уже начали вербовку или около завершения; эти испытания особо указывают эффективность различных противоокислительных витаминов в сердечно-сосудистую болезнь. Анализ здоровья мужчин сравнивает b-каротин и плацебо в среднем 12 лет у 21100 здоровых мужчин, и каротин и ретинол Испытание Эффективности сравнивает с b-каротином и витамином в факторном плане на 17700 постоянных курильщиках или мужчинах с асбестовым раскрытием наблюдавшихся в среднем 9 лет. Результаты от этих испытаний должны быть доступны в следующих 2 годах и помогут решить дискуссию о дополнении b-каротина, которое всплыло на поверхность с РАП испытанием.
Анализ Защиты Сердца ВЕЛИКОБРИТАНИЯ испытает комбинацию витамин E, b-каротин, и витамин C на 20 000 пациентах с установленной сердечно-сосудистой болезнью. Сердечная Защита Анализа Результатов оценивает витамин E на 9000 аналогичных пациентах. Сердечно-сосудистый Анализ испытает факториал витамина E, витамина C, и b-каротина на 8000 женщин с установленной сердечно-сосудистой болезнью. Во всех опытах над витамином E используется доза больше чем 300 IU/d; такая доза должна быть достаточна, чтобы увеличить уровень сыворотки по крайней мере в два или три раза. Будущие мета-анализы или систематический обзор совокупных чисел от этих испытаний ( предполагаемые 40000 пациентов получают второстепенное предотвращение и 86000 пациентов получают первичное предотвращение) были бы к концу десятилетия, обеспечивая ясные ответы о эффективности и безопасности различных противоокислительных витаминов. Такой обзор должен также обеспечить данные в размере эффекта, длительности обработки и эффекты в других группах (например, мужчины по сравнению с женщинам; более старые пациенты по сравнению с младшими пациентами; курильщики по сравнению с некурящими; диабетические пациенты по сравнению с недиабетическими пациентами).
3.4 Итог:
Эпидемиологические данные показывают, что высокие уровни ввода витамина E, или от диеты или, более вероятно, от добавок витамина, которые поддерживаются до двух или более лет, связываются с уменьшением риска для фатальной и нефатальной сердечно-сосудистой болезни. Использование b-каротина или витамина C несомненно связаны с несколько меньшим уменьшением риска. Тем не менее, недостатки эпидемиологических опытов, как например, различия в поведении здоровья и диетического ввода между лицами использующими антиоксидантные витамины и лицами не использующими их, могут объяснить значительную часть наблюдаемого уменьшения в риске.
4.0 О классификации липопротеидов.
Благодаря гетерогенности, обусловленной значительными различиями по ряду физико-химических параметров (размер частиц, их заряд, плотность, природа апобелка и др.), ЛП могут разделяться и классифицироваться несколькими путями.В настоящее время получили распространениедве классификации ЛП: одна, основанная на важнейшем физико-химическом параметре ЛП - их плотности (физико-химическая классификация), и вторая, основанная на идентификации белка(апопротеина), участвующего в формировании индивидуального ЛП (химическая классификация). Первая классификация опирается на использование ультрацентрифугирования, вторая-иммуноаффинной хроматографии с использованием антител против индивидуальных апопротеинов.
Согласно первой классификации, различают хиломикроны (ХМ), ЛП очень низкой, промежуточной, низкой и высокой плотности (ЛПОНП, ЛППП, ЛПНП и ЛПВП, соответственно). Согласно второй классификации, различают первичные (простые) ЛП, например, ЛП-А, ЛП-В, ЛП-С и т.д., и вторичные (сложные) ЛП, к которым относят ассоциаты первичных ЛП. Примерами таких вторичных ЛП могут быть ЛП-В:С, ЛП-В:С:Е, ЛП-А:В:С:Д:Е и др. Так как многие апопротеины отличаются гетерогенностью, то названия первичных и вторичных ЛП часто уточняют и пишут как ЛП-А-1, ЛП-А-11, ЛП-В-100 и Т.Д.
Химическая классификация ЛП более физиологична. Использование ее дает возможность оценить реальное содержание первичных и вторичных ЛП и их соотношение в плазме крови. Кроме того, связывая название ЛП с определенным апопротеином, входящим в ее состав,
химическая классификация дает большую информативность о первичных и вторичных ЛП, исходя из свойств апопротеынов.Так, например, когда с помощью иммуноаффинной хроматографии удалось из ЛПВП выделить ЛП-А-1 и ЛП-А-11, для специалистов не был неожиданностью тот факт, что ХС-акцепторная способность и ЛХАТ активность оказались преимущественно сосредоточенными в ЛП-А-1. Широкое применение химической классификации, однако, тормозится из-за сложности выделения первичных ЛП. Но за ней, несомненно, будущее. Напротив, физико-химическая классификация получила исключительно широкое распространение, и подавляющая часть исследований выполнена с ее использованием. Физико-химическая классификация удобна в операционно-методическом отношении и к ней, кроме того,привыкли. Недостаток физико-химической классификации состоит в том, что она отражает не только то, что представляют собой ЛП плазмы, взятой для анализа, но и то, что произошло с ними при длительном многочасовом ультрацентрифугировании в концентрированном солевом растворе при заданной величине плотности. Применение ряда других методов позволяет субфракционировать ЛП как в рамках приведенных классификаций, так и независимо от них. Так, среди липопротеидов высокой плотности выделяют a- ЛПВП и пре-b-ЛПВП, причем последням субфракцим связана с ЛХАТ и обладает ХС-акцепторними свойствами. Использование свободно-проточном изотахофореза позволило разделить ЛПВП на три субфракции, различающиеся по скорости миграцыи и по характеру взаимодействия с клетками.
По-видимому, еще длительное время различные классификации ЛП будут существовать одновременно, и для специалистов, работающих в этой области, очень важно применять тот или иной методический подход адекватно поставленной задаче.
К строению липопротеидной частицы. При описании липопротеидной частицы обычно упоминается, что ее наружная оболочка образована фосфолипидным монослоем, неэстерифицированными пре-b-ЛПВП, причем последням субфракцим связана с ЛХАТ и обладает ХС-акцепторними свойствами. Использование свободно-проточном изотахофореза позволило разделить ЛПВП на три субфракции, различающиеся по скорости миграцыи и по характеру взаимодействия с клетками.
По-видимому, еще длительное время различные классификации ЛП будут существовать одновременно, и для специалистов, работающих в этой области, очень важно применять тот или иной методический подход адекватно поставленной задаче.
К строению липопротеидной частицы. При описании липопротеидной частицы обычно упоминается, что ее наружная оболочка образована фосфолипидным монослоем, неэстерифицированнымхолестерином (НЭХС) и белками (апопротеинами), а внутреннее мдро - триглицеридами (ТГ) и эфирами холестерина (ЭХС). Однако, такое одностороннее представление о строении липопротеидной частицы затрудняет понимание тех превращеный, которые происходжг на ее поверхности и в глубине. Так, гидролиз ТГ при воздействии липопротеидлипазы (ЛПЛ) происходит не в ядре частицы, где содер-
жатся эти липидм, а на ее поверхности, В равной мере, в результате лецитин-холестерин-ацилтрансферазной (ЛХАТ) реакции ЭХС образуются не в ядре частицы, где им "улловлено" место, а также на ее поверхности. Исследования последних лет показали, что в фосфолипидном монослое мохет растворяться небольшое количество ТГ. При этом два крайних ацильных радикала ТГ, вероятно, образуют водородные связи с молекулами води. Образование таких связей можно представить себе тогда, когда атомы кислорода ацильных радикалов повернуты в водную среду. Располохение ТГ в поверхностном слое явлмется идеальным для действия ЛПЛ вследствие наличия воды, необходимой для гидролитическом расщепления этих липидов. По мере гидролиза поверхностных ТГ происходит перемещение ядерных ТГ к поверхности частицы и обеднение последней этими липидами. Уменьшенная в обьеме частица становится богатой ЭХС. При этом в ремныглых частицах ХМ и ЛПОНП, наряду с аккумуляцией ЭХС в ядре, происходит и их небольшое накопление в оболочке. Этого оказывается достаточно, чтоби растворимость ТГ в фоа~ипидном монослое снизилась с 3-4 до 0,15% и стало невозмохным дальнейшее протекание ЛПЛ реакции. Наличие небольших количеств ЭХС и ТГ в оболочке липопротеидной частицы и их подвихность внутри частицы делают возможным обмен этыми липидами и между отдельными классами ЛП при участии липидпереносящих белков.В ядре липопротеидной частищю обнарухены небольшие количества НЭХС, растворенном в ТГ. Значение этом факта пока не ясно. Холестерин-транспортные функции ЛПНП. На протяжении более чем четверти столетия подчеркивается, что ЛПНП - самые богатые холестерином частицы - осуществляют транспорт ХС из печени в органы и ткани. Исследования М.Вгожа и Э.бо1бз1еiп показали, как осуществляется этот транспорт в клетку. Сначала в печени образуются богатые триглицеридами, но не ХС, частицы ЛПОНП, затем эти частицы в капиллярном русле подвергаются атаке со стороны ЛПЛ и печеночной триглицеридлипазы, в результате чего частицы лишаются подавляющей части ТГ, теряют апопротеины С и Е и становятся богатыми ЭХС. При этом сначала образуются частицы ЛППП, а затем - ЛПНП. Подавляющая часть и тех и других частиц (не менее 75 %) взаимодействует с апоВ, Е-рецепторами печени и поступает в этот орган, унося в него все, что осталось в этих частицах, в том числе содержащийся в них ХС. Можно сказать, что печеночный ХС был прежде всего необходим для формирования богатых ТГ частиц и после того как эти частицы выполныли ТГ-транспортную функцию, он снова поступил в печень. Сходную ситуацию мы встречаем при секреции желчи, когда большая часть секретируемых желчных кислот и ХС подвергается реабсорбции в кишечнике ц снова поступает в печень. Из этого следует, что печень экономно расходует свой стериновый пул.
Что касается других органов и тканей, то их клетки, как и гепатоциты, обладают способностью синтезировать свой собственный ХС, хотя и не в столь значительных размерах. Наличие в периферических клетках апоВ, Е-рецепторов можно рассматривать как дополнительный или резервный путь поступления ЛПНП и содержащегося в них ХС в клетку. Таким образом, согласно высказанной точке зрения, богатые триглицеридами апоВ-содержащие ЛП (ЛПОНП и ЛППП) прежде всею выполняют ТГ-транспортную роль; главная функция ЛПНП, являющихся по существу ремнантами ЛПОНП, заключается в возвращении ХС в печень и дополнительная функция - в доставке ХС в периферические органы и ткани, если последние по какой-то причине не обеспечивают себя своим синтезированным ХС. Эта точка зрения подкрепляется данными, согласно которым сильнейшим стимулом образования ЛПОНП является повышение концентрации в крови неэстерифицированных жирных кислот (НЭЖК) и их доставка в печень.
Все апоВ-содержащие ЛП, включая ХМ и их ремнанты, выполняют также роль акцепторов эфиров ХС. Последние передаются ЛПВП при участии специальных белков, переносящих эти эфиры (ЭХС-ПБ). В связи с этим напомним, что основная функция ЛПВП захват избыточного ХС из периферических тканей и транспорт его в эстерифицированной форме в печень для окисления. Не преследует ли перенос ЭХС с ЛПВП на апоВсодержащие ЛП эту же самую цель? Об атерогенных и антиатерогенных ЛП. До сих пор считается, что ЛПНП-самый богатый холестерином класс липопротеидов- является наиболее атерогенным (допускается, что некоторой атерогенностью обладают ЛПОНП). Кроме того, в крови циркулирует минорная и независимая от других классов ЛП фракция, обозначаемая как ЛП (а), также обладающая высокой атерогенностью. На ее долю приходится всеголишь 1-2% от общего пула апоВ-содержащих ЛП. Поэтому основное внимание приковано к ЛПНП. О высокой атерогенности этого класса ЛП говорит не только эксперименты на животных, но и многочисленные клинические и популяционные данные о положительной корреляции между уровнем ЛПНП в крови и распространенностью и выраженностью ишемической болезни сердца.
Эта, казалось бы, незыблемая истина в настоящее время подвергается серьезной проверке и уточнению. Эксперименты, проведенные на клеточных культурах, показывают, что превращение макрофага в пенистую клетку, являющуюся, как известно, "предшественницей", "виновницей" и "спутницей" атеросклеротических поражений артерий, происходит при инкубации макрофагов не с нативными, а с так называемыми модифицированными ЛПНП.
В крови людей обнаружено несколько разновидностей модифицированных ЛПНП: перекисно-модифицированные, гликозилированные, десиалированные, а также ЛПНП, входящие в состав автоиммунных комплексов. Характерно, что уровень всех перечисленных модифицированных форм ЛП у больных ишемической болезнью сердца повышен. Одновременно при этом заболевании вофракции ЛПНП обнаружены минорние субфракции, отличающиеся измененными физико-химическими параметрами. Сюда относятся так называемые "мелкие, плотные ЛПНП" (d=1,044-1,064 г/мл), а также субфракции, характеризующиесм более отрицательным зарядом, обогащенностью продуктами перекисном окисления липидов, способностью легко образовывать агрегаты. Надо полагать, что мрдификационные изменения не затрагивают все частицы ЛПНП (равно, как и атерогенность не распределена между ними поровну), а только какую-то небольшую субфракцию. Если согласиться с точкой зрения, что атерогенность присуща только модифицированным ЛПНП, то усилия врачей должны быть направлены не стк»ко на снижение уровня ЛПНП, схолько на снижение уровня модифицированных ЛПНП или, что еще лучше, на прщотвращение их образовдния. По всей видимости, существует йржяя зависимость между уровнем ЛПНП в крови и количеством образующихся модифицированных форм, что оправдывает применение и того и другого подхода. Нельзя исключить, что те модификации ЛП, которые мы обнаруживаем в крови, являются всем лишь предвестниками последующих более глубоких модификаций, происходящих в артериальной стенке и ведущих, собственно, к развитию атеросклероза. В крови могут циркулировать лишь слабо модифицированные или предмодифицированные ЛП, т.к. все ЛП, подвергшиеся глубокой модификации, будут быстро захватываться
клетками РЭС. Так, если кролику ввести внутривенно ацетилированные ЛПНП или иммунный комплекс ЛПНП-IgG, то будет происходить чрезвычайно быстрая, почти мгновенная их элиминация из кровотока.
Как бы то ни было, требует уточнения вопрос, какие частицы ЛПНП подвергаются модификациям в плазме крови и какие - в артериальной стенке. Самая распространенная модификация ЛПНП - их повреждение, связанное с перекисным окислением липидов. Эксперименты на кроликах Ватанабе показали, что если у этих животных затормозить перекисную модификацию ЛП с помощью пробукола, то атеросклероз у них развивается значительно медленнее, несмотря на высокую гиперхолестеринемию. Показательно, что кролики Ватанабе, получавшие пробукол, оставались в живых, тогда как контрольные животные погибали от инфаркта. Значит, "виноватыми" в развитии атеросклероза, инфаркта миокарда и в смерти животных явились не нативные ЛП, а ЛП, подвергшиеся перекисной модификации. Об антиатерогенном действии ЛПВП. Антиатерогенность ЛПВП связывают со способностью этих ЛП осуществлять "обратный" транспорт ХС из клеток периферических тканей в печеньдля последующего окисления в желчные кислоты. По данным ряда популяционных исследований существует строгая отрицательная корреляция между уровнем ЛПВП в крови и распространенностью ишемической болезни сердца, а клинические наблюдения однозначно показывают, что низкий уровень этих липопротеидов характерен для данного заболевания.
По всей видимости, "обратный" транспорт ХС не является единственной причиной антиатерогенного действия этих ЛП. По данным нашей лаборатории, ЛПВП, как in vitro, так и in vivo задерживают перекисную модификацию ЛПНП . Выявлена отрицательная корреляция между уровнем ЛПВП в крови и содержанием продуктов перекисного окисления липидов. Не исключено, что в циркулирующей крови, где на одну частицу ЛПНП приходится около 30 частиц ЛПВП, последние оказывают на ЛПНП стабилизирующее действие. Этому способствует постоянно протекающий переход ЭХС из ЛПВП на апоВ-содержащис ЛП, обеспечивающий поддержание липопротеидами наиболее устойчивой сферической формы. В целом эволюция наших знаний относительно липопротеидной концепции атерогенеза шла примерно следующим путем:
- без холестерина не может быть атеросклероза (Н.Н.Аничков 1915 г.)
- холестерин крови связан с развитием атеросклероза (двадцатые-тридцатые годы);
-ЛП, как переносчики холестерина, ответственны за развитие атеросклероза (сороковые-пятидесятые годы);
- ЛПНП и ЛПОНП являются атерогенными, а ЛПВП - антиатерогенными и защищают организм от атеросклероза (шестидесятые - семидесятые годы);
- модифицированые ЛПНП и ЛПОНП, а также независимая от них фракция ЛП (а) повинны в развитии атеросклероза (восьмидесятые - девяностые годы).
Завершая хронологический подход к рассматриваемой проблеме, можно выразить надежду, что наши знания о роли ЛП, их фракций и субфракций в атерогенезе к столетию создания холестериновой модели атеросклероза (2013 год) пополнятся новыми фундаментальными данными.
Таблица 1 Основные аполипопротеиды плазмы крови
человека.
| Обозначение | Место синтеза | ЛП, где данный апо явл. Главным белком или проявляет специфическую функцию. | Функция |
| A-I A-II A-IV B-100 B-48 C-I C-II C-III D E F,H,J | Кишечник, печень Печень, кишечник Кишечник, печень Печень Кишечник, печень Печень Печень Печень и многие др. ткани Печень и многие др. ткани, в т.ч. макрофаги Мало изучены | ЛПВП ЛПВП ХМ, ЛПВП, свободная форма ЛПОНП, ЛПППП, ЛПНП ХМ, ХМ,ЛПОНП ХМ, ЛПОНП, ЛПВП ХМ, ЛПОНП ЛПВП ХМ, ЛПВП | Лиганд для апо А-1-рецептора. Кофактор ЛХАТ. Участие в "обратном" транспорте ХС Связывание ФЛ. Активация ЛПЛ и ПТГЛ Активация ЛХАТ. Участие в "обратном" транспорте ХС. Лиганд для апо В,Е-рецептора. Секреция ЛПОНП. Секреция ХМ. Активация ЛХАТ. Ингибирование фосфолипазы А2. Активация ЛХАТ. Ингибирование ЛПЛ Транспорт ЭХС Лиганд для апо В,Е- и апо Е-рецепторов. Участие в "обратном" транспорте ХС. |
Литература:
1. Физико-химические аспекты атерогенеза. Сборник научных трудов. М.1986г.
2. VI Симпозиум по биохимии липидов. С.-Петербург,1994г.
3. Dujvne C. Drug intervention trials in dyslipidemia: the past and the future. Clin Cardiol. 1991;14:148-52
4. Hoffman RM, Gaweral HS. Antyoxidants and the prevention of coronary heart disease. Arch Intern Med. 1995;155:241-6
5. Elinder LS, Walldius G. Antioxidants and the atherosclerosis progression: unresolved questions. Curr Opin Lipidol. 1994;5:265-8
6. Steinberg D. Clinical trials of anioxidants in atherosclerosis:are we doing the right thing? Lancet. 1995;346:36-8
7. Knekt P, Reunanen A, Jarvinen R, Seppanen R? Heliovaara M, Aromaa A. Antioxidant vitamin intake and coronary mortalyin a longitudinal population study. Am J Epidemiol. 1994;139:180-90
Похожие работы
... ферментов, уменьшается также разрушение фосфолипидов как источников субстратов для перекисного окисления). Во многих ситуациях использование антиоксидантной активности антигипоксантов является более рациональным, чем применение антиоксидантов, поскольку профилактика заболевания (в данном случае предотвращение образования свободных радикалов антигипоксантами) обычно эффективнее его лечения ( ...
... Q, ферменты супероксиддисмутаза, каталаза, глутатионпероксидаза и т.д.). Экзогенными поступают с пищей (например, витамин С, селен, флавоноиды и т.д.). Вот, в общем-то, и вся наука. Теперь переходим к мифам. Миф 1. Антиоксидантов в пище мало! Реальность. Это, смотря, чем вы питаетесь. Если гамбургерами и кока-колой или соблюдаете жесткую белковую диету, тогда конечно. Если же в вашем рационе ...
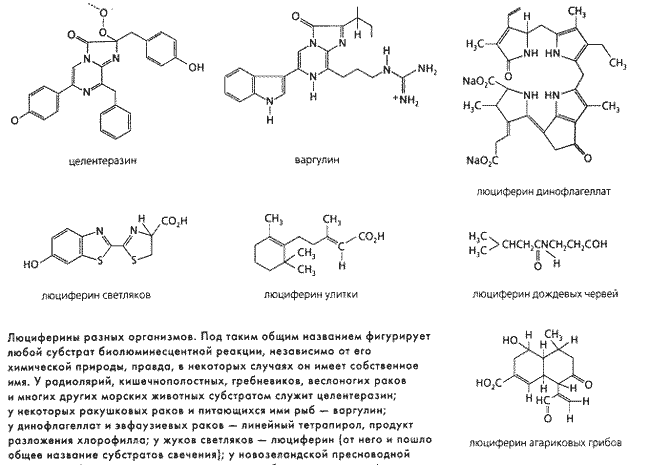
... в нескольких нестабильных, или возбужденных, состояниях. Одно из них – синглетное. Возврат электронов из синглетного состояния в триплетное сопровождается испусканием фотонов, правда, «маленьких», инфракрасных. Свечение же организмов обычно синее или зеленое. Причина, как полагают, в том, что из возбужденного состояния в основное переходят сразу два или более атомов кислорода и энергии этих ...
... кальциевых каналов. Нимодипин Нимодипин - блокатор кальциевых каналов, производное дигидропиридина. Избирательно взаимодействует с кальциевыми каналами типа L и блокирует трансмембранное поступление ионов кальция. Фармакологическое действие: Особенностью препарата является преимущественное влияние на кровоснабжение мозга. Препарат оказывает дилатирующее действие на сосуды головного мозга ...
0 комментариев