Навигация
Коррозия и защита металлов
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ............................................................................................................... 2
ХИМИЧЕСКАЯ КОРРОЗИЯ.................................................................................. 3
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ ПОД ДЕЙСТВИЕМ ВНУТРЕННИХ МАКРО- И МИКРОГАЛЬВАНИЧЕСКИХ ПАР.................................................. 7
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ, ВОЗНИКАЮЩАЯ ПОД ДЕЙСТВИЕМ ВНЕШНЕЙ РАЗНОСТИ ПОТЕНЦИАЛОВ......................................................... 9
3АЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ............................................................. 10
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ ВНЕШНИМ ПОТЕНЦИАЛОМ..... 15
список литературы..................................................................................... 16
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ. ХИМИЧЕСКАЯ СТОЙКОСТЬ МАТЕРИАЛОВ
ВВЕДЕНИЕПолучение металлов из их природных соединений всегда сопровождается значительной затратой энергии. Исключение составляют только металлы, встречающиеся в природе в свободном виде: золото, серебро, платина, ртуть. Энергия, затраченная на получение металлов, накапливается в них как свободная энергия Гиббса и делает их химически активными веществами, переходящими в результате взаимодействия с окружающей средой в состояние положительно заряженных ионов:
Меn++ nе ® Ме0 (![]() G>0); Ме0 – ne ® Ме n+ (
G>0); Ме0 – ne ® Ме n+ (![]() G <0).
G <0).
металлургия коррозия
Самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с окружающей средой, происходящий с выделением энергии и рассеиванием вешества (рюст энтропии), называется коррозией. Коррозионные процессы протекают ннеобратимо в соответствии со вторым началом термодинамики.
Медленное выделение тепловой энергии почти без повышения температуры или электрической энергии с ничтожно малыми разностями потенциалов не дает возможности использовать выделяющуюся энергию — происходит рассеивание энергии (рост тепловой части энтропии). Продукты коррозии, как правило, рассеиваются в процессе эксплуатации металлических конструкций, что ведет к росту энтропии (концентрационная часть энтропии). Необратимые коррозионные процессы наносят большой вред народному хозяйству.
Создан Международный институт коррозии и защиты металлов, координирующий работы в этой области, ведущиеся во всех странах. Подсчитано, что около 20% ежегодной выплавки металлов расходуется в коррозионных процессах. Большой вред приносит коррозия в машиностроении, так как из-за коррозионного разрушения какой-нибудь одной детали может выйти из строя машина, стоящая нередко десятки и сотни тысяч рублей. Коррозия снижает точность показаний приборов и стабильность их работы во времени. Незначительная коррозия электрического контакта приводит к отказу при его включении. Меры борьбы с коррозионными процессами являются актуальной задачей современной техники.
Виды коррозионных разрушений. Изменение поверхности металла в результате коррозионных процессов может быть различным в зависимости от свойств металла и коррозионной среды. На их развитие очень сильно влияет механическая напряженность металла.
Наиболее опасной является местная коррозия, которая при малой общей коррозии в отдельных местах может создать резкую концентрацию механических напряжений, в свою очередь содействующих дальнейшему разрушрнию металла.
Выявляемые микроскопическим исследованием коррозионные разрушения все опасны и особенно интеркристаллитная коррозия, ослабляющая связь между металлическими зернми, и транскристаллитняя коррозия, возникающая под действием, механических напряжений и приводящая к развитию трещин. Наименее опасна селективная коррозия — результат травления стали при сохранении карбидных зерен (цементит, мартенсит) или потеря цинка из латуней.
Типы коррозионных процессов. Часто одни и те же типы коррозионных разрушений металла могут быть вызваны разными процессами коррозии. Коррозионные процессы бывает трудно отнести только к какому-либо определенному типу, так как они нередко происходят одновременно (атмосферная коррозия). По природе гетерогенных процессов взаимодействия окружающей среды с металлами эти процессы можно разделить на два основных типа.
Химическая коррозия, развивающаяся в отсутствие электролитов. Она протекает главным образом при температурах, исключающих возможность образования насыщенного пара воды, — высокотемпературная или газовая коррозия. Этот же вид коррозии может возникать и в неводных органических средах (галогенозамещенные, тиосоединения и т. д.).
Электрохимическая коррозия, идущая в электролитной среде под действием внутренних микро- или макрогальванических пар или внешней разности потенциалов.
Оба типа коррозионных процессов определяются термодинамически изменением свободной энергии Гиббса:
![]() G0 = – RT ln K = –
G0 = – RT ln K = – ![]() e0nF (1)
e0nF (1)
Процессы высокотемпературной химической коррозии определяются константой равновесия обратимых гетерогенных реакций, и для их исследования мы используем первую часть равенства (1).
Для исследования процессов электрохимической коррозии необходимо рассматривать выражение DG0, содержащее разность потенциалов и величину заряда, перенесенного растворяющимся веществом, т. е. электрическую работу.
Кроме термодинамической вероятности процесса необходимо рассматривать кинетику процесса, так как она определяет долговечность и надежность машин и конструкций, работающих в коррозионных средах.
Существенно влияет на коррозионные процессы уровень внешних или внутренних (остаточных) напряжений и их распределение в металле изделия. На коррозию сталей и других металлов, особенно в контакте с грунтом (землей), могут влиять продукты жизнедеятельности микроорганизмов, значительно ускоряющие процессы коррозии.
ХИМИЧЕСКАЯ КОРРОЗИЯХимической коррозии подвержены детали и узлы машин, работающих при высоких температурах, — двигатели поршневого и турбинного типа, ракетные двигатели и т. п. Химическое сродство большинства металлов к кислороду при высоких температурах почти неограниченно, так как оксиды всех технически важных металлов способны растворяться в металлах и уходить из равновесной системы:
![]() 2Ме(т) + O2(г) 2МеО(т);
2Ме(т) + O2(г) 2МеО(т);
![]() МеО(т) [МеО] (р-р)
МеО(т) [МеО] (р-р)
В этих условиях окисление всегда возможно, но наряду с растворением оксида появляется и оксидный слой на поверхности металла, который может тормозить процесс окисления.
Скорость окисления металла зависит от скорости собственно химической реакции и скорости диффузии окислителя через пленку, а поэтому защитное действие пленки тем выше, чем лучше ее сплошность и ниже диффузионная способность. Сплошность пленки, образующейся на поверхности металла, можно оценить по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла (фактор Пиллинга—Бэдвордса). Рассмотрим реакцию окисления металла
xMe + уO ® MexOy
объем полученного оксида:
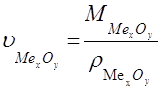
где ![]() — молекулярная масса;
— молекулярная масса;
![]() - плотность;
- плотность;
объем израсходованного металла:
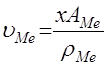
где ![]() — атомная масса;
— атомная масса;
![]() — плотность;
— плотность;
отсюда
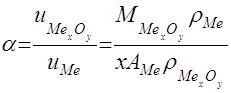 (2)
(2)
Коэффициент a (фактор Пиллинга — Бэдвордса) у разных металлов имеет разные значения (табл. 1).
Таблица 1. Значение коэффициента a для некоторых металлов
| Металл | Оксид | a | Металл | Оксид | a |
| Mg | MgO | 0.79 | Zn | ZnO | 1.58 |
| Pb | PbO | 1.15 | Zr | ZrO2 | 1.60 |
| Cd | CdO | 1.27 | Be | BeO | 1.67 |
| Al | Al2O2 | 1.31 | Cu | Cu2O | 1.67 |
| Sn | SnO2 | 1.33 | Cu | CuO | 1.74 |
| Ni | NiO | 1.52 | Ti | Ti2O3 | 1.76 |
| Nb | NbO | 1.57 | Cr | Cr2O3 | 2.02 |
| Nb | Nb2O3 | 2.81 |
Металлы, у которых a<1, не могут создавать сплошные оксидные слои, и через несплошности в слое (трещины) кислород свободно проникает к поверхности металла.
Сплошные и устойчивые оксидные слои образуются при a = 1,2—1,6, но при больших значениях a пленки получаются несплошные, легко отделяющиеся от поверхности металла (железная окалина) в результате возникающих внутренних напряжений.
Фактор Пиллинга — Бэдвордса дает очень приближенную оценку, так как состав оксидных слоев имеет большую широту области гомогенности, что отражается и на плотности оксида. Так, например, для хрома a = 2,02 (по чистым фазам), но пленка оксида, образующегося на нем, весьма устойчива к действию окружающей среды. Толщина оксидной пленки на поверхности металла меняется в зависимости от времени. При низких температурах толщина пленки изменяется по логарифмическому закону и асимптотически приближается к некоторой постоянной величине:
d = d0 (1 – e-kSt) (3)
где d — толщина пленки; d0 —постоянная, предельная величина; k — константа скорости гетерогенной реакции; S — поверхность раздела (1 см2), t — время. При t ® ¥ d ® d0. Уравнение (3) есть кинетическое уравнение для гетерогенной реакции, в которой площадь контакта не изменяется со временем. В рассмотренном случае лимитирующим фактором является скорость реакции, а не диффузия.
При больших температурах четко выявляется параболический закон роста, т. е. затухание диффузии с ростом толщины слоя. В этом случае лимитирующим процессом является уже диффузия, но не скорость химической реакции, а условия диффузии можно определить соотношением
d grad C = const (4)
где d — толщина оксидного слоя; grad C — градиент концентрации кислорода по толщине пленки. После соответствующих преобразований уравнения диффузии и его интегрирования получаем закон роста пленки:
![]() (5)
(5)
где DT — коэффициент диффузии; P = d grad C; M — молекулярная масса оксида; r — плотность оксида.
Если пленка оксида такова, что кислород в ней обладает высокой диффузионной способностью при высоких температурах, можно считать grad C = const. В этом случае возникает линейный закон роста пленки:
![]() (6)
(6)
В зависимости от температуры для одного и того же окисляющегося металла проявляются различные законы роста пленкиоксида. Например, для титана при низких температурах выполняется логарифмический закон роста пленки; она пассивирует его очень стабильно. При 900—1100К он окисляется уже по параболическому закону, т. е. пассивируется частично, а при более .высоких температурах окисляется по линейному закону, т. е. пленка оксидов перестает быть защитной (Н. Д. Томашев).
Строение оксидных пленок очень сложно и зависит от характера образующихся между металлом и кислородом соединений и процессов диффузии. Процессы диффузии в оксидных слоях могут происходить за счет перемещения ионов кислорода O2- от газовой фазы по направлению к металлу или ионов Ме+ в противоположном направлении. Ионы перемещаются по вакансиям в кристаллических решетках оксидов.
Если в толще образовавшейся пленки преимущественно движутся ионы O2-, то это приводит к утолщению пленки за счет уменьшения толщины металла, т. е. общая толщина коррелирующего образца практически не изменяется.
Наоборот, если преимущественно перемещаются ионы Ме+, то пленка растет в направлении газовой фазы (O2) и размер корроди-рующего образца растет.
Может быть и промежуточный случай — одновременного движения ионов O2- и Ме+, что вызывает рост пленки в обоих направлениях. Диффузия ионов создает неравномерное электрическое поле вблизи поверхности металла
Оксидные, нитридные и другие пленки на металлах обычно приобретают свойства полупроводимости.
Сложный теоретический вопрос о развитии оксидных и иных слоев на поверхности металлов имеет практическое значение в технологии машиностроения, так как изменение размеров деталей после их оксидирования необходимо учитывать (допуск на обработку).
У металлов с переменной степенью окисления строение пленки по толщине неодинаковое.
Наилучшие по стойкости оксидные пленки обладают структурой шпинелей RO *R2O2; образуясь на поверхности сплавов (IХ18Н9), они служат надежной защитой от коррозии (FeO * Cr2O3 или NiO * Cr2O3).
Практически вообще не пасси-вируются при высоких температурах d-металлы с высокими степенями окисления, образующие летучие оксиды: Мо, W, Nb, Та, Rе. Температуры кипения их оксидов ниже температур плавления соответствующих металлов, и поэтому оксиды улетают в газовую фазу, обнажая поверхность металла для дальнейшего окисления.
Изменение состава металла в результате газовой коррозии. Если образование оксидного слоя при высокой температуре сопровождается интенсивной диффузией кислорода внутрь металла, то это приводит к изменению его состава за счет окисления легирующих компонентов. Особенно это заметно на конструкционных сталях, в поверхностных слоях которых происходит окисление углерода — ферритная полоска, образование которой сопровождается потерей прочности, особенно для тонкостенных изделий. Взаимодействие сталей с окисляющими средами можно представить в виде следующих уравнений:
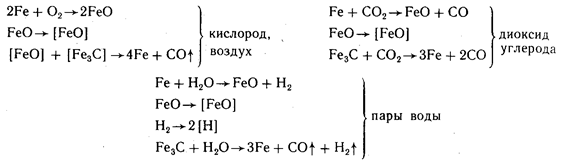
Последний случай — наиболее опасный, так как водород, растворяясь в стали, создает повышенную хрупкость металла. При тонкостенных конструкциях это влияние газовой коррозии на снижение прочности особенно заметно.
Химическая коррозия в неводных средах. Эти процессы харак терны для эксплуатации химико-технологического оборудования. Несмотря на сложность их развития, в прийципе они представляют собой обычные гетерогенные химические реакции:
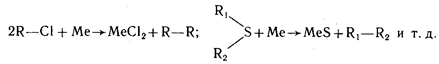
(где R—органические радикалы).
Разрыв ковалентных связей и переход их в ионные легче совершается при повышенных температурах. Особенно легко перестройка связей идет в присутствии следов воды. Последнее обстоятельство имеет место при коррозии питательной аппаратуры двигателей внутреннего сгорания (плунжерные пары, форсунки), работающих на топливе с примесями сернистых соединений.
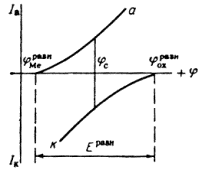
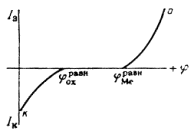
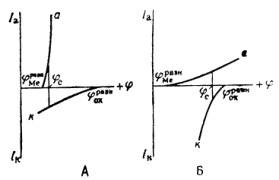
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ ПОД ДЕЙСТВИЕМ ВНУТРЕННИХ МАКРО- И МИКРОГАЛЬВАНИЧЕСКИХ ПАРРаньше электрохимическую коррозию называли гальванической коррозией, так как разрушение металла происходит под действием возникающих гальванических пар.
Рассмотрим различные случаи возникновения коррозионных гальванических пар.
1. Контакт с электролитом двух разных металлов в случае сочетания в одном узле или детали металлов различной активности в данной среде, или в случае применения сплава эвтектического типа из двух металлов разной активности.
2. Контакт металла и его соединения, обладающего металлообразными или полупроводниковыми свойствами. В любом случае свобоЛный металл имеет отрицательный электрический заряд, а соединение — положительный заряд, так как в нем часть электронов проводимости связана. Это также справедливо и для интер-металлидов.
Похожие работы
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...
... агрессивных средах и при наличии различных сопутствующих физических факторов; 3. Определить методы применения противокоррозионных защитных покрытий, в первую очередь лакокрасочных. Обзорно-аналитическая часть Характеристика коррозионных процессов Коррозия металлов - разрушение металлов вследствие физико-химического воздействия внешней среды, при этом металл переходит в окисленное (ионное) ...

0 комментариев