Навигация
Разложение малахита
2. Разложение малахита.
Ход работы
В штативе закрепляем сухую колбу Вюрца, поместив туда 5 г малахита. Колбу соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа. Ведем нагревание колбы спиртовкой. Реакция начинает идти при температуре 100°C, идет интенсивно при температуре 150°C.
Уравнение реакции
Cu2(OH)2CO3 ® 2CuO+H2O+CO2
Наблюдения
Получаемый газ собираем в колбу на 500 мл (заполнение ведем до получения постоянной массы, проверку заполненности колбы ведем по горящей лучине), реакция протекает очень быстро и интенсивно с образованием черного порошка оксида меди (II). Проделываем три пробега.
Установка та же, что и в опыте 1.
3. Термическое разложение карбоната магния.
Ход работы
В штативе закрепляем сухую колбу Вюрца, поместив туда 2 г магнезита. Колбу соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа. Ведем нагревание колбы спиртовкой.
Уравнение реакции
MgCO3®MgO+CO2
Наблюдения
Для разложения необходима температура 540°C. Данной температуры достичь не удалось, газ не был получен.
Установка та же, что и в опыте 1.
4. Взаимодействие мрамора с соляной кислотой.
Ход работы
В проверенный на герметичность аппарат Киппа закладываем 3 г карбоната кальция и наливаем раствор соляной кислоты (1: 2,5). Аппарат Киппа соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа.
Уравнение реакции
CaCO3+2HCl®CaCl2+CO2+H2O
Наблюдения
Получаемый газ собираем в колбу на 500 мл (заполнение ведем до получения постоянной массы, проверку заполненности колбы ведем по горящей лучине), реакция идет умеренно. Газ получается чистый. Делаем три пробега.
Установка
5. Декарбоксилирование карбоновой кислоты.
Ход работы
В штативе закрепляем сухую колбу Вюрца, поместив туда 2,5 г лимонной кислоты. В колбу Вюрца помещаем катализатор - медь и ведем нагревание. Колбу соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа.
Уравнение реакции
Наблюдения
Реакция декарбоксилирования лимонной кислоты идет очень медленно даже в присутствии медного катализатора. При температуре °С лимонная кислота начинает закипать и разлагаться. В результате опыта получили небольшое количество углекислого газа, т.к. все дикарбоновые кислоты трудно декарбоксилируются.
Столбиковая диаграмма относительной ошибки
Сводная таблица результатов
| масса колбы с пробкой и воздухом m1, г | масса колбы с пробкой и СО2 m2, г | масса воздуха в колбе m3, г | масса колбы с пробкой m4, г | масса СО2 в колбе m, г | давление, кПа Р | температура, град К Т | объем колбы V | объем колбы при н.у. V0 | молярная масса СО2, вычисленная методом | относительная ошибка, % | ||
| А г/моль | В г/моль | С г/моль | ||||||||||
| разложение гидрокарбоната натрия | ||||||||||||
| 172,51 | 172,91 | 0,7801687 | 171,72984 | 1,18016 | 102,3915 | 296,5 | 0,650 | 0,60478 | 43,86825 | 43,690705 | 43,8682 | 0,31 |
| разложение малахита | ||||||||||||
| 135,27 | 135,69 | 0,8609581 | 134,40905 | 1,290326 | 102,9248 | 297,5 | 0,716 | 0,667494 | 43,462586 | 43,286673 | 43,306715 | 1,24 |
| взаимодействие мрамора с соляной кислотой | ||||||||||||
| 193,69 | 194,06 | 0,7899026 | 192,8801 | 1,179945 | 102,3915 | 296 | 0,657 | 0,612327 | 43,32105 | 43,146258 | 43,166233 | 1,5 |
| декарбоксилирование лимонной кислоты | ||||||||||||
| 135,13 | 135,48 | 0,8428581 | 134,2871 | 1,19283 | 100,5917 | 297 | 0,716 | 0,65337 | 41,04139 | 40,875285 | 40,89207 | 0,7 |
Поправка: берем средние величины результатов.
Приложение 13
Растворенный углекислый газ в воде определяет жизнедеятельность в океане. Углекислый газ является “продуктом питания” фитопланктона. Максимальное содержание углекислого газа приурочено к глубинным слоям воды. Растворимость углекислоты возрастает в холодных водах и уменьшается при нагревании. В связи с этим в зимние месяцы часть углекислого газа переходит из атмосферы в океаническую воду, а летом – обратно.
Углекислый газ принимает участие в химических реакциях, в частности регулирует карбонатное равновесие. Воды, обогащенные углекислым газом, агрессивны по отношению к CaCO3, удаление углекислого газа из воды при ее нагревании способствует осаждению карбонатов. Велика роль углекислого газа в фотосинтезе, в процессе которого образуется органическое вещество. В результате фотосинтеза в океане ежегодно образуется около 1017 г биомассы фитопланктона.
Выяснив, что углекислый газ может поглощать океан как северного, так и южного полушария, ученых заинтересовал еще один вопрос: поглощает ли южная часть Тихого океана углекислый газ во все сезоны года?
Известно, что обильный планктон южного полушария играет важную роль в природном механизме, “выкачивающем” диоксид углерода из атмосферы и отлагающем ее в меловые осадочные породы морского дна. Если его эффективность понизится, количество углекислого газа в воздухе возрастает, что будет способствовать парниковому эффекту, вызывающему глобальное потепление.
На сессии Американского географического союза в декабре 1991 г. были представлены первые материалы о концентрациях углекислого газа в водах южной части Тихого океана в осенний период. Исследования выполняли сотрудники Тихоокеанской лаборатории Национального управления США по изучению океана и атмосферы (НОАА) Р.Фили и П.Мерфи при участии Р.Гаммона – Вашингтонский университет, спонсор исследования – программа НОАА по глобальному изменению климата.
Обобщенные данные непосредственных химических анализов, которые были выполнены с 1984 по 1989 г. в Тихом океане от экватора до Южного полярного круга. Полученные результаты ставят под сомнение представление о роли этой области Мирового океана как активного поглотителя углекислого газа из атмосферы.
На основании прежних исследований считалось, что около половины углекислого газа, поступающего в атмосферу со всей земной поверхности при сжигании ископаемого топлива и сокращении площади лесных массивов, в ней и остается, а другая половина – “пропавший углерод” – поглощается наземными растениями и водами океана, в основном южной частью Тихого океана. Считалось также, что область высоких концентраций углекислого газа в восточной половине южной части Тихого океана находится в приблизительном балансе с областью низких концентраций западной половины.
По мнению Фили, “область высоких концентраций углекислого газа – это те районы, где океан отдает этот газ в атмосферу, и наоборот, в области с низкими концентрациями углекислого газа воды поглощают его из атмосферы”. Однако количество поглощаемой и отдаваемой углекислоты зависит от скорости ветра: чем он сильнее, тем больше углекислого газа переносится через границу вода-воздух. Этот фактор заставил исследователей тщательно проанализировать данные по ветровому режиму южной части Тихого океана. Однако вследствие суровых погодных условий метеонаблюдения на судах велись эпизодически. Пришлось для анализа использовать также имеющийся в НОАА массив сведений о ветрах, которые отмечались китобойными судами в прошлом веке, особенно в полосе между 40 и 50 градусами ю.ш. Эта полоса хорошо известна мореплавателям как “ревущие сороковые”, где скорость ветра превышает 70 км/ч. Обобщенные данные по ветрам были сопоставлены с концентрациями углекислого газа в поверхностных водах и приповерхностных слоях воздуха для оценки потоков поглощаемого или выделяемого углекислого газа в различных районах южной части Тихого океана. Согласно полученным результатам, в осенний сезон в Южном полушарии количество углекислого газа, выделяемого в атмосферу из океана на востоке, почти совпадает с количеством, поглощаемым океаном на западе.
Ученые допускают, что в иные сезоны южная часть Тихого океана действительно является мощным поглотителем углекислого газа. Это вопрос и практика будущего.
Следующий вопрос, который заинтересовал ученых – это механизм осаждения карбонатов в условиях фотосинтеза. Для простоты изобразим это в виде небольшого рисунка (его можно использовать как МП-картосхему на уроках химии и географии).
Рис. 2 Схема осаждения атмосферного углекислого газа, образование морских отложений.
Экспериментально изучена кинетика осаждения CaCO3 при 20°C и 30°C в условиях пересыщений, достигаемых при фотосинтезе в морской воде. Выяснена возможность спонтанного осаждения CaCO3 в условиях Багамской Банки.
Проблема осаждения карбоната кальция в океане привлекает внимание исследователей в течение последних 40 лет. Две основные точки зрения – о выделении CaCO3 исключительно биогенным путем и о спонтанном физико-химическом осаждении непосредственно из морской воды – имеют подтверждения как в экспериментальных работах, так и в результатах натуральных наблюдений. Особенно большое значение придается этой проблеме в связи с интенсивным осаждением карбонатных илов на Багамской Банке, Персидском заливе, которое часто рассматривают в качестве аналога карбонатообразования в древних морях.
Эксперименты по этому вопросу были проведены московскими учеными О.С. Покровским и В.С. Савенко (МГУ им.М.В. Ломоносова). Что же им удалось получить и изучить?
В экспериментах по изучению спонтанного физико-химического осаждения CaCO3 в морской воде была показана возможность непосредственного осаждения карбоната кальция в условиях морской воды, отвечающих районам интенсивного карбонатонакопления. Данные по Багамской Банке подтверждают действие механизма прямого физико-химического осаждения из морской воды. Но имеются многочисленные данные, которые доказывают основную роль в выделении CaCO3 сине-зеленых водорослей. В ходе фотосинтеза происходит значительное увеличение pH, что может приводить к химическому осаждению CaCO3 на внешних поверхностях клеток. Наблюдения показали, что суточные изменения pH в непосредственной близости от скоплений водорослей могут достигать 7,4 – 9,2, что приводит к выпадению CaCO3.
Несмотря на большую роль водного фотосинтеза в осаждении карбонатов, физико-химический анализ этого процесса не проводился, а имеющиеся данные по гомогенному осаждению CaCO3 не могут быть непосредственно использованы в силу изменения концентраций неорганического углерода, растворенных фосфатов, pH, происходящих при фотосинтезе.
Рассмотрим теоретически изменения состава среды, непосредственно примыкающей к фотосинтезирующим клеткам. При фотосинтезе, вследствие реакций образования электронейтральных органических соединений происходит компенсационное выделение ионов OH-, что сопровождается увеличением pH и переходом части ионов HCO3- в CO32-
n H2CO3 ® (CH2O)n + n O2;
n HCO3- + n H2O ® (CH2O)n + n O2+ n OH-;
n CO32- + 2n H2O ® (CH2O)n + n O2+ 2n OH-;
Используя условие электронейтральности – постоянство общей щелочности – Alk
Alk = [HCO3-] + 2[CO32-] + [H2BO3]- + [OH]-
и смешанные константы диссоциации, можно выразить общую концентрацию неорганического углерода Ст как функцию активности ионов водорода (10-pH)
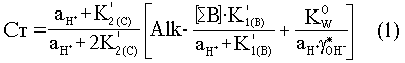
Необходимо знать, что в ходе водного фотосинтеза изменение концентрации ионов CO32- слагается из двух одновременно действующих и противоположно направленных процессов: уменьшением общего количества растворенного неорганического углерода Ст, который расходуется на синтез органических соединений, и увеличением концентрации CO32- в результате подщелачивания среды:
HCO3- + OH- ® CO32- + H2O
Это указывает на существование экстремального пересыщения, выше которого происходит снижение пересыщения при дальнейшем развитии фотосинтеза. Используя уравнение для пересыщения
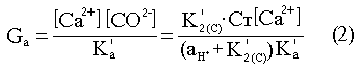
| Alk, M | [SB], M | [Ca2+], M | K'2(C) | K11(B) | K0w | g*OH- | K'arag | |
| 20°C | 2,4·10-3 | 4,3·10-4 | 0,01 | 6,59· ·10-10 | 1,9·10-9 | 6,81· ·10-15 | 0,218 | 7,14· ·10-7 |
| 30°C | 2,4·10-3 | 4,3·10-4 | 0,01 | 8,76· ·10-10 | 2,26· ·10-9 | 1,44· ·10-14 | 0,202 | 7,65· ·10-7 |
Табл.5 Расчетные параметры для уравнений (1) и (2),
где [ ] – концентрации; K'a – концентрационное произведение растворимости арагонита, являющегося основной фазой выпадающего из морской воды карбоната кальция – можно рассчитать зависимость пересыщения от pH.
В таблице 5 приведены значения расчетных параметров в уравнениях (1) и (2) для морской воды с соленостью 35%. При температурах 20°C и 30°C, охватывающих интервал поверхностных вод с наиболее интенсивным фотосинтезом. На рис. 3,а представлена кривая снижения концентрации растворенного углерода в системе в ходе фотосинтеза, а на рис. 3,б – зависимость пересыщения от интенсивности фотосинтеза (величины pH).
Как видно из этих рисунков, полного выделения растворенной углекислоты в фотосинтезирующих природных системах не происходит. Максимальное значение пересыщения – 11 – 12 раз по арагониту достигается уже при величинах pH = 9,2 – 9,4, реализуемых в природной обстановке.
Поскольку уравнения зависимости индукционного периода осаждения CaCO3 от пересыщения относятся к условиям морской воды с Ст = 2,33 ммоль/л = const, нельзя считать, что выведенные закономерности напрямую приложимы к условиям фотосинтеза. Дополнительным фактором неопределенности является влияние фосфат-ионов – главных ингибиторов осаждения CaCO3 в природе. Закономерное выведение фосфора из раствора через пищевые цепи организмов может сильно изменить оценку скорости осаждения карбоната кальция.
Были проведены и специальные исследования по изучению кинетики спонтанного осаждения карбоната кальция в условиях, моделирующих фотосинтез в морской воде. В отличие от более ранних экспериментов, в этой работе проводились по два параллельных опыта при индукционных периодах менее 500 минут, что позволило снизить относительную ошибку измерений до 10%. Величины индукционных периодов осаждения определяли визуально или спектрофотометрически. В слабопересыщенных растворах, в силу трудности обнаружения малого количества осадка, основным критерием с начала осаждения было уменьшение pH на заранее заданную величину. Дополнительный контроль карбонатной щелочности, измеренной в нескольких пробах, отфильтрованных через мембранный фильтр после окончания индукционного периода, показал ее заметное уменьшение. Это подтверждает надежность критерия снижения pH в качестве мер индукционного периода. Эксперименты проводили в закрытой ячейке при 20±0,5°C и 30±0,1°C, термостатируемой с помощью водного термостата U15. Во всех опытах использовали искусственную морскую воду соленостью 35%, отфильтрованную сначала через бумажный фильтр, а затем через мебрану 0,45 мм.
Варьирование концентрации общего углерода достигали путем смешивания двух растворов морской воды: без HCO3- и содержащей 10 ммоль/л NaHCO3. Далее в раствор с известной концентрацией общего углерода добавляли несколько капель раствора NaOH до создания величины pH, отвечающей данному Ст в соответствии с уравнением (1) и рис.3. Фосфат вводили в виде точной аликвоты свежеприготовленной морской воды, содержащей 10-5 M PO43-.
Зависимость кинетики осаждения от pH
Поскольку интервал величин pH, достигаемых при фотосинтезе, весьма значителен, возникает вопрос о возможности зависимости кинетики осаждения не только от пересыщения, но и от pH.
Проведены специальные эксперименты при пересыщениях 10, 15 и 20 раз по арагониту в интервале pH = 7,6 – 10,2. Для каждого раствора морской воды с известным содержанием общего углерода (это достигали введением точного количества NaHCO3) добавлением раствора NaOH создавали такое значение pH, которое отвечало желаемому пересыщению. Для получения широкого интервала pH содержание Ст варьировали в 50 раз. Результаты представлены на рис.4. Как видим при pH от 7,7 до 9,8 в интервале протекания процесса фотосинтеза – кинетика осаждения не зависит от pH, но определяется только величиной пересыщения. Наблюдаемое при высоких pH резкое снижение индукционных периодов связано с формированием зародышей уже на стадии создания пересыщения и с возможностью осаждения Mg(OH)2, как это проявлялось визуально в опытах при pH = 10,1-10,2. Это происходило в силу превышения произведения растворимости Mg(OH)2; так, ученый Плэтфорд наблюдал появление осадка Mg(OH)2 при pH = 9,8-9,9. Согласно последним опытам, pH морской воды, равновесной с Mg(OH)2 составляет 9,70.
Моделирование осаждения при фотосинтезе
Используя полученное ранее уравнение зависимости индукционного периода от пересыщения G (при постоянной концентрации Ст = 2,33 ммоль/л)
lg t[мин] = 6,27 - 3,784 lg Ga (3)
Рис.4 Зависимость кинетики осаждения СаСО3 в морской воде от величины рН при постоянном пересыщении (Ст = 0,5 - 50 мМ)
можно по уравнениям (1, 2, 3) рассчитать ожидаемую кривую кинетики осаждения как функции величины pH, достигаемой при фотосинтезе. Из рис.5 видно, что расчетная кривая хорошо согласуется с экспериментальными данными, полученными при переменной концентрации Ст. Причина систематического отклонения опытных точек (пунктирная кривая) в сильнощелочной области при pH > 9,8 аналогична резкому снижению индукционных периодов при G = 10-15 на рис. 4 и, вероятно, связана с возникновением избыточного числа зародышей на стадии создания пересыщения при высоких pH.
Рис.5 Индукционные периоды осаждения CaCO3 в различных условиях фотосинтеза.
Сплошные кривые – расчет по уравнениям (3) – кривая 1, 20°C и (4) кривая 2, 30°C; пунктирные линии – экспериментальные данные.
без перемешивания при 20°C (кривая 3);
то же, с добавлением 3мкгР/л;
с перемешиванием при 30°C.
При 30°C в нормальной морской воде с 2,33 ммоль/л HCO3- было получено
lg t = 6,32 - 3,951 lg Ga (4)
Данные 11 экспериментов хорошо ложатся на прямую, с коэффициентом корреляции 0,994. Используя уравнения 1, 2 и 4, рассчитали ожидаемую кривую кинетики осаждения как функции pH при фотосинтезе до 30°C. Экспериментальные данные обнаружили хорошее согласие до pH < 9,2. Наблюдаемое отклонение в щелочной области связано с теми же причинами, что и при 20°C. Увеличение константы диссоциации воды (см. таблицу 5) в интервале 20–30°C приводит к снижению величины pH момента начала осаждения Mg(OH)2 на 0,3–0,4 единицы.
В неперемешиваемых растворах происходит увеличение длительности индукционных периодов примерно на порядок. Данные эксперименты при 20°C (пунктирная линия) подтверждают это. На рис.5 видно, что в опытах без перемешивания действительно происходит десятикратное уменьшение скорости осаждения.
Роль фосфатов.
Присутствие фосфатов – главных ингибиторов осаждения карбоната кальция – может сильно уменьшить скорость осаждения при фотосинтезе. Вместе с тем известно, что выделение фосфора при интенсивном цветении фитопланктона зачастую приводит к обнаружению аналитического нуля неорганических фосфатов в растворе. Полагая отношение P:C как 1:50 (по весу на сухое вещество в %) или 1:130 в атомных соотношениях, и максимальную начальную концентрацию фосфора 0,1 мг/л, вывели скорость выделения фосфатов в ходе фотосинтеза, используя уравнение (1). Расчеты показали, что уже при pH = 8,5 происходит полное извлечение всех растворенных неорганических фосфатов при 20°C. Это хорошо согласуется с опытами, которые при 25°C используются в уравнении
Ст = 135[PO43-] + 1860 (m моль/л) (5)
Как видно, в этом случае полное исчезновение фосфатов наблюдается при G = 1,86 ммоль/л, то есть pH = 8,55 (рис.3а).
Данные опыты были проведены с морской водой, содержащей 3 мкг/л фосфора (10-7 M[PO43-]), что близко к аналитическому нулю. Как видно из рис.4, не происходит систематических отклонений величин индукционных периодов сравнительно с безфосфатной морской водой. Таким образом, роль фосфатов при осаждении CaCO3 при фотосинтезе незначительна.
Рассматриваемая модель изменения концентрации растворенной углекислоты в ходе повышения pH при фотосинтезе предполагает закрытость системы по отношению к атмосферному резервуару углекислого газа. То есть допускается, что скорость изменения содержания углекислоты в результате фотосинтеза значительно превышает скорость обмена углекислого газа с атмосферой. Это предположение верно, т.к. кинетика взаимодействия с газовой фазой определяется несколькими сутками или неделями, тогда как фотосинтез происходит в течение одного светового дня (12 – 16 часов). Это подтверждается натуральными данными, которые по результатам дневных измерений приводят уравнение связи концентрации общей углекислоты и pH: при 25°C
Ст = -524 pH + 6285 (в mM)
pH = 7,7 - 8,4
На рис. 3а зависимость показана точечной линией.
Видна согласованность с расчетными данными. Отличия обусловлены интегральным характером величины pH, измеряемой в полевых условиях. Используя полученные данные, можно оценить начало выпадения CaCO3 в природных обстановках. Как видно из рис.4 в зонах интенсивного фотосинтеза с температурой поверхностных вод 20–30°C уже при pH = 8,5-8,8 должны создаваться условия, достаточные для гомогенного осаждения CaCO3. В связи с этим следует отметить, что величины pH = 8,5-8,6 (Ga = 5) часто наблюдаются в водах Багамской Банки. Учитывая хорошую локальную перемешиваемость вод (скорость течений достигает 18,5 см/с), которые меняются каждые 6 часов и варьируют по глубине, можно предполагать реальность процесса спонтанной нуклеации. Необходимые индукционные периоды не превышают 1–2 суток. Полученные в работе московских ученых изотопные данные по сравнению состава карбонатов водной взвеси, донных осадков и выделяемых водорослями, изучение гидродинамической обстановки придонных слоев и состава грунтов показывают, что 80–90% карбонатов осаждаются непосредственно из морской воды, а 10–20% имеют происхождение, связанное с жизнедеятельностью фитопланктона. Основываясь на полученных результатах, возможно рассчитать кинетику осаждения CaCO3 в процессе цветения фитопланктона или суточного фотосинтеза водорослевой колонии. Поскольку роль фосфатов ничтожна, а растворенное органическое вещество не оказывает существенного ингибирующего действия, можно использовать данные зависимости индукционного периода от pH при фотосинтезе. Для двух вариантов скоростей процесса 0,2 и 0,5 единиц pH/час – получены кривые зависимости момента выпадения осадка от времени, прошедшего с начала фотосинтеза. Каждой точке зависимости pH(G) от времени соответствует величина индукционного периода появления осадка для данных условий pH и G.(рис.6)
Рис.6 Экспериментальная модель кинетики осаждения CaCO3 при 20°C и различной скорости фотосинтеза.
t – время, прошедшее с момента начала фотосинтеза;
пунктирная правая кривая соотвестствует скорости фотосинтеза 0,5 ед. pH/час;
сплошная 0,2 ед. pH/час;
левые кривые отражают время с начала фотосинтеза до появления первого осадка.
Как видим, минимальное время, требуемое для появления осадка в условиях перемешиваемой среды в ходе фотосинтеза 8 – 12 часов после начала процесса. Гомогенное осаждение при фотосинтезе происходит в условиях переменного пересыщения, т.к. величина G в течение индукционного периода не постоянна. Однако, в силу логарифмической зависимости t от G, этот эффект не может значительно сократить время осаждения даже в условиях очень интенсивного фотосинтеза.
Таким образом, полученные экспериментальные данные дают основания считать, что в условиях интенсивного цветения фитопланктона или в среде водорослевой колонии достигаются пересыщения 10–11 раз по арагониту, и это вполне достаточно для спонтанного осаждения CaCO3. Обычно измеряемые величины pH вблизи фотосинтезирующих организмов являются интегральными характеристиками, поскольку отражают изменения pH в среднем по довольно большому объему раствора. Реальные же пересыщения в тонком приклеточном слое могут достигнуть гораздо больших значений.
Приложение 2
Тематическое планирование по теме “Подгруппа углерода”.
По программе курса химии для 8-11 классов средней общеобразовательной школы разработанной в лаборатории химического образования Института общеобразовательной школы РАО на данную тему отводится 7 часов.
Цели изучения данной темы:
Ознакомить учащихся с характерными свойствами простых и сложных веществ образованных элементами – неметаллами главной подгруппы 4 группы. Сформировать знания о кристаллических решетках, аллотропии, практическом применении веществ на примерах соединений углерода и кремния. Показать роль топлива в развитии экономики страны.
Развивать умения решать качественные задачи, а также расчетные химические задачи: определение массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего примеси.
Расширить представления о взаимосвязи количественных и качественных изменений при сравнении состава и свойств оксидов углерода.
Сформировать знания учащихся по данной теме используя их знания из курсов физики, географии, биологии.
Показать важность взаимосвязей между предметами.
Тематическое планирование в приложении.
Рекомендации по теме “ Подгруппа углерода”
Материал данной темы подвергся довольно значительным сокращениям (всего отводится 7 часов). Не рассматриваются подробно сведения о метане. Однако при изучении химических свойств углерода необходимо обратить внимание учащихся на то, что соединения углерода с водородом весьма многочисленны. В природе смеси углеводородов образуют скопления нефти и природного газа. Это 2 важных вида топлива – сведения из курса географии.
Изучение неметаллов будет завершаться сравнением свойств водородных соединений неметаллов разных групп. Сравнение этих свойств можно провести в такой последовательности: учитель напоминает, какие соединения с водородом могут образовывать различные химические элементы, в каких из этих соединений водород – электроотрицателен, а в каких – электроположителен, каково строение этих соединений и их физические свойства. Внимание учащихся привлекается к тому, какие химические свойства проявляют водородные соединения неметаллов разных групп периодической системы Д.И. Менделеева. Отмечается, что водородные соединения 6-7 групп неметаллов, растворяясь в воде, образуют кислоты, водородные соединения азота и фосфора в тех же условиях обнаруживают основные свойства, а водородные соединения углерода и кремния ни кислотных, ни основных свойств в водном растворе не проявляют. Затем прослеживается, как изменяется сила кислот и оснований, образуемых водородными соединениями неметаллов, при перемещении в подгруппах периодической системы Менделеева сверху вниз и слева направо и даются пояснения этим изменениям. Здесь уже можно привлечь для объяснения закон Кулона, изученный к этому времени в курсе физики.
Рекомендуется также пошаговая подача учебной информации для класса со средним уровнем усвоения материала. Данная система предлагает разъяснения темы небольшими порциями, закрепление каждой с помощью упражнений или в ходе выполнения учащимися самостоятельной работы.
1 шаг – Обратить внимание на то, что химические элементы главной подгруппы 4 группы стоят на границе с металлами. Напомнить, что химические элементы одной и той же подгруппы имеют общее и различное в свойствах, обусловленное их строением. Дается сравнительная характеристика химических элементов подгруппы углерода. Отмечают характер соединений.
2 шаг – Рассматривают свойства простых веществ образованных углеродом. Углерод – один из важнейших химических элементов живых организмов. Изучение аллотропных видоизменений: при характеристике свойств аллотропных видоизменений углерода имеется возможность привлекать знания знания, полученные на других уроках, например: из курса физики об электропроводности графита и использовании его в производстве электродов; из курсов биологии о том, что элемент углерод – основа жизни, он входит в состав белка; из курса географии о месторождениях графита и алмазов, атмосфера и углекислый газ.
3 шаг – Физические свойства углерода, можно изучить в процессе просмотра кинофильма “Углерод” и в ходе работы с раздаточным материалом.
4 шаг – Изучение химических свойств, сопровождающее демонстрацией химических опытов.
5 шаг – На основе изученных свойств делается вывод о применении. Доказывается схема – главная идея химии:

![]()
 свойства
свойства
строение применение
1 шаг – Дедуктивный подход – на основе положения в ПСХЭ, строения атома отсюда структура вещества.
2 шаг – Повторяем материал о аллотропных видоизменениях углерода в связи со строением атома (соединяются атомы ковалентной неполярной связью, образуя простые вещества состава Cn., где n – очень большая временная величина).
3 шаг – Исторический подход – постоянные поиски искусственного способа получения алмаза. Начались в 1881 году – английский ученый Ханней. В СССР осуществлен в 1961 в институте физики высоких давлений по технологии Верещагина. Карбин – состоит из линейных полимеров.
4 шаг – Алмаз, графит, карбин, уголь – родные братья. Различия их физических свойств определяется различной кристаллической решеткой. Химические свойства сходны.
5 шаг – Подчеркивается огромное практическое значение простого вещества.
Экологизация курса химии по теме “Углерод”
Данная программа разработана В.М. Назаренко, МПГУ им. В.И. Ленина. В данной программе более глубоко развиваются МПС, на каждом уроке постоянно привлекаются знания учащихся из других предметов. При изучении этой темы необходимо придерживаться нескольких направлений:
1. Выяснить причины, вызывающие нарушение круговорота углерода в природе.
2. Рассмотреть физико-химическую природу оксидов углерода и оксида кремния.
3. Сравнить возможность их использования живыми организмами в процессе жизнедеятельности.
4. Раскрыть вопросы охраны окружающей природной среды в связи с добычей и использованием ископаемого твердого топлива и производство цемента.
5. Живой мир на планете Земля – это мир углерода, единственный элемент, сохраняющий в цепях одновременно одинарные и кратные связи.
6. Различие от углерода у кремния из-за увеличения заряда ядра и радиуса атома ослабевает связь валентных электронов с ядром, возрастает металличность, уменьшается электроотрицательность. Цепи из атомов кремния неустойчивы.
7. Сформулировать проблему: почему углекислый газ усваивается растениями в процессе фотосинтеза, а оксид кремния IV нет. Ответ на него заключается в следующем: в процессе усвоения растениями углекислого газа лежит реакция карбоксилирования рибулозо-1,5-дифосфата (связывание углекислого газа в темновой фазе фотосинтеза). Эта реакция возможна из-за молекулярной природы углекислого газа (он легко диффундирует через устьица в лист) и из-за наличия в его молекуле двойных связей, при разрыве которых происходит присоединение углекислого газа к углеводу.
В оксиде кремния IV атомы кремния не способны к образованию кратных связей: при образовании химических связей два валентных электрона из четырех переходят на a-подуровень, поэтому с кислородом образуются только одинарные связи. Оставшиеся у кремния и у кислорода неспаренные электроны образуют новые связи с соседними молекулами оксида кремния IV, что приводит к созданию гигантского полимера с атомной кристаллической решеткой, твердого, исключительно плотного инертного вещества, не способного растворяться в воде. В этой форме кремний не усваивается растениями, не включается в обменные процессы и, следовательно, выбывает из круговорота веществ в природе. Но в некоторых формах он участвует в обменных процессах веществ живых организмов. Кремний входит в состав стеблей растений, тканей животных. А искусственно полученные препараты на основе кремния менее канцерогенны, чем на основе углерода, способствуют более эффективному заживлению ран, язв, срастанию костей.
Обсуждая вопрос “Круговорот углерода в природе” следует объяснить, что круговорот состоит из двух циклов:
| геологический | биологический |
| Представлен углекислым газом, выделяющимися в атмосферу, при сгорании ископаемого топлива, с вулканическими газами, из горячих источников, поверхностных слоев океанических вод, при выветривании горных пород, а также при осаждении карбонатов кальция и магния. Этот цикл очень длителен. | Цикл короткий и интенсивный: углерод в виде углекислого газа ассимилируется из атмосферы растениями и из биосферы вновь возвращается в геосферу – с растениями углерод попадает в организмы животных и человека, а затем при гниении животных и растительных останков – в почву и в виде углекислого газа в атмосферу. Средняя длительность существования соединений углерода в экосистемах 15 лет. |
Важно отметить главную роль океана, т.к. он адсорбирует из атмосферы примерно 30% углекислого газа, но также служит и его источником, выделяя его в атмосферу в районах теплых вод. Он является “насосом природы”, перекачивая углекислый газ из холодных в теплые районы, т.к. там давление углекислого газа в атмосфере выше (основано на физико-химическом свойстве углекислого газа к растворению в воде, в холодной лучше, чем в теплой). В океанической воде растворено 88% углерода, за 26 дней это количество возвращается в биосферу, остальной оседает в виде карбонатов. Установлено, что углекислого газа в 60 раз больше в водах рек, морей, океанов, чем в атмосфере.
Необходимо указать, что круговорот углерода в природе не замкнут. Углерод выходит из него часто на длительный срок в виде карбонатов, торфа, сапропели, гумуса. Каждый год в атмосферу Земли за счет естественных процессов поступает примерно 0,5Ч109 углекислого газа, тогда как антропогенное его поступление достигло 15-25Ч109 т, что в 100-150 раз больше.
Вместе с учащимися указать главные причины интенсивного притока углекислого газа в атмосферу.
CO2 ® в атмосферу из-за:
1. сжигания ископаемого топлива, отходов целлюлозно-бумажного производства;
2. огромного потребления кислорода металлургической и химической промышленностью;
3. истребления лесов, особенно тропических;
4. разрушения и минерализации лесных подстилок, дернины лугов, степей;
5. осушения болот, сопровождающегося интенсивным окислением торфяников;
6. уничтожения водной растительности в дельтах рек, загрязнения водоемов и морей, приводящего к угнетению фотосинтеза и, как следствие, к увеличению концентрации углекислого газа в атмосфере;
7. обжига известняка, производства цемента.
8. воздействия кислотных дождей на природные запасы карбонатов
CaCO3 + 2H+ ® Ca2+ + CO2 + H2O
Углекислый газ – “парниковый газ” – уменьшает тепловое излучение Земли, но увеличение его концентрации в атмосфере приводит к интенсивному осаждению на дне океана карбонатов кальция и магния, к снижению фотосинтеза (при избытке углекислый газ становится ингибитором этого процесса).
Влияние углекислого газа на человека: наркотическое действие, раздражение кожи, слизистых оболочек, в малых концентрациях возбуждает дыхательный центр, в очень больших – угнетает. Углекислый газ оказывает центральное сосудосуживающее и местное сосудорасширяющее действие, вызывает ацидоз (закисление), повышение содержания адреналина и норадреналина и уменьшение содержания аминокислот в крови, ингибирует действие ферментов в тканях. Животные менее чувствительны к углекислому газу, чем человек.
Наибольшую опасность для здоровья человека представляет оксид углерода II – продукт неполного сгорания топлива. Этот оксид соединяется с гемоглобином крови в 200-300 раз быстрее, чем кислород, образует очень прочное соединение – карбоксигемоглобин, диссоциация которого протекает в 3600 раз медленнее, чем оксигемоглобина (соединение гемоглобина с кислородом). В этом случае резко снижается обеспеченность тканей организма кислородом, развивается гипоксемия.
Оксид углерода II соединяется не только с гемоглобином крови, но и с миоглобином мышц. Он нарушает углеводный обмен, усиливая распад гликогена в печени, нарушая утилизацию глюкозы, повышая уровень сахара в крови, моче и в спинномозговой жидкости, нарушает обмен фосфора и азота, водно-солевой обмен, изменяет содержание витамина B6, повышает содержание липидов в плазме, что способствует усиленному отложению холестерина на стенках сосудов, свертываемость крови и проницаемость сосудов.
Важной проблемой загрязнения атмосферного воздуха является добыча и сжигание твердого топлива.
При сжигании твердого топлива в атмосферу поступает:
1. летучая зола с частицами несгоревшего топлива (2/3 топлива рассеивается в атмосфере) – CO, CO2, SO3, NO2, соединения F;
2. летучая зола с МИ;
3. зола торфа содержит U, Co, Cu, Ni, Pb, Zn.
Причины поступлений:
1. низкий КПД электростанций;
2. неудовлетворительная очистка топочных газов;
3. пыление угля при его добыче и перевозке, потери его при разгрузке и складировании.
Природоохранные меры:
1. предварительное извлечение из топлива серы (путем его гидрирования);
2. применение очистных аппаратов;
3. сокращение территорий, занимаемых ТЭС, путем более компактного их размещения;
4. создание лесозащитных зон.
5. использование шлаков и золоотвалов ТЭЦ в производстве строительных материалов. Другой источник загрязнения атмосферы – производство цемента.
Очаги пыления – барабаны для сушки угля и сырья, шаровые мельницы для угля, сырья и цемента, вращающиеся печи и транспортно-загрузочные установки.
В окрестностях крупного цементного завода П = 400 тыс.т цемента в год на расстоянии 2 км концентрация пыли в воздухе – 20 мг/м3.
Повышенная концентрация кремнезема в воздухе вызывает тяжелое заболевание легких – силикоз. При попадании SiO в дыхательные пути происходит его гидратация в присутствии тканевой жидкости. При этом на поверхности пылевидных частиц образуется коллоидный раствор кремниевой кислоты, которая и становится причиной заболевания: появляется одышка, боли, кашель.
Основные природоохранные меры:
1. полнейшая гирмитизация оборудования;
2. снижение отходов до 99% ;
3. экономное расходование продукции.
(Если на дне вагона останется слой цемента 0,5 см, то потери составят 150 кг).
Элементарный углерод попадает в атмосферу в виде сажи с выбросами. Длительность существования частиц элементарного углерода в атмосфере определяют:
· размеры частиц
· их концентрация
· эффективность механизмов очистки промышленных выбросов
· метеорологические условия (В условиях дождливого климата они могут прибывать в атмосфере до 40 ч, а в засушливом – до одной недели и более.)
Частицы углерода в зависимости от источника загрязнения могут быть покрыты оболочкой, обуславливающей их гидрофильность. Попадая в облака, эти частицы становятся ядрами конденсации. Химические реакции, протекающие на таких частицах, могут приводить к образованию нелетучих веществ из газообразных продуктов, например сульфатов из SO3. Адсорбция частиц углерода аэрозолями снижает прозрачность атмосферы, что уменьшает количество солнечных дней и влияет на климат региона. Частицы угля активно поглощают солнечное излучение, что может привести к парниковому эффекту.
Сажа поступает в атмосферу также в составе обработанных газов автотранспорта. Выхлопы дизельных двигателей, особенно тяжелых грузовиков, состоящие в основном из частиц углерода, дают примерно 1/2 всего количества углеродных частиц, попадающих в атмосферу, крупных городов.
Частицы углерода в составе аэрозолей распространяются очень далеко от индустриальных центров. При открытых разработках угля, подземной его газификации, получение угольного концентрата, сжигание угля на ТЭС в атмосферу выбрасывается, помимо частиц углерода, СО, СО2, соединения серы, хлора, брома, в составе летучих фракций золы – кадмий, Ni, Pb, Se, радионуклеотиды, а также полициклические, ароматические углеводороды.
Высокое содержание частиц углерода в атмосферных аэрозолей ведет к повышению заболеваемости населения особенно страдают верхние дыхательные пути и легкие. Профессиональная заболеваемость представлена в основном антрапозом, пылевым бронхитом; присутствие в угольной пыли частиц SiO2 ускоряет и осложняет этот процесс. Наиболее агрессивны частицы угольной пыли менее 5-7 мкм, способные глубоко проникать в легкие, и в большом количестве задерживаться в легочной ткани. Существенное значение имеет продолжительность воздействия пыли: более длительное при меньшей концентрации оказывает более выраженный эффект, чем менее длительны, но более интенсивное. Повышенное содержание в угле Cu, Fe, Ni, Pb, Zn способствует учащению заболевания антракозом.
Тематическое планирование по теме “Подгруппа углерода”.
| № | тема урока | основные образовательные цели урока | основ-ные понятия (впервые вводимые) | МПС | планируемые результаты обучения | возможные вопросы и задачи с МП уклоном | химический эксперимент |
| 1 | Положение химич. элементов подгр. углерода в ПСХЭ Д.И.М., строение их атомов. Углерод. Аллотропия углеро да. Адсорбция Хим.св-ва углерода: горение, восст-е оксидов металлов. | 1. Повторить особенности строения атомов Cи Si. 2. Изучить первоначальные представления о природе 4-х валентности C, способности его атомов связываться друг с другом, образуя простые вещества разной структуры, на этой основе учиться прогнозировать св-ва веществ. 3. Изучить на основе структуры угля явление адсорбция. 4. Расширить знания уч-ся о термохимических уравнениях, электроотрицательности, окисл.-восстановит. реакциях на примере хим. св-в углерода. | адсорбция | природоведение, физика, география | 1) знать св-ва простого вещ-ва угля 2) иметь представление об аллотропных видоизменениях С, адсорбции. 3) уметь сравнивать элементы гл. подгруппы 4 группы, знать строение их атомов, формулы высших оксидов и водородных изменений, их характеристику. 4) уметь составлять уравнения хим. реакций, характеризующих химич. св-ва угля. | 1) Из учебника физики выпишите теплоты сгорания спирта, древесного угля, природного газа. Выразите теплоты сгорания в Дж)/моль. Молярная масса спирта 36 г/моль, древесного угля около 16 г/моль. 2) Из курса физики вспомните: а) что лежит в узлах кристаллической решетки; б) св-ва полупроводников, проводников, изоляторов. 3) Какие аллотропные видоизменения вы помните из курса природоведения? 4) Назовите основные месторождения в России: угля, графита, алмаза. 5) При сгорании в кислороде 1 моль древесного угля выделяется 402 кДж теплоты. Определите: а) количество теплоты Q1, выделяющейся при сгорании 1кг С; б) достаточно ли этой Q для нагревания 1 кг воды от 15 до 25°C (удельная теплоемкость воды 4200 Дж/кг·град) | § 28-29, вопросы 3-8 стр. 91, вопросы 1-2 стр. 91. Демонстрации: 1) поглощение С растворенных веществ из газов; 2) восстановление Сu из СuО углем |
| 2 | Оксид углерода (II) и оксид углерода (IV). Химические св-ва оксида углерода (II): горение восстановление металлов. Химические св-ва окида углерода (IV), взаимодействие с водой и раствором щелочи | 1. Ознакомить уч-ся с оксидом углерода (II) как несолеобразующим оксидом, обладающим св-ми восстановителя; показать значение этого вещ-ва как топлива, отметить его ядовитость. 2. На примере окисления СО повторить условия смещения химического равновесия . 3. Привести в систему знания об оксиде углерода (IV), закрепить умения производить расчеты с применением понятий относительной плотности и молярного объема газа. | газогенератор, генераторный газ, газификация твердого топлива | природоведение, физика, биология, география | 1) уметь составлять уравнения химических реакций, характеризующих хим. св-ва СО (горение, восстановление металлов из оксидов) и СО2 (взаимодействие с водой, раствором щелочи) 2) сравнивать по химическим свойствам СО и СО2 3) разъяснить процессы, происходящие в газогенераторе 4) знать требования по охране окружающей Среды | 1) Вспомните сущность процесса фотосинтеза. 2) Расскажите об обмене газов СО2 и О2 в легких и тканях. 3) Составьте диаграмму влияния давления и температуры на растворимость СО2. 4) Расскажите об отрицательном воздействии СО на организм человека. 5) Глобальная проблема человечества “Парниковый эффект” - что это? 6) На сколько граммов масса 5,6 л СО2 больше, чем масса 5,6 л оксида углерода (II). | § 30, § 31, стр. 83-86, задание 1, стр. 92. Демонстрация: получение оксида углерода(IV) и взаимодействие его с водой и раствором щелочи. |
| 3 | Угольная кислота, общие св-ва карбонатов. Качественная реакция на карбонат - ион. Превращение карбонатов в природе. Круговород углерода в природе. | 1) ознакомить с особенностями свойств угольной кислоты и карбонатов; 2) повторить явление гидролиза. 3). Понятие о кислой соли, о превпащениях кислых солей в нормальные и обратно. 4). Научить распознавать карбонат - ион в соединениях. | карбонат-ион | биология, география | 1. знать качественную реакцию на карбонат-ион 2. уметь составлять уравнения реакций, характеризующие превращения карбонат в гидрокарбонат. | а) почему иногда пьют раствор питьевой соды? б) изобразите схему круговорота углерода в природе в). Предположите, как происходит процесс образования карбонатов в мировом океане. г). Вспомните, определение ион. д). Почему известняк в размолотом виде применяют для уменьшения кислотности почв? | § 32, 33, 34, задачи 2-5, стр.92. Лабораторный опыт № 7. |
| 4 | Решение расчетных задач на определение массы или объема продукта реакции по известной массе или объему исходного вещества содержащего примеси. | Научить решать задачи. | Примеси. | Уметь решать задачи, вычисляя массы (объем) продуктов реакций по указанным массе, объему исходных веществ, одно из которых содеожит примеси. | Уметь решать задачи, вычисляя массы (объем) продуктов реакций по указанным массе, объему исходных веществ, одно из которых содеожит примеси. | Подготовка к практической работе. | |
| 5 | Получение оксида углерода (4) и изучение его свойств. Распознавание карбонатов. | 1). Научить собирать прибор для получения газов. 2). Изучить свойства углекислого газа. 3). Провести распознавание карбонатов. | С природоведением, географией, биологией. | 1). Уметь собирать прибор для получения газа,который тяжелее воздуха. 2). Получить в нем углекислый газ, и подтвердить его наличие. 3). Распознавать карбонаты с помщью качественной реакции на карбонат - ион. | 1). Назовите основных поставщиков углекислого газа в природу. 2). Основые минералы карбонаты, их назначение и название. | Практическое занятие № 5. | |
| 6 | Краткие сведения о кремнии и его соединениях. | 1). Изучить свойства кремния, его оксида и кислоты по аналогии с углеродом и его соединениями. 2). Убедиться в том, что свойства - следствие строения веществ. | Силицид. | Природоведение. | 1). Уметь составлять уравнения химических реакций, характеризующих свойства кремния и его соединений: оксида кремния,кремниевой кислоты, силикатов. 2). Разъяснить свойства оксида кремния и кремниевой кислоты. | 1). Назовите самое распостраненное полезное ископаемое, отвечающее формуле SiO2? 2). Назовите известные вам минералы в состав которых входит кремний. | Лабораторный опыт № 8. Ознакомление с образцами природных силикатов. Параграфы 35, 36, 37, 38, страницы 92-97. |
| 7 | Строительные материалы: стекло, цемент, бетон; их получение в промышленности. | 1). Ознакомиться с основными продуктами силикатной промышленности (стеклом. керамикой); с реакциями, лежащими в основе получения стекла. 2). Узнать о местных производствах силикатной промышленности. | Природоведение. | 1). Уметь характеризовать свойства строительных материалов. 2). Перспективы развития силикатной промышленности. | 1). Вспомнить из курса природоведения, сырье для керамических изделий: фарфора, фаянса, (охарактеризуйте свойства сырья). 2). Что служит сырьем для получения стекла? 3). Охарактеризуйте свойства стекла. | Параграф 39, страницы 97-100, з.1-2, стр.101. Демонстрации: виды стекла, затвердевание цемента при смешении с водой. Лабораторный опыт № 9. |
Приложение 3
Межпредметный семинар “Биогенные элементы в
периодической системе Д.И. Менделеева”.
Наиболее эффективным средством обучения является семинар. Межпредметный семинар – одна из эффективных форм организации учебной работы, которая способствует обобщению знаний учащихся из разных предметов. Такой семинар позволит в целом комплексе решать задачи образования, развития и воспитания школьников, то есть ТДЦ.
Межпредметный семинар “Биогенные элементы в ПСХЭ“ – проводится как завершающий и обобщающий тему “ПЗ и ПС Д.И. Менделеева“, “Строение вещества”. Данный семинар проводится с учетом особенностей строения атомов биогенных элементов и их роли в живых организмах и проводится на факультативных занятиях по химии при изучении строения вещества.
Основная цель семинара установить закономерные связи между строением атома, химическими свойствами и биогенными функциями элементов.
За две недели до семинара предлагаем учащимся вопросы для подготовки, называем параграфы из учебников химии и биологии, которые необходимо повторить, рекомендуем дополнительную литературу. Учитель биологии проводит семинары-консультации, на которых рассматриваются более сложные вопросы биологического характера. В процессе совместной работы учителей и коллективной деятельности учащихся, знания по химии и биологии о биогенных элементах приводились в систему.
Учителя-методисты отмечают, что эффективность межпредметных семинаров значительно повышается, если использовать проблемный подход в обучении, коллективную работу в классе и индивидуальный подход к учащимся. Методика семинара в отличии от конференций, в центре которых стоят доклады учащихся, предполагает, прежде всего, совместное обсуждение общей проблемы, темы семинара, а также активность всех учеников в достижении основной учебной цели. Поэтому используются многообразные средства активизации познавательной деятельности учащихся на основе проблемного подхода. Занятия семинара строились таким образом, что учащиеся должны были решить ряд последовательно предложенных проблемных (межпредметных) вопросов: почему именно элемент углерод, а не кремний является основным элементом жизни? Как объяснить, почему с повышением в крови концентрации диоксида углерода повышается и концентрация ионов H+? Какова их физиологическая роль? Почему жизнь зародилась в воде и как это произошло? Каковы физико-химические свойства воды и как объяснить ее биологические функции? Почему живые организмы дышат кислородом, хотя в атмосфере значительно больше азота? Содержание данных вопросов предполагает одновременное использование и обобщение знаний из курсов химии и биологии.
В процессе коллективной беседы учащиеся высказывают предположения, ищут их обоснование и приход к решению поставленных проблем.
На межпредметных семинарах нередко заслушиваются доклады учащихся. Тематику докладов целесообразно посвящать вопросам, которые еще не изучались в курсах химии и биологии и требуют самостоятельного освоения учащимися новых разделов учебных программ (например: значение углерода для организма человека); не входят в школьные программы и требуют самостоятельного изучения из дополнительной литературы (например: “Использование элементов-органогенов в медицине”).
Распределение докладов проводилось с учетом познавательных интересов учащихся и их возможностей. В процессе семинара сообщения учащихся прерывались беседой и обобщениями учителя. Доклады служат опорой в постановке и решении проблемных межпредметных вопросов.
Рассмотрим на примере, как происходит на семинаре решение ряда предложенных (межпредметных) проблемных вопросов. Во вводной части семинара в процессе беседы учащиеся повторяют химический состав живых организмов, выводится понятие о биогенных элементах как элементах, из которых строятся органические и неорганические вещества живых организмов, обеспечивающие их основные функции. Рассматриваются и записываются в тетрадь сведения о положении этих элементов в ПС.
Отмечается, что углерод, водород, кислород, азот – это широко распространенные элементы. Они находятся в двух первых периодах таблицы Д.И. Менделеева, имеют небольшой порядковый номер и обладают высокой способностью к образованию устойчивых ковалентных полярных связей в молекулах белков, жиров, углеводов.
Учитель, подчеркивает, что основной скелет органических соединений, входящих в состав живых организмов, образуется из атомов углерода. Перед учащимися ставится проблемный вопрос: почему именно элемент углерод, а не кремний является основным элементом жизни, хотя эти элементы в таблице находятся в одной группе и имеют сходное строение атом?
Учащиеся по заранее подготовленной таблице “Углерод и кремний“ сравнивают строение атомов, химические свойства элементов. Учитель подчеркивает, что углерод имеет строение атома, промежуточное между металлами и неметаллами, поэтому он легко вступает в реакцию со многими элементами, в том числе и с водородом, кислородом, азотом, образуя разнообразные органические вещества. Главной особенностью атомов углерода является их способность к образованию простых элементных связей друг с другом. Это ведет к созданию длинных углеродных цепей (-C-C-C-), прямых, разветвленных, в виде колец, спиралей (демонстрируются таблицы сложных органических веществ), что приводит к огромному многообразию соединений. В большинстве источников – 5-6 млн органических веществ, по сведениям иностранных журналов – 12 млн. Вследствие большой металличности, меньшей электроотрицательности кремния по сравнению с углеродом атомы кремния не образуют длинных цепей.
Сравнение связей -C-C- и -Si-Si- показывает, что расстояние между атомами углерода значительно меньше, чем между атомами кремния. Это обеспечивает устойчивость углеродных связей и наличие в них большего запаса энергии, что важно для биоэнергетического обмена, для жизнедеятельности организма. Запасы энергии в органических соединениях увеличиваются благодаря способности атомов углерода создавать устойчивые при обычных условиях длинные цепи.
Совместно с учащимися делается вывод о необходимости для жизни организмов макромолекул органических веществ с большим числом химических связей, с большим запасом внутренней энергии. Такие макромолекулы образует углерод. Учитель обобщает результаты коллективного обсуждения вопроса: мир углерода – это живая природа, мир кремния – неживая природа.
Рассмотрим это на примере фотосинтеза.
Мы утверждаем, что мир углерода – это живая природа. Наиболее яркое и знакомое из курса биологии 6-7 класса учащимся такое явление как фотосинтез. Изобразив схему фотосинтеза, нетрудными вопросами вспоминаем: 1) Из каких веществ образуется сахар в зеленых листьях растений? 2) Какой опыт показывает, что наземные растения на свету поглощают CO2 и выделяют кислород? (рис. 1)
Используя знания физики-9 о втором законе термодинамики повторяем, что любые виды энергии в конечном счете превращаются в тепловую форму и рассеиваются. Реакция же фотосинтеза сопровождается накоплением энергии в органическом веществе за счет преобразования энергии фотонов в энергию химических связей.
Энергетический смысл фотосинтеза заключается в расщеплении светом некоторого донора водорода DH2 и переносе водорода на акцептор A с выделением свободного окислителя D:
DH2 + A ®свет AH2 + D
В качестве акцептора выступает углекислый газ, а роль донора водорода могут играть некоторые органические соединения, сероводород и вода.
Наибольшее распространение получил процесс с участием воды, идущий в зеленых растениях:
6 CO2 + 6 H2O + 673 ккал хлорофилл® (СH2O)6 + 6 O 2
При этом источником кислорода является вода, а не углекислый газ. В некоторых случаях синтез органического вещества может осуществляться некоторыми бактериями без выделения кислорода. Источником углерода для них служит углекислый газ, а водород берется из сероводорода (или какого-либо органического соединения):
6 CO2 + 12 H2S ® (CH2O)6 + 12 S + 6 H2O
Фотосинтез – это сложная многостадийная реакция:
1 стадия – световая – молекулы хлорофилла возбуждаются фотонами света с длиной волны 670-680 нм и ускоряют фотолиз воды, то есть разложение воды на кислород, который поступает в атмосферу, протоны и электроны:
H2O ® 2 H+ + 2 e- + 1/2 O2
Энергия, образующихся электронов используется в последующих реакциях с участием пигментных фотосистем растений.
2 стадия – темновая, так как протекает без участия солнечного света, во время которой происходит поглощение CO2 и синтез на его основе органических веществ – сахаров, глицерина и аминокислот.
Этот процесс, возникнув на Земле, стал мощным геологическим фактором (весь кислород атмосферы имеет фотосинтетическое происхождение).
Ежегодно запасаемое растениями в продуктах фотосинтеза общее количество энергии составляет примерно 1024 ккал. Хотя коэффициент полезного действия фотосинтеза невелик (КПД из курса физики).
Известно, что хлорофилл поглощает энергию, находящуюся в голубой (400-500 нм) и красной (610-690 нм) областях спектра.
Поэтому в реальных условиях лишь 10% энергии из видимой области спектра, получаемой растениями, действительно обращается в биомассу. Если сопоставить количество энергии, преобразованной в органические вещества растениями, с большим количеством солнечной энергии, достигающей поверхности Земли, то коэффициент полезного действия фотосинтеза оказывается крайне низким (менее 1%). Только в редких случаях, касающихся культурных растений с высокой продуктивностью, можно повысить КПД до 3% .
Роль образующей глюкозы велика, так как в дальнейшем процессе фотосинтеза образуется крахмал – является запасным питательным материалом для растений и содержится в них в виде крахмальных зерен.
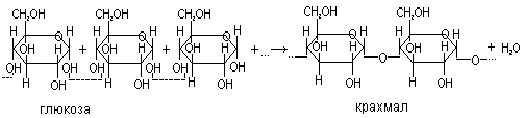
Существенное отличие химии кремния от химии углерода обусловлено прежде всего относительно малой прочностью связей Si-Si. Поэтому цепочки из атомов кремния разрываются гораздо легче , чем углеродные, особенно если имеется возможность образования наиболее характерной для кремния связи с кислородом. Прямым следствием является резкое уменьшение числа устойчивых кремниевых соединений по сравнению с углеродными. Так, различных минералов известно около 3 тыс., а отдельных видов живых организмов описано более миллиона.
Сравнение диоксида углерода и диоксида кремния показывает активное участие соединений углерода в круговороте веществ в природе, в реакциях обмена веществ в организме (например, газообмен в легких и тканях).
Обмен газов в легких
Содержание газов во вдыхаемом и выдыхаемом воздухе неодинаково. Во вдыхаемом воздухе содержится почти 21% кислорода, около 79% азота, примерно 0,035% , небольшое количество водяных паров и инертных газов.
Процентный состав выдыхаемого воздуха иной. Кислорода в ней остается около 16%, количество углекислого газа возрастает до 4%. Увеличивается и содержание водяных паров. Азот и инертные газы в выдыхаемом воздухе остаются в том же количестве, что и во вдыхаемом. Разное содержание кислорода и углекислого газа во вдыхаемом и выдыхаемом воздухе объясняется обменом газов в легочных пузырьках. Концентрация углекислого газа в венозных капиллярах легочных пузырьков гораздо выше, чем в воздухе, заполняющем легочные пузырьки. (рис. 2)
Углекислый газ из венозной крови поступает в легочные пузырьки и во время выдоха выводится из организма. кислород из легочных пузырьков проникает в кровь и вступает в химическое соединение с гемоглобином. Кровь из венозной превращается в артериальную.
По легочным венам артериальная кровь поступает в левое предсердие, затем в левый желудочек и в большой круг кровообращения.
Обмен газов в тканях
Из капилляров большого круга кровообращения кислород поступает в ткани. (рис.3). В артериальной крови кислорода больше, чем в клетках, поэтому он легко диффундирует в них и используется в окислительных процессах. Углекислый газ из клеток поступает в кровь. Таким образом, в тканях органов происходит превращение артериальной крови в венозную.
Венозная кровь по венам большого круга кровообращения поступает в правое предсердие, затем в правый желудочек сердца, а оттуда в легкие.
Учитель знакомит учащихся с тем фактором, что при повышении в крови концентрации диоксида углерода повышается и концентрация ионов водорода. Ставиться новый проблемный вопрос: почему с повышением в крови концентрации диоксида углерода повышается и концентрация ионов водорода? Как это объяснить?
Учащиеся записывают уравнение реакции:
CO2 + H2O ® H2CO3 ® H+ + HCO3-
Далее повторяется строение атома водорода, особенности его положения в ПС, образование ионов водорода:
H - 1 e- ® H+; H + 1 e- ® H-
Отмечается, что при отдаче электрона от атома водорода остается один “голый протон”, радиус которого почти в 2000 раз меньше радиуса атома водорода. Физиологическое значение положительного иона водорода, рассказывается в докладе ученика, который готовил его, консультируясь с учителем биологии.
Аналогично, путем бесед, докладов и самостоятельной работы учащихся с обобщающими таблицами и периодической системой элементов, проходит обсуждение всех других вопросов семинара.
В заключение учащиеся подводят к мировоззренческому выводу о наличии в природе связей “строение – свойства – функции”: биологические (физиологические) функции всех биогенных элементов определяются их физико-химическими свойствами, которые, в свою очередь, зависят от особенностей строения их атомов, их места в ПСХЭ Д.И. Менделеева. В этом проявляется материальное единство живой и неживой природы.
В целях создания межпредметных связей учащимся предлагается дома заполнить таблицу “Знания по биологии, химии, физике, которые привлекались на семинаре”.
| предмет | знания (понятия, законы, факты) |
Об эффективности межпредметного семинара можно судить по количеству высоких оценок, по росту интереса к познанию взаимосвязей наук химии, биологии. Межпредметный семинар имеет большое воспитательное и образовательное значение.
Вопросы межпредметного семинара.
| вопросы семинара | вопросы для подготовки | литература |
| 1. Углерод – основной элемент жизни. Сравнение элементов углерода и кремния. | 1. Понятие об элементах – органогенах. 2. Строение атомов и сравнительная характеристика элементов углерода и кремния. 3. Способность атома углерода к образованию химических связей и углеродных цепей. | Химический состав клетки и ее жизненные свойства. Учебник “Человек”, § 3. Характеристика элемента по его положению в ПТ и строению атома. Учебник “Неорганическая химия”, 8 кл. |
| 2. Водород, его роль в образовании органических веществ. | 1. Особенности строения атома водорода. Отсутствие аналогов. 2. Образование связи водорода с углеродом. 3. Ион водорода и его значение в физиологических процессах. | Состояние электронных оболочек атомов. Состояние электронов в атомах. Ионная связь. Ковалентная связь. Учебник “Неорганическая химия”. |
| 3. Вода. Ее значение в жизни организмов. | 1. Строение молекулы воды. 2. Физические свойства воды. Вода как растворитель. 3. Значение воды в жизни организмов. | Вода как растворитель. Растворимость. Значение растворов в природе. Ковалентная связь. Учебник “Неорганическая химия”. 8-9 кл. Водный обмен. Учебник “Человек”, 9 кл. |
| 4. Элементы кислород и азот. Их сходство с углеродом и отличие. Дыхание и фотосинтез. Круговорот углерода в природе. | 1. Строение атомов кислорода и азота. Полярность связи. 2. Строение молекул кислорода и азота. Энергия химических связей. 3. Дыхание и фотосинтез как ox-red процессы. 4. Обмен веществ и энергии. | Ковалентная связь. ox-red реакции. Учебник “Неорганическая химия”. 9 кл. “Поглощение листьями на свету углекислого газа и выделение кислорода. Поглощение азота из воздуха”. Учебник “Ботаника”, 6-7 кл. Значение дыхания. Газообмен в легких и тканях. Ассимиляция и диссимиляция. Учебник “Человек”. |
| 5. Элементы фосфор, азот, сера. Их участие в образовании органических веществ и в энергетическом обмене. | 1. Многообразие аминокислот и белков. 2. Значение фосфора, азота и серы для живого организма. | Многообразие белков и их образование в клетках. Учебник “Человек”. |
| 6. Использование элементов – органогенов в медицине. | 1. Физиологический раствор. 2. Соединения кальция, железа в медицине. 3. Применение кислорода в медицине. | Сероводород. Учебник “Неорганическая химия”, 9 кл. Популярная медицинская энциклопедия. |
Круговорот углерода
Круговорот углерода (CO2) такой же важный цикл для биосферы, как и круговороты H2O и O2. В круговороте углерода атмосферный фонд очень невелик по сравнению с запасами углерода в океанах, в ископаемом топливе. Полагают, что до наступления индустриальной эры потоки углерода между атмосферой, материками и океаном были сбалансированы, но в последние 100 лет содержание углекислого газа в атмосфере постепенно растет в результате новых антропогенных поступлений. Считают сжигание горючих ископаемых, интенсивное развитие с/х и уничтожение лесов.
Перед учащимися может возникнуть проблема: каким образом с/х связано с увеличением содержания углекислого газа в атмосфере, если известно, что зеленые растения в процессе жизнедеятельности фиксируют этот газ?
В ходе обсуждения, привлекая знания из биологии, учащиеся могут прийти к выводу, что фиксация углекислого газа с/х культурами (многие из которых активны лишь часть года) не компенсирует количество углекислого газа, высвобождающего из почвы, особенно при ее частой вспашке.
Вторая причина может возникнуть при обсуждении причин и последствий увеличения углекислого газа в атмосфере в результате сжигания горючих ископаемых, поскольку известно, что фотосинтезирующий “зеленый пояс” Земли и карбонатная система моря поддерживают постоянный уровень содержания углекислого газа в атмосфере (образование углекислого газа компенсируется потреблением его растениями, а также превращением в карбонаты). Каковы же причины и последствия нарушения этого равновесия?
Можно указать четыре причины:
1. Стремительное возрастание потребления горючих ископаемых.
2. Уменьшение поглотительной способности “зеленого пояса”.
3. Загрязнение поверхности Мирового океана.
4. Загрязнение атмосферы.
Что же касается последствий, то это парниковый эффект. Если в атмосфере установится равновесие между углекислым газом, не пропускающим поступающие на Землю лучи, то любое значительное изменение в тепловом балансе повлияет на климат планеты.
В круговорот углерода оба вещества вовлекаются в виде углекислого газа, до которого они окисляются.
Схема круговорота углерода в главе 2.
Приложение 4
Викторина “Знаете ли вы химию и географию?”
Данный турнир лучше проводить в виде телеигры “Счастливый случай” между параллельными классами для 9х.
Игра состоит из трех туров:
I тур. Учитель поочередно задает вопросы командам (номер вопроса по вытянутому жетону). На обдумывание вопроса дается 15 секунд. Вопрос, на который не дан ответ, задается болельщикам.
II тур. “Ты – мне, я – тебе”. Каждый из команды задает противнику вопрос. Отвечающий не может советоваться. Время – 15 секунд.
III тур. “Дальше. Дальше. Дальше.” За 2 минуты команда должна ответить на как можно больше вопросов, то есть конкурс на быстроту, точность. За каждый правильный ответ – 1 очко. Побеждает тот, кто набирает больше очков.
Вопросы:
1. Какие химические элементы названы в честь частей света? 2. Перечислите элементы, названные в честь стран. 3. Названия каких химических элементов произошли от названий столиц европейских государств? 4. Какой химический элемент назван по имени острова? 5. Название какого элемента произошло от названия полуострова? 6. Какие химические элементы названы в честь: а) города в США, б) штата США. 7. Какой химический элемент получил свое имя по названию города в Древней Греции? 8. Название какой шведской деревушки дало имя четырем химическим элементам? Назовите эти элементы. 9. Какой химический элемент назван в честь провинции в Германии? 10. Верно ли утверждение, что индий назван в честь Индии? 11. Какой элемент второй группы получил свое имя по названию деревни в Шотландии? 12. Почему тулий (№ 69) получил такое название? 13. В названия каких химических элементов входят названия рек? 14. Добавьте к названию элемента две буквы в конце слова и назовите реку, берущую свое начало в Монголии и впадающую в Байкал. 15. Заменив одну букву в названии химического элемента, получите название реки во Франции, заменив же другую – название реки, на берегах которой стоит Пенза. 16. Поменяйте окончание “-ий” в названии элемента на “-а”, получите старое название города на Волге. 17. Отбросьте первую букву в названии химического элемента восьмой группы и получите название притока Днестра. 18. Поменяйте букву в названии благородного газа и получите имя реки и города на ней в Чечено-Ингушетии. 19. Замените первую букву в названии химического элемента и получите название пролива между Европой и Азией. 20. Замените первую букву в названии элемента семейства актиноидов и получите название государства в Азии. 21. Замените две буквы в середине названия химического элемента и получите название мыса на юге Сахалина. 22. В названии какого химического элемента содержится название озера в Турции? 23. Назовите химические элементы, которые носят одинаковые названия с городами в СНГ. 24. Какие населенные пункты СНГ имеют названия, связанные с названием химических элементов? 25. Замените последнюю букву в названии элемента на две одинаковые, получите название столицы республики СНГ. 26. Переставьте местами две первые буквы в названии химического элемента, получите город во Франции, расположенном на берегу Сены. 27. Переставьте местами буквы в названии элемента подгруппы железа и получите название города в Куйбышевской области. 28. Прибавьте к названию химического элемента название музыкальной ноты, получите название города во Франции. 29. Замените окончание “-ий” в названии элемента на “а”, получите название города-героя. 30. В названии каких двух химических элементов входит название крупного города в Колумбии? 31. Отбросьте последнюю букву в названии элемента второй группы, получите название итальянского порта на Адриатическом море. 32. Замените последнюю букву в названии элемента и получите название портового города Ростовской области. 33. Название какого острова в Беринговом море связано с названием химического элемента? 34. Отбросив первую букву в названии радиоактивного элемента, получите название острова в Малой Курильской гряде. 35. Добавив к названию элемента шестой группы одну букву, получите название моря и одноименного острова в составе Молуккских островов в Индонезии. 36. Заменив последнюю букву в названии химического элемента, получите название горной системы, являющейся границей между Европой и Азией. 37. Где находятся: а) Золотой Рог, б) Золотые ворота, в) Золотые пески, г) Серебряный берег, д) Железные ворота?
Ответы:
1. Европий, америций, 2. Германий, франций, полоний (Польша), рутений (Россия), галий (Франция). 3. Гольмий (от старого названия Стокгольма), лютеций (от старого названия Парижа), гафний (старое название Копенгагена). 4. Медь (остров Кипр (Сиргит)), 5. Скандий (Скандинавский п-ов). 6. а) Берклий (Беркли); б) Калифорний (Калифорния). 7. Магний (Магнисия). 8. Иттерби, иттрий, тербий, эрбий, иттербий. 9. Гений (Гейнская провинция). 10. Индий – от синей (индиговой) линии в спектре этого элемента. 11. Стронций (Стронишан). 12. Тулий (от греч. слова “туле” – античные географы называли самую северную часть Земли – северная часть Скандинавского полуострова). 13. Радон – Дон; нильсборий – Нил; индий – Инд; полоний – По. 14. Селен – Селенга. 15. Сера – Сена – Сура. 16. Самарий – Самара. 17. Никель – Икель. 18. Аргон –Аргун. 19. Фосфор – Босфор. 20. Уран – Иран. 21. Криптон – Крилеон. 22. Ванадий – Ван. 23. Никель (Мурманская обл.), Марганец (Днепропетровская обл.), Бор (Нижне-Новгородская обл.) 24. Железноводск (Ставропольский край); Железногорк (Курская обл.), Железногорск-Илимский (Иркутская обл.); Железное (Северо-Казахстанская обл.); Золотаревка (Пензенская обл.); Золотая гора (Амурская обл.); Золотники (Тернопольская обл.); Золотое (Луганская обл.); Медногорск (Оренбургская обл.); Медное (Калининская или Тверская обл.); Сереброполь (Алтайский край); Хромтау (Актюбинская обл.); Оловянная (Читинская обл.); Никельтау (Актюбинская обл.); 25. Таллий – Таллинн; 26. Уран – Руан; 27. Никель – Кинель; 28. Бор – Бордо; 29. Тулий –Тула; 30. Калий, калифорний – кали; 31. Барий – Бари; 32. Азот – Азов; 33. Медный; 34. Кюрий – Юрий; 35. Сера – Серам; 36. Уран – Урал; 37. а) бухта в проливе Босфор, залив Петра Великого у Владивостока; б) пролив, соединяющий Сан-Франциско с Тихим океаном; в) курорт Болгарии на Черном море; г) побережье Бискайского залива во Франции; д) теснина на реке Дунай на границе Югославии и Румынии.
Приложение 5
Межпредметная конференция по экологии
Данная конференция в традиционной форме по плану:
1. Вступительное слово ведущего.
2. Доклады: “Парниковый эффект”, “Разрушение слоя озона атмосферы”, “Кислотные осадки”, “Фотохимический смог”.
3. Обсуждение докладов.
4. Подведение итогов конференции.
Ведущий: Сегодня одни из самых тревожных слов – “экологическая катастрофа”. Ежедневно мы слышим предостережения: “Образумтесь, люди!”, “Будущее земли в опасности!”, “На нас – ответственность перед настоящим и будущим!”. Но все они так и останутся лишь призывами, благими намерениями, если мы не осознаем главного: человечество стоит на пороге экологической катастрофы. Здесь нет преувеличений. Эта тревога так серьезна, что настоящей проблемой по охране окружающей среды занимаются интенсивно не только экологи, но и химики, физики, биологи, метеорологи. Задача сохранения Земли, пригодной для обитания человека и всех других организмов, не может быть решена без сотрудничества всех стран и всех народов Земли, а также без повышения экологической культуры каждого человека.
В последние годы жизни человека угрожают “парниковый эффект”, озоновая “дыра”, кислотные дожди и фотохимический смог. Наша конференция посвящена раскрытию сущности этих явлений.
1-ый ученик. “Парниковый эффект”.
Некоторые газы, составляющие незначительную долю атмосферы, подобно стеклянной крыше парника хорошо пропускают солнечную радиацию, но задерживают уходящее длинноволновое тепловое излучение Земли. К ним относятся диоксид углерода, метан, оксид азота, хлорфторуглероды. Поскольку в этом отношении они подобны стеклянной крыше парника, их часто называют парниковыми газами.
Несмотря на то, что суммарное содержание парниковых газов в атмосфере очень мало, увеличение концентрации хотя бы одного из них приводит к тому, что в атмосфере начинает задерживаться больше тепла, в результате чего повышается средняя температура атмосферы Земли и ее поверхности. Повышение температуры внутренних слоев атмосферы и поверхности Земли, обусловленное накоплением в атмосфере парниковых газов, называется парниковым эффектом. Последние данные показывают, что поступление и накопление в атмосфере диоксида углерода и метана, обусловленное хозяйственной деятельностью человека приводит к потеплению климата Земли. В результате парникового эффекта год за годом на нашей планете становиться теплее, климатические зоны смешиваются, ледники тают, уровень моря увеличивается.
Для замедления начавшегося потепления климата необходимо, прежде всего, остановить избыточное поступление парниковых газов в атмосферу.
2-ой ученик. “Разрушение слоя озона атмосферы. Озоновая “дыра”.”
Стратосферный озон O3 образуется, когда молекула кислорода, поглощая коротковолновую радиацию Солнца, распадается на два атома кислорода, каждый из этих атомов соединяется с другой молекулой кислорода, образуя молекулу озона.
Озон легко поглощает ультрафиолет и распадается на первоначальные компоненты O2 и O. Освободившийся атом кислорода вновь соединяется с молекулой кислорода и образует молекулу озона. При низменных условиях скорость образования озона равна скорости его распада.
Содержание озона в атмосфере не достигает и одной миллионной доли от содержания остальных газов, однако именно озон поглощает большую часть солнечной ультрафиолетовой радиации, не давая ей достигнуть земной поверхности. Если снижение земной концентрации озона вблизи поверхности Земли оказало бы оздоравливающее влияние на загрязненные местности, то снижение концентрации стратосферного озона опасно, поскольку следующее за этим увеличение интенсивности ультрафиолетового излучения, достигающего поверхности, влечет за собой много неприятных последствий. Оно повышает частоту раковых заболеваний кожи и катаракты, повреждает сельскохозяйственные культуры и разрушает фитопланктон – микроскопические растения, являющиеся начальным звеном пищевой цепи в океане.
Главными виновниками снижения концентрации озона в атмосфере являются хлорфторуглероды, в особенности CFCl3 и CF2Cl2. Атомы хлора, входящие в состав хлорфторуглеродов, выбрасываемых в атмосферу, разрушают слой озона.
Озонная “дыра” – это область резко пониженной концентрации озона в стратосфере. Она в более очевидной форме наблюдается над Антарктикой, где в последнее десятилетие весеннее содержание озона снизилось на 50%. В Антарктике и, в какой-то степени, Арктике низкие температуры способствуют ускорению процессов, разрушающих слой озона.
Выводы о состоянии слоя озона в целом по земному шару пока еще делать рано, но уже сейчас можно сказать о том, что за последние 20 лет зимой и ранней весной в средних и высоких широтах Северного полушария потери озона составляют от 3 до 10%, причем большие потери отмечались в высоких широтах.
3-ий ученик “Кислотные дожди”.
“Кислотные дожди” (к которым относятся также кислотные снега, туман и роса) являются в основном побочным продуктом химической реакции в атмосфере. Их может быть несколько, в которых участвуют оксиды азота и диоксид серы. В ходе различных реакций, таких, как соединения с водой, эти газы могут превращаться соответственно в азотную и серную кислоту, которые хорошо растворимы в воде. Капельки такого раствора, падающие на Землю, и представляют собой “кислотный” дождь.
Источником оксидов серы и азота являются теплоэлектростанции, нефтеперерабатывающие и металлургические заводы, транспорт и т.д.
“Кислотные” дожди наносят колоссальный ущерб здоровью людей и материальным средствам. Под их влиянием гибнут озера вместе со своими обитателями, корродирует почва, массивы лесов превращаются в мертвые леса. “Кислотные” дожди разъедают не только легкие человека, но и камни, металлы, краски.
4-ый ученик “Фотохимический смог”.
Неприятным явлением в современных городах и их окрестностях является фотохимический смог. Этим термином обозначают смесь газов, образующуюся в нижних слоях атмосферы, где солнечная радиация воздействует на некоторые газы (особенно на оксиды азота и углеводороды, содержащиеся в выхлопах автомобилей), в результате образуются газы с высокой реакционной способностью, очень вредные для живых организмов.
Главным продуктом таких фотохимических реакций является озон, который в основном и воздействует на глаза и легкие и наносит вред деревьям и сельскохозяйственным культурам. Именно “густоту” смога обычно выражают через концентрацию озона на уровне земной поверхности.
При проведении такой конференции приглашаются работники комитета по охране природы, данные ученики-докладчики являются своего рода “специалистами-экологами”. После выступления задаются вопросы.
По ходу конференции ученики заносят в тетрадь краткую характеристику явления и пути предотвращения катастрофы.
Свою работу завершают составлением небольшой схемы о межпредметном взаимодействии.
Задание на дом – подписать влияние над стрелками, т.е. домашнее задание учащихся будет представлено следующей схемой:
![]()
![]() Человек
Человек
Биология
![]()
![]() Ботаника Химия География
Ботаника Химия География

![]()
Физика
Приложение 6
“Приготовление растворов солей с определенной
массовой долей w растворенного вещества”
Предлагаем им задачу следующего содержания: “Юные цветоводы попросили юных химиков приготовить каждому из них по 80 г раствора аммиачной селитры с w ее в растворе 0,15. Назовите и рассчитайте действия юных химиков. Раствор с какой w аммиачной селитры получат цветы, если до и после подкормки почву промывают по 100 мл воды.”
Прежде чем разрешить учащимся приступить к выполнению данной задачи, повторяем с ними основные формулы:
1. mр-ра = mраст.в-ва + mраст-ля
2. w = (mраст.в-ва/mр-ра)·100%
mраст.в-ва = mр-ра·w; mр-ра = mраст.в-ва/w
Записываем краткое условие задачи.
Дано:
m1(р-ра) = 80 г
w1 = 0,15
m2(H2O) = 200 г
Найти: w2
Решение.
1. Рассчитаем массу аммиачной селитры
mам.с. = 80 г·0,15 = 12 г
2. Рассчитаем массу воды для растворения 12 г минеральных удобрений
mводы = 80 - 12 = 68 г
3. Берут цилиндр, отмеряют 68 мл воды и всыпают 12 г аммиачной селитры.
4. Рассчитывают, каков объем получаемый растениями до, во время и после подкормки и поливки. Отсюда следует, что
m2(р-ра) = 200 + 80 = 280 г
5. Рассчитывают w2
w2 = 12/280 = 0,04; w = 4%
Ответ: цветы получили раствор аммиачной селитры с w = 0,04.
Можно предложить учащимся составить обратную задачу и решить ее самостоятельно.
Приложение 7
Фрагмент урока по теме “Ионная связь”
Цели: образовательные: дать понятие ионной связи, объяснить механизм образования данной связи, провести сравнение с ковалентной связью;
развивающие: закрепить понятие о ковалентной связи, полярной и неполярной; об электроотрицательности, развитие общеучебных умений анализировать, выделять главное, применять знания из курса географии;
воспитывающие: формировать у учащихся убежденность в познании мира веществ.
Фрагмент объяснения механизма образования ионной связи:
| СУМ | УПДУ |
| +1; -1 - степень окисления Na0 + Cl0 ® Na+ Cl- В данном случае общей электронной пары не образуется потому, что электрон от атома Na с внешнего энергетического уровня переходит на внешний энергетический уровень атома Cl, т.к. Cl более электроотрицателен. Спаривание электронов происходит в атоме элемента Cl. Соединения, которые при этом образуются, называются ионными соединениями. Ионная связь образуется между металлами и галогенами. NaCl - хлорид натрия | Что такое степень окисления? Ответ: Что такое ион? (из курса физики) Запись примера в тетрадь. Почему? Что такое электроотрицательность? Ответ: Как называется ионное соединение NaCl в быту и где в Арх. обл. находится самое старое месторождение этого полезного ископаемого? Ответ: поваренная соль, г. Сольвычегодск. |
На доске рисуем схемы взаимодействия щелочных металлов с галогенами. В результате химического взаимодействия атомы галогенов притягивают валентные электроны атомов металлов и образуются ионы. Далее задаем учащимся такие вопросы: Как будут вести себя одноименно или разноименно заряженные ионы, если они окажутся рядом? Какие силы удерживают ионы в ионных соединениях?
Заключение урока - обобщение знаний, формулировка полного определения ионной связи.
Приложение 8
Тему “Углерод, подгруппа углерода.” можно завершить зачетным уроком по составлению обобщающей схемы, которая пригодится для сдачи экзамена по химии и приведет в систему знания учащихся, дополняя в старших классах.
Углерод C, IV группа, главная подгруппа

Значит углерод может обладать и окислительными и восстановительными свойствами.
В природе: органические вещества, CO2; CaCO3 – мрамор, мел; MgCO3 – магнезит; FeCO3 – железный шпат.
Физические свойства: 4 аллотропные модификации.
| алмаз | графит | карбин | линейный ацетиленовый углерод |
| sp3-гибридизация, тетраэдрические s-связи, прочные ковалентные, поэтому очень тверд | sp2-гибридизация, слоистая структура, большое расстояние и непрочные связи между слоями, поэтому мягкий | sp-гибридизация, линейный полимер, твердое вещество
| разновидность сажи |
Новая форма линейного углерода
В дополнение к известным формам структуры углерода – палкам, тубам и сферам – группой химиков во главе с Ричардом Дж. Лэгоу из Техасского университета (США) открыта новая аллотропная форма этого элемента – линейный ацетиленовый углерод. Он является разновидностью сажи и представляет собой тончайшие нити в виде паутины янтарного цвета. По этой причине его назвали “волосы ангела”.
Каждая нить новой аллотропной формы углерода содержит от 300 до 500 углеродных атомов, связанных друг с другом чередующимися одинарными и тройными связями. Исследователям удалось осуществить синтез новой формы с помощью лазера путем взрывообразного испарения графитового стержня в заполненном аргоном стеклянном реакторе. Образовавшиеся на стенках реактора нити могут быть легко собраны.
Полученные углеродные нити весьма реакционно способны и проводят электрический ток. Химики полагают, что многие из этих нитей закручены в спирали, которые могут превращаться в фуллерены или сажу. Свойства новой аллотропной формы углерода позволяют надеяться на ее применение в микроэлектронике, синтезе алмазов, а также в качестве топлива для реактивных двигателей и топливных элементов.
Сокр. перев. с англ.
Г.Т. Хачатуровой
(Science News, 1995,
v.147, № 5, p.77)
Получение углерода
![]()
![]() Сухая
перегонка
Сухая
перегонка
древесины каменного угля
древесный уголь кокс
активированный уголь
Самый чистый углерод – сажа
CH4 ® C + 2H2
Химические свойства
- малоактивен, на холоде – только с F2 ® CF4
Восстановитель ¬ Слабо выражены ® Окислительные
1) O2 + C ® CO2 ниже 500°C ь
э загорается
CO2 + C ® CO выше 900°Cю
2) H2O + C ® CO + H2 выше 1200°C
2H2O + C ® CO2 + CO2 + H2 выше 1000°С
3) CuO + C ® Cu + CO при t
Cu+2+2e® Cu0 – окислитель, восстанавливается
C0 -2e® C+2 – восстановитель, окисляется
4) HNO3 + 3C ® 3 CO2 + 4 NO + 2 H2O
с H2SO4 разбавленная
Cu+2+2e® Cu0 – окислитель, восстанавливается
C0 -2e® C+2 – восстановитель, окисляется
![]() C
C
![]() 1)
Ca + 2C ®
Ca ъъъ карбид кальция
1)
Ca + 2C ®
Ca ъъъ карбид кальция
C
C + Si ® CSi карборунд
другой способ:
CaO + C ® CaC2 + CO
2) 2H2 + C ® C-4H+4
Рассмотрим с точки зрения ox-red:
4H0 -4e® 4H+ – восстановитель, окисляется
C0 +4e® C-4 – окислитель, восстанавливается
Углерод может быть и окислителем и восстановителем.
| 4+ | 2+ | n- |
| Оксид углерода (IV) CO2 Без цвета и запаха, растворим в воде; -76°C – сухой лед; Получение: в промышленности обжиг известняка CaCO3 ® CaO + CO2 в лаборатории – вытеснение сильной кислотой CaCO3 + 2HCl ® CaCl2+ + CO2 + H2O Окислительные свойства выражены слабо: только при высоких температурах, с металлами, сродство к кислороду, которых больше, чем у C (Mg, K) 2Mg + CO2 ® 2MgO + C Кислотный оксид при растворении в воде, образуется небольшое количество угольной кислоты
1. 2NaOH + CO2 ® ® Na2CO3 + H2O; Na2CO3 + H2O + CO2 ® ® 2NaHCO3 Этим способом могут быть получены соли угольной кислоты. Другой способ: 2. Обменная реакция BaCl2 + Na2CO3 ® ® BaCO3Ї + 2NaCl Соли: 1) карбонаты, растворимы в воде – только щелочных и NH+4 сильный гидролиз. При нагревании Ca(HCO3)2 ® CaCO3 + + CO2 + H2O CaCO3 ® CO2 + CaO Карбонаты щелочных металлов плавятся без разложения. Качественная реакция “вскипание” – сильная кислота CaCO3 + 2HCl ® CaCl2+ + CO2 + H2O CO2 вызывает помутнение известковой и баритовой воды Ca(OH)2 + + CO2 ® CaCO3 + H2O Растворение, ведущее к разрушению старых известковых гор. CaCO3 + H2O + CO2 ® ® Ca(HCO3)2 | Оксид углерода (II) CO (угарный газ) Бесцветный газ, без запаха, ядовит, т.к. соединяется с гемоглобином крови. Плохо растворим в воде. Получение: горение при недостатке O2 2C + O2 ® 2CO 2CH4 + 3O2 ® 2CO + + 4H2O В лаборатории: действие концентрирован. H2SO4 HCOOH ® CO + H2O Щавелевая кислота H2C2O4 ® CO + CO2+ +H2O Восстановитель Fe2O3 + + 3CO® 2Fe + 3CO2 O2 + 2CO ® 2CO2 Несолеобразующий, но при t = 200°C, 20 атм NaOH + CO ® O ® HC O – Na | Органические соединения CH4 карбиды – получаются при непосредственном взаимодействии с металлами. 2 группы. I. Карбиды металлического характера. Переходные Me + C. Электронная проводимость, металлический блеск. II. Ионные карбиды более электроположительные, бесцветные, прозрачные, не проводят электрический ток. 1) Al4C3 + 12H2O ® ® 4Al(OH)3 + 3CH4 c Be2C – та же реакция 2) CaC2 + 2H2O ® ® Ca(OH)2 + C2H2 Na2C2; K2C2; SrC2; BaC2; Cu2C2 При гидролизе – ацетилен и ненасыщенные углеводороды из Mg2C2; Fe3C, лантанидов. |
Приложение 9
Для контроля знаний по теме “Подгруппа углерода” можно привести несколько примеров в виде тестов.
Карточка 1.
1. Электронная конфигурация атома углерода в свободном состоянии:
а) 1s22s22p2;
б) 1s2 2s2 2p6;
в) 1s2 2s2 2p6 3s2 3p2;
г) 1s2 2s2 2p6 3s2 3p6 .
2. Валентность углерода в органических соединениях:
а) 1;
б) 4;
в) 2;
г) 3.
3. Степень окисления углерода в соединениях состава CH4:
а) 0;
б) +2;
в) +4;
г) -4.
4. В данной химической реакции углерод является:
2H2+ C ® СH4
а) восстановителем
б) окислителем,
5. По химическим свойствам углерод относится к:
а) неметаллам;
б) металлам.
Ключ для проверки:
1. а. 2. б. 3. г. 4. б. 5. а.
Карточка 2.
1. Какие реакции, схемы которые приведены ниже, используются для получения оксида углерода (IV) в лаборатории:
а. СaCO3 + HCl®
б. C + O2®
в. СaCO3®
г. CO + O2®
2. Степень окисления углерода в его высшем оксиде;
а) 0;
б) +2;
в) +4;
г) -4.
3. Какие вещества, формулы которых приведены, можно использовать для осушения углекислого газа:
а) концентрированная серная кислота;
б) оксид фосфора (V);
в) гидроксид натрия;
г) оксид кальция.
Напишите возможные уравнения реакции.
Похожие работы
... и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. На изучение этой темы отводится 7 ч [4, 5]. ГЛАВА 3. МЕЖПРЕДМЕТНЫЕ СВЯЗИ ПРИ ИЗУЧЕНИИ III И V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА 3.1 III-А группа 3.1.1 Бор 3.1.1.1 Распространение в природе Бор никогда не встречается в природе в свободном состоянии, он всегда оказывается связанным с кислородом. В этой ...
... на новые программы и учебники этот вопрос становится наиболее острым. Наша школа перешла на новое учебники О.С. Габриеляна и новую программу, как и большинство школ Заволжского района, поэтому мы представляем календарно-тематическое планирование к курсу "Органическая химия" 10 класс. Тематическое планирование составлено согласно программе разработанной Департамента образовательных программ и ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
... необходимостью творческого использования имеющихся у них знаний и приобретения недостающей информации) [10,11]. ГЛАВА III. УРОК «ПРАКТИКУМ ПО РЕШЕНИЮ ЗАДАЧ КУРСА ОРГАНИЧЕСКОЙ ХИМИИ С ЭКОЛОГИЧЕСКИМ СОДЕРЖАНИЕМ» Цель. Описывать и объяснять задачи с экологическим содержанием. Оптимальное использование в учебном процессе таких задач позволяет приблизить теоретический материал к жизни, сделать его ...
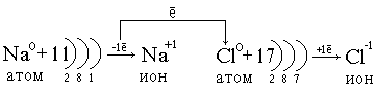
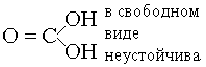

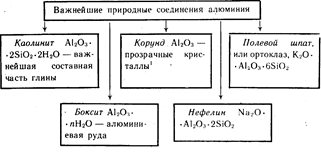
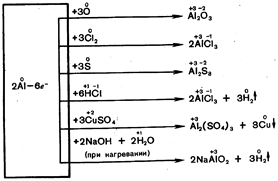
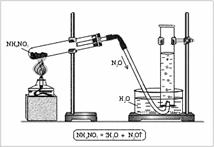
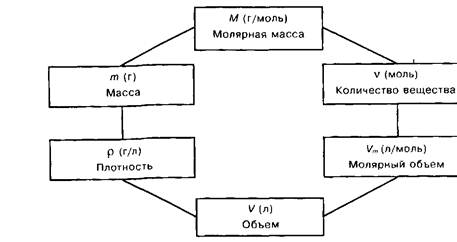
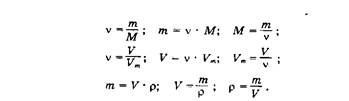

0 комментариев