Навигация
Расчет и анализ экспериментальных данных
2.1.3 Расчет и анализ экспериментальных данных.
Уравнение реакции:
2KIO3+5Na2SO3+H2SO4=I2+5Na2SO4+K2SO4+H2O
или
2IO3-+5SO32-+2H+=I2+5SO42-+H2O
|
|
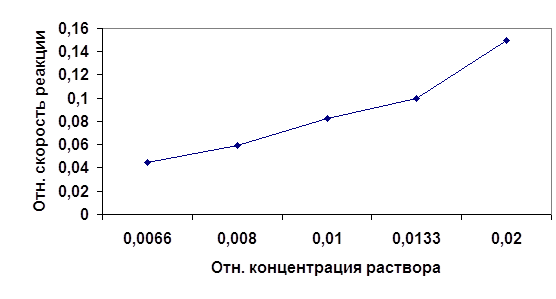
Рис1.График зависимости скорости протекания реакции от концентрации реагирующих веществ.
2.1.4.Выводы.
Из графика видно, что скорость является функцией концентрации реагирующих веществ. Это следует из того, что реагируют те молекулы, которые сталкиваются. Поэтому, чем больше концентрация (и следовательно вероятность столкновения молекул ) реагентов, тем выше скорость протекания реакции.
2.2 Зависимость скорости реакции от температуры.
2.2.1 Описание хода работы.
В одну пробирку помещено 20 капель раствора щавелевой кислоты. В другой - 20 капель перманганата калия, 20 капель концентрированной серной кислоты (пробирка охлаждается под струей холодной воды). Обе пробирки и термометр вставляются в отверстие крышки, которой закрыт химический стакан, наполненный водой (пробирки и термометр не должны касаться дна стакана). После этого стакан ставится на электроплитку и вода нагревается до температуры 30*С. Затем содержимое пробирки с перманганатом калия выливается в пробирку со щавелевой кислотой, которая остается в стакане. Одновременно включается секундомер и выключается только при полном обесцвечивании растворов. Затем опыт повторяется при температурах 40°,50° и 60°С. Данные заносятся в таблицу.
2.2.2. Данные опыта.
Уравнение реакции:
5H2C2O+ 2KMnO4+3H2SO4=10CO2+2MnSO4+K2SO4+8H2O
или
5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O.
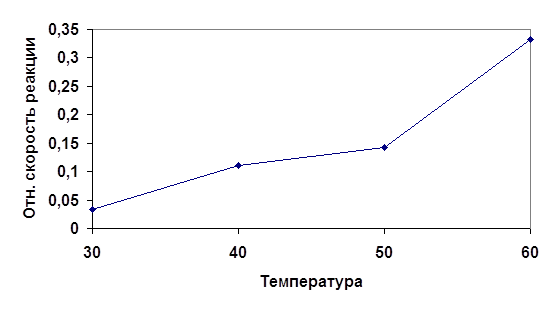
Таблица 2| № | Температура t, oC | Время от начала реакции до конца | Относительная скорость реакции u=1/t, с-1 |
| 1 | 30 | 30 | 0.033 |
| 2 | 40 | 9 | 0.111 |
| 3 | 50 | 7 | 0.142 |
| 4 | 60 | 3 | 0.333 |
|
|
2.2.3 Расчет и анализ экспериментальных данных.
Рис 2. График зависимости скорости протекания реакции от температуры.
2.2.4 Выводы.
Исходя из анализа полученных данных можно заключить, что скорость физико-химического процесса непосредственно зависит от температуры. Повышение температуры влечет за собой возрастания числа активных молекул, обладающих избыточной энергией. Избыточная энергия позволяет молекулам добиться того, чтобы столкновения были эффективными. Эта энергия также называется энергией активации.
2.3 Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ.
2.3.1 Описание хода работы.
Даны 2 пробирке с 10% раствором соляной кислоты. В одну из них помещают мел, в другую – мрамор (в одинаковых количествах).
2.3.2 Данные опыта.
В пробирке с мелом реакция протекает более интенсивно. В пробирке с мрамором реакция протекает значительно медленнее.
Уравнение реакции:
CaCO3+2HCl = CaCl2+H20+CO2
2.3.3 Расчет и анализ экспериментальных данных.
Величина поверхности мела значительно больше, чем мрамора. Это связано с особенностями строения этих веществ. Мел имеет более рыхлую структуру чем мрамор.
2.3.4 Выводы.
Величина поверхности вещества влияет на скорость реакции. Чем больше поверхность вещества, тем больше скорость протекания гетерогенной реакции.
2.4 Влияние концентрации реагирующих веществ на состояние равновесия.
2.4.1 Описание хода работы.
В стакан налито 10 мл 2-х %-го раствора FeCl3 и добавлено 10 мл 1 %-го раствора KCNS. Полученный раствор разделен на 4 пробирки. В 1-ю добавляется 3-5 капель концентрированного раствора FeCl3, во вторую – 2-3 капли концентрированного раствора KCNS, в третью помещено немного твердого KCl. Четвертая пробирка является контрольной. Cравнивается интенсивность окраски полученных растворов. Данные записываются в таблицу.
1.4.2.Данные опыта.Таблица 3
| № | Добавленное вещество | Изменение интенсивности окраски (усиление, ослабление) | Направление смещения равновесия |
| 1 | FeCl3 | Усиление | ® |
| 2 | KCNS | Усиление | ® |
| 3 | KCl | Ослабление | ¬ |
| 4 | –– | –– | « |
Уравнение реакции:
![]()
![]() FeCl3+3KCNS Fe(CNS)3+3KCL
FeCl3+3KCNS Fe(CNS)3+3KCL
2.4.3 Расчет и анализ экспериментальных данных.
В первой пробирке концентрация FeCl3 увеличилась, и интенсивность окраски усилилась, это связано с тем, что равновесие сместилось в сторону продукта реакции, усиливающего интенсивность окраски. Во второй пробирке увеличилась концентрация KCNS и интенсивность окраски усилилась т.к. равновесие сместилось в сторону продукта реакции, усиливающего интенсивность окраски. В третей пробирке увеличилась концентрация KCl и интенсивность окраски ослабилась, т.к. равновесие сместилось в сторону реагентов и скорость протекания реакции уменьшилась.
2.4.4. Выводы.
При увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции. При увеличении продуктов реакции равновесие смещается в сторону исходных веществ. Это один из случаев действия принципа Ле-Шателье (изменение концентрации).
2.5 Влияние температуры на состояние равновесия.
2.5.1 Описание хода работы.
В пробирке находится 4-5 мл. раствора крахмала. К нем приливают несколько капель раствора йода до появления синего окрашивания. Сначала пробирку нагревают в сосуде с горячей водой, а затем охлаждают до комнатной температуры.
2.5.2. Данные опыта.Уравнение реакции (схема):
![]()
![]() иод + крахмал иодокрахмал (DН<0).
иод + крахмал иодокрахмал (DН<0).
При нагревании окраска ослабевает. При охлаждении окраска усиливается.
2.5.3. Выводы.
При повышении температуры равновесие смещается в сторону протекания эндотермического процесса (DН>0), а понижение температуры вызывает смещение равновесия в сторону экзотермической реакции (DН<0).
3. Контрольные вопросы.
1. Объясните физический смысл константы скорости. Укажите факторы, влияющие на численное значение константы скорости.
Константа скорости k показывает, с какой скоростью идет химический процесс при концентрациях реагирующих веществ равных 1 моль/л. На числовое значение константы скорости влияет температура, природа реагирующих веществ, присутствие катализаторов.
2. Во сколько раз измениться скорость прямой и обратной реакций
2SO2(г) + О2(г) = 2SO3
если объем газовой смеси уменьшить в 3 раза.
u0=k*С2SO2*CO2
u1=k*(3CSO2)2*3CO2=27*k*C2SO2*CO2
u1 /u0=27.
3. Вычислить значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К.
Т1=280К uТ2=uТ1*g(Т2-Т1)/10 g=Ц10
Т2=300К lg g = (Ea/2,3R)*((T2-T1)/(T2*T1))
Еа=? Ea=80,3 кДж/моль
uТ2=10uТ1
Белорусский государственный университет информатики и радиоэлектроники.
Кафедра Химии.
Отчет по лабораторной работе №1
“Кинетика физико-химических процессов.
Химическое равновесие.”
Проверил преподаватель Выполнил студент 1 курса Соловей Нина Петровна группы 050506 ФКСиСБутылецкий Д.В.
Г. Минск 2000
Похожие работы
... изменение. 3. Что такое термодинамическая вероятность состояния (статистический вес). 4. Статистический смысл изменения энтропии. 5. Первый закон термодинамики. 6. Вывод рабочей формулы (36) данной работы. 7. Второй закон термодинамики и его статистический смысл. 6. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ И УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ МЕТАЛЛА Цель работы Исследовать фазовый переход первого рода ...
... самопроизвольно протекать не может, необходим подвод энергии извне. 2-й закон термодинамики с использованием понятия энтропии формулируется так: Все процессы в природе протекают в направлении увеличения энтропии, энтропия замкнутой системы не может самопроизвольно уменьшаться. В статистической физике энтропию связывают с термодинамической вероятностью состояния системы – с числом ...
... образовательным стандартом Высшего профессионального образования для студентов, обучающихся по специальности 020208 – «Биохимия». 4. Место дисциплины в профессиональной подготовке студентов Курс «кинетики и термодинамики ферментативных реакций» является заключительным курсом в цикле спецдисциплин федерального компонента, посвященных изучению ферментов. Он имеет основополагающее значение, ...
... программного комплекса ведется на основании задания на дипломную работу, утвержденное приказом ректора Донбасской машиностроительной академии по ГОСТ 19.101-77. Тема дипломной работы – «Программно – методический комплекс для мультимедийного представления учебной информации». Спецчасть разработки – «Разработка программного обеспечения для интерфейса оболочки комплекса и примера информационного ...





0 комментариев