Навигация
Синтез 4-окси-3-кабоксиазобензола
4.1. Синтез 4-окси-3-кабоксиазобензола
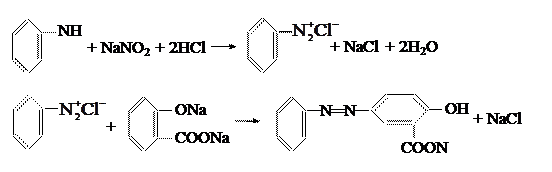

| Анилин 9,3 г (9,1 мл) Соляная кислота (d=1,18) 22,5 мл Нитрит натрия 7 г Карбонат натрия 3 г | Салициловая кислота 13,8 г Раствор едкого натра (36%-ный) 16,5 мл 2 фарфоровых стакана на 250 мл Мешалка |
В фарфоровом стакане на 150-200 мл растворяют 9,3 г анилина в смеси 22,5 мл концентрированной соляной кислоты и 22,5 мл воды. Раствор охлаждают до 0˚С и при перемешивании приливают к нему охлаждённый раствор 7 г нитрита натрия в 20 мл воды (при температуре не выше 2˚С). Конец реакции диазотирования контролируют по иодкрахмальной бумаге.
Через 10 мин после конца диазотирования избыток соляной кислоты удаляют осторожным внесением 2 г соды, после чего раствор должен всё же давать слабокислую реакцию на конго.
Раствор диазосоединения при перемешивании постепенно приливают к охлаждённому до 0˚С раствору 13,8 г салициловой кислоты в 16,6 мл 36%-ного едкого натра и 35 мл воды, к которому добавлено ещё 1 г соды (температура должна поддерживаться не выше 5˚С). Через 2 ч выпавший моноазокраситель отделяют фильтрованием.
Характеристика исходных реактивов
| № | Название | Формула | Мол. масса | ρ, г/см3 | Т. пл., ˚С | Т.кип., ˚С |
| Растворимость | |
| в воде | в орг. р-лях | ||||||||
| 1 | Анилин | C6H5NH2 | 93,13 | 1,02 | -6 | 184,4 | 1,585 | 3,4 | сп. э. бз. |
| 2 | Соляная кислота | HCl | 36,5 | 1,179 | - | - | - | - | - |
| 3 | Нитрит натрия | NaNO2 | 69,0 | 2,17 | 79 разл. | - | - | 84,5 | э. метанолабс. сп |
| 4 | Карбонат натрия | Na2CO3 | 105,9 | 2,53 | 851 | разл. | - | 21,5 | - |
| 5 | Салициловая кислота | HO-C6H4-COOH | 138,1 | 1,443 | 159 | возг. | - | 0,18 | сп. э. ац. хл. |
| 6 | Едкий натр | NaOH | 40,0 | 2,13 | 328 | 1388 | - | 109 | сп. гл. |
Ход работы и пояснения к синтезу
1. Анилин растворяем в разбавленной соляной кислоте.
2. Проводим реакцию диазотирования. Раствор охлаждаем до 0˚С и при перемешивании к нему добавляем охлаждённый водный раствор нитрита натрия. Для диазотирования применяется азотистая кислота, выделяющаяся из нитрита натрия под действием соляной кислоты. Для проведения реакции необходима низкая температура (не выше 2˚С), т.к. большинство диазосоединений неустойчивы. В процессе диазотирования раствор должен иметь кислую реакцию. Как правило, минеральной кислоты берётся в некотором избытке – 2,5 эквивалента на 1 эквивалент амина, т.к. при более высоких значениях pH равновесие ион аммония ↔ амин смещается в сторону свободного основания. Следует отметить также, что анионы галогенводородных кислот действуют в данной реакции каталитически. При небольших концентрациях водородных ионов образовавшееся диазосоединение может реагировать с исходным анилином, образуя диазоаминосоединение: 
 что является побочным продуктом. Для контроля кислотности пользуемся реакцией на конго – красный: посинение бумажки от капли раствора указывает на присутствие соляной кислоты. Необходимое для реакции нитрита натрия следует дозировать как можно точнее, т.к., во-первых, диазотирование протекает практически количественно (этой реакцией пользуются при объёмном анализе ароматических аминов) и, во-вторых, избыток азотистой кислоты уменьшает устойчивость диазорастворов. Избыток азотистой кислоты обычно определяют в конце реакции. Для этого пользуются йодкрахмальной бумажкой (фильтровальная бумага, пропитанная раствором крахмала и йодистого калия). Образовавшая из нитрита натрия в кислой среде азотистая кислота, реагирует с йодистым калием, выделяя йод, который с крахмалом даёт синее окрашивание: 2HNO2 + KI + 2H2O → I2 + 2KCl + 2NO + 2H2O. При правильно проведённом диазотировании реакция на азотистую кислоту в конце процесса должна быть очень слабой, т.е. йодкрахмальная бумажка должна быть синей в процессе реакции, когда много свободной азотистой кислоты, к концу реакции синее окрашивание исчезает. Таким образом получаем водный раствор соли диазония. Механизм реакции диазотирования приведён подробно в литературной части (стр. 22).
что является побочным продуктом. Для контроля кислотности пользуемся реакцией на конго – красный: посинение бумажки от капли раствора указывает на присутствие соляной кислоты. Необходимое для реакции нитрита натрия следует дозировать как можно точнее, т.к., во-первых, диазотирование протекает практически количественно (этой реакцией пользуются при объёмном анализе ароматических аминов) и, во-вторых, избыток азотистой кислоты уменьшает устойчивость диазорастворов. Избыток азотистой кислоты обычно определяют в конце реакции. Для этого пользуются йодкрахмальной бумажкой (фильтровальная бумага, пропитанная раствором крахмала и йодистого калия). Образовавшая из нитрита натрия в кислой среде азотистая кислота, реагирует с йодистым калием, выделяя йод, который с крахмалом даёт синее окрашивание: 2HNO2 + KI + 2H2O → I2 + 2KCl + 2NO + 2H2O. При правильно проведённом диазотировании реакция на азотистую кислоту в конце процесса должна быть очень слабой, т.е. йодкрахмальная бумажка должна быть синей в процессе реакции, когда много свободной азотистой кислоты, к концу реакции синее окрашивание исчезает. Таким образом получаем водный раствор соли диазония. Механизм реакции диазотирования приведён подробно в литературной части (стр. 22).
3. Проводим реакцию азосочетания полученной соли диазония с салициловой кислотой. После окончания реакции диазотирования избыток соляной кислоты удаляем осторожным внесением соды, после чего раствор всё же должен давать слабокислую реакцию на конго. Раствор полученного диазосоединения при перемешивании постепенно приливаем к охлаждённому до 0˚С щелочному раствору салициловой кислоты. Температура синтеза не должна превышать 5˚С. Салициловая кислота 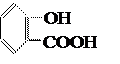
 является окси-кислотой или фенолокислотой, она имеет две функциональные группы ─OH и ─COOH и потому образует два ряда производных. Как кислота, салициловая кислота по COOH-группе может образовать хлор-ангидрид, соль, эфир. С другой стороны, салициловая кислота может выступать как фенол по OH-группе, образовывать феноляты и участвовать в реакции азосочетания. Салициловая кислота труднее, чем фенол, вступает в реакцию азосочетания. Сочетание с салициловой кислотой идёт в щелочной среде, диазогруппа вступает в п-положение к оксигруппе:
является окси-кислотой или фенолокислотой, она имеет две функциональные группы ─OH и ─COOH и потому образует два ряда производных. Как кислота, салициловая кислота по COOH-группе может образовать хлор-ангидрид, соль, эфир. С другой стороны, салициловая кислота может выступать как фенол по OH-группе, образовывать феноляты и участвовать в реакции азосочетания. Салициловая кислота труднее, чем фенол, вступает в реакцию азосочетания. Сочетание с салициловой кислотой идёт в щелочной среде, диазогруппа вступает в п-положение к оксигруппе:
 Механизм реакции азосочетания приведён в литературной части (стр. 30). Для поддержания щелочной среды к раствору добавляется ещё 1 г. соды. Через 2 часа выпадает моноазокраситель оранжевого цвета, который отделяют фильтрованием.
Механизм реакции азосочетания приведён в литературной части (стр. 30). Для поддержания щелочной среды к раствору добавляется ещё 1 г. соды. Через 2 часа выпадает моноазокраситель оранжевого цвета, который отделяют фильтрованием.
Чтобы легче установить строение полученного азокрасителя, его можно восстановить с помощью гидросульфита натрия до двух простых по строению диаминов: 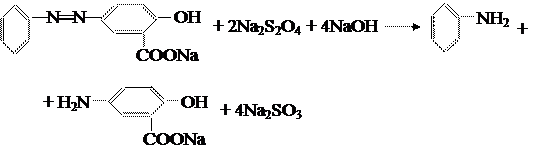

Полученные диамины можно охарактеризовать данными элементного анализа, спектроскопии и хроматографии. Данный моноазокраситель можно использовать для получения вышеуказанных аминов, если их труднее получить другим путём. В качестве восстановителя также можно использовать SnCl2 в кислой среде.
Расчёты (по проведённому синтезу):
5. Выводы
1. Собран и проанализирован литературный материал по красителям, азокрасителям, способам их получения и свойствам.
2. Изучены условия реакции диазотированияи получена соли диазония.
3. Изучены условия реакции азосочетания соли диазония с салициловой кислотой и получен моноазокраситель – 4-окси-3-карбоксиазобензол.
6. Список литературы
1. Гурвич Я. А., Кулик С. Т.. Химия и технология промежуточных продуктов органических красителей и химикатов для полимерных материалов. – М. Высшая школа. 1974. с.126-171
2. Венкатараман К.. Химия синтетических красителей. Т.2 -Л. Хим. литература. 1957. с.1664.
3. Несмеянов А. Н., Несмеянов Н. А.. Начала органической химии. Т.2. –М. Химия. 1970. с.823.
4. Неницеску К. Д.. Органическая химия. Т.1. – М. «ИЛ». 1963. с.863
5. Робертс Дж., Касерио М.. Основы органической химии. Т.2. – М. Мир. 1968. с.550
6. Каррер П.. Курс органической химии. 2-е издание (стереотипное). – Л. 1962. с.358-359,586,588,589,740.
7. Физер Л., Физер М.. Органическая химия. Т.2. – М. Химия. 1969. с.687.
8. Гауптман, Грефе Ю., Ремане Х.. Органическая химия. – М. Химия. 1979. с.740-746.
9. Храмкина М. Н.. Практикум по органическому синтезу. – Л. Химия. 1969. с.328.
10. Гинзбург О. Ф.. Лабораторные работы по органической химии. – М. Высшая школа. 1970. с.295.
11. Аграномов А. Е., Шаборов Ю. С.. Лабораторные работы в органическом практикуме. – М. Химия. 1974. с.375.
12. Сайкс П.. Механизмы реакций в органической химии. – М. Химия. 1977. с.319.
13. Бреслоу Р.. Механизмы органических реакций. – М. Мир. 1968. с.277.
14. Перельман В. И.. Краткий справочник химика. – М. Л. Химия. 1964. с.619.
0 комментариев