Навигация
Ar–OH + RX → Ar–O–X + NaX
4. Ar–OH + RX → Ar–O–X + NaX
5. C6H5ОН + Cl–CO–CH3 → C6H5–О–CO–CH3 + HCl
6. C6H5ОН + Zn → C6H6 + ZnO
Свойства бензольного ядра
1. C6H5ОН + 3Br2 → C6H2Br3OH + 3HBr
2. C6H5ОН + Cl2 → о-C6H4ClОН + п-C6H4ClОН
3. C6H5ОН +3HNO3 (к) → C6H2(NO2)3ОН + 3H2O
4. C6H5ОН + HNO3(p) → о-C6H4NO2ОН + п-C6H4NO2ОН
5. C6H5ОН + CH2C(CH3)CH3 → (CH3)3C–C6H4ỢOH
Фенол применяется для производства красителей пикриновой кислоты и особенно для получения пластмасс – фенолоформальдегидных смол. Растворы фенола используются для дезинфекции.
Альдегиды, их строение, номенклатура, химические свойства (реакции окисления и восстановления). Получение и использование муравьиного и уксусного альдегидов. Фенолформальдегидные смолы.Соединения, в молекулах которых карбонильная группа связана с одним органическим радикалом и с атомом водорода называются альдегидами. Соединения, в которых карбонильная группа связана с двумя органическими радикалами, называются кетонами. В функциональной группе альдегидов и кетонов связь между углеродом и кислородом двойная. Углеродный атом карбонильной группы находится в состоянии sp2-гибридизации и его конфигурация является плоской. В отличие от двойной С=С связи, вследствие большей ЭО кислорода по сравнению с углеродом, связь поляризована за счет смещения электронной плотности π-связи к кислороду:
>Сδ+ = Оδ–
Полярность сказывается на физических и химических свойствах. Многие альдегиды и кетоны хорошо растворимы в воде. Низшие альдегиды обладают резким запахом, многие высшие альдегиды и кетоны обладают приятным запахом и используются в парфюмерии.
Реакции присоединения:
1. R–CHO + 2H → R–CH2–OH R’R”C=O + 2H → R’R”CH–OH
2. –Cδ+– + :CN → –C–CN + H+ → –C–CN
|| | |
Oδ– O– OH
3. H2CО+ H2O → H2C–(OH)2
OH HCl OR’
4. R–CHO + R’OH → R–C< + R’OH —→ R–C< + H2O
| OR’ | OR’
H H
5. R–COH + Ag2O → R–COOH + 2Ag
Реакции замещения кислорода карбонильной группы.
Формальдегид: в промышленности формальдегид получают из метилового спирта. Пары спирта вместе с воздухом пропускают над раскаленной медью:
2СН3ОН + 2О2 → 2СН2О + 2H2O К-р: Cu
Другим важным способом является неполное окисление метана:
СН4 + О2 →СН2О + H2O к-р: t=400°
Используется для различных синтезов. Обладает токсичностью для микроорганизмов и применяется как дезинфицирующее средство. Используется в кожевенной промышленности, для хранения медицинских препаратов и т. д.
Ацетальдегид: в промышленности получают из ацетилена по реакции Кучерова и окислением этанола. Современным способом получения является каталитическое окисление этилена:
СН2=СН2 + ⅛О2 → СН3–СНО К-р: PdCl2
Используется для получения уксусной кислоты, этилацетата, “сухого спирта” (метальдегида) и этилового спирта.
Ацетон: в промышленности получают каталитической кетонизацией уксусной кислоты, дегидрированием изопропилового спирта, прямым окислением пропилена:
СН2=СН–СН3 + ⅛О2 → СН3–СО–СН3 К-р: PdCl2, Cu2Cl2
Ацетон применяется как растворитель для лаков, кинопленки, для получения искусственного ацетатного волокна, ацетилена, а также во многих синтезах.
Карбоновые кислоты. Строение карбоксильной группы. Химические свойства карбоновых кислот. Муравьиная кислота, ее восстановительные способности. Уксусная и стеариновая кислоты, их применение. Олеиновая кислота как представитель непредельных карбоновых кислот. Мыла как соли высших карбоновых кислот.
Карбоновыми кислотами называются соединения, содержащие в молекуле группу –СООН , носящую название карбоксильной, происходящее от названий составляющих ее групп: карбонильной –СНО, гидроксильной –ОН. По числу карбоксильных групп кислоты делятся на одноосновные, двухосновные и многоосновные. По характеру радикала – на предельные, непредельные, ароматические и т. д. Изомерия обусловлена строением углеводородного радикала. Для низших членов ряда наиболее употребительны тривиальные названия. Кислоты имеют высокие температуры кипения и плавления, что обусловлено наличием водородных связей. Низшие кислоты обладают острым кислым запахом, высшие запаха не имеют. Низшие кислоты хорошо растворимы в воде, но с увеличением радикала растворимость уменьшается.
Карбоксильная группа содержит в себе карбонильную и гидроксильную группы. Вследствие близкого расположения они оказывают сильное влияние друг на друга. Гидроксогруппа кислот легче отщепляет протон водорода, чем гидроксогруппа спиртов. Причина усиления кислотности – полярная карбонильная группа. Карбонильный атом углерода, несущий положительный заряд, стремится погасить дефицит электронов, притягивая электронные пары не только связей R–C и С=О, но и свободные электронные пары кислорода гидроксильной группы. Поэтому гидроксильный кислород сильнее оттягивает электронную пару связи О–Н (1), усиливая положительный заряд на водороде (2):
1.
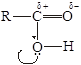
2.
![]()
Химические свойства:
1. RCOOH + NaOH → RCOONa + H2O
2. 2RCOOH + Mg → (RCOO)2Mg + H2
Похожие работы
... Российского централизованного многонационального государства. Они усилили власть царя, привели к реорганизации местного и центрального управления, укрепили военную мощь страны. Политика (см. Программу для поступающих): Внешняя политика: Основными задачами внешней политики России в XVI в. являлись: на западе - борьба за выход к Балтийскому морю, на юго-востоке - и востоке - борьба с Казанским и ...
... математики тригонометрической подстановки и проверка эффективности разработанной методики преподавания. Этапы работы: 1. Разработка факультативного курса на тему: «Применение тригонометрической подстановки для решения алгебраических задач» с учащимися классов с углубленным изучением математики. 2. Проведение разработанного факультативного курса. 3. Проведение диагностирующей контрольной ...
... к условиям существования. Отсюда и появилось представление о приспособительном характере эволюции. На основе изучения возникновения приспособлений (адаптаций) возникло целое направление в биологии – учение об адаптациях. Приспособительные признаки или адаптации подразделяются на физиологические и морфологические. Физиологические адаптации. Обилие и большое значение для жизненной стойкости ...
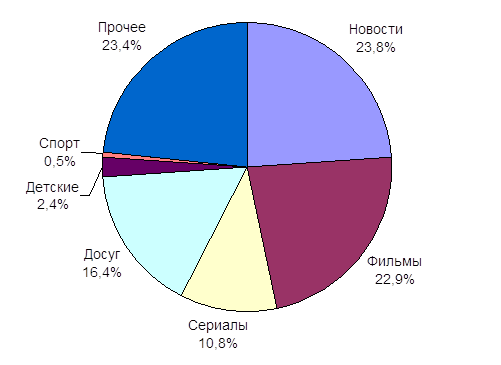
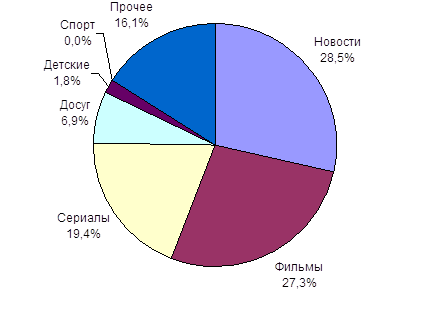
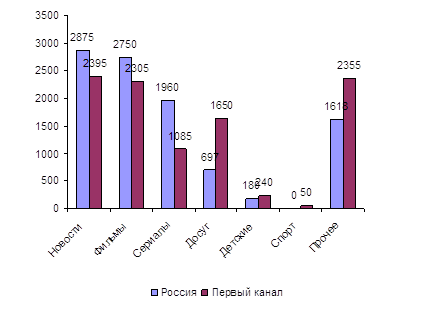
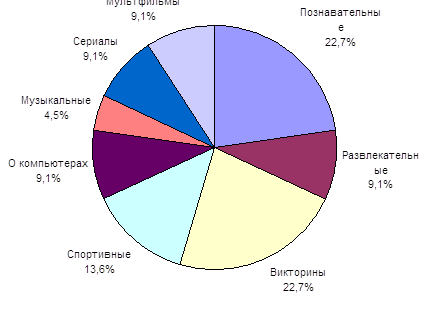
... долю детского контента, назвали некоторые проблемы детского телевидения и их причины. Во второй главе мы провели анализ детских и подростковых программ, транслируемых на «Первом канале» и канале «Россия». В параграфе 2.1 оценили значимость названных каналов, сделали их характеристику, попытались сформулировать политику вещания. В параграфе 2.2 изучили детский контент на главных каналах ...

0 комментариев