Навигация
Подготовка сырья: очистка и плавление серы; очистка, сушка и дозировка воздуха;
1. подготовка сырья: очистка и плавление серы; очистка, сушка и дозировка воздуха;
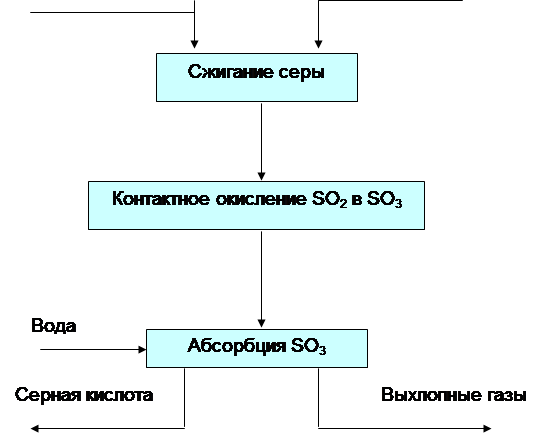
2. сжигание серы: S + O2 = SO2 (1) .Процесс ведут с избытком воздуха;
3. контактное окисление SO2 в SO3: SO2 + 0,5O2 = SO3 (2).Процесс идет на ванадиевом катализаторе при температуре 420-550*С;
4. абсорбция SO3 : SO3 + H2O = H2SO4 (3). Абсорбционная колонна орошается 98,3% H2SO4. Перед отправкой на склад кислота разбавляется до ~93% H2SO4 в соответствии с требованиями ГОСТа.
Исходные данные для расчета
| Показатель | Значения |
| Степень превращения серы в SO2, % | 92.0 |
| Степень превращения SO2 в SO3, % | 99.0 |
| Степень абсорбции SO3, % | 99.8 |
| Содержание SO2 в газе, поступающем в контактный аппарат, % (по объему) | 8.0 |
| Содержание H2SO4 в целевом продукте, % по массе | 92.5 |
| Базис расчета, кг H2SO4 | 2000 |
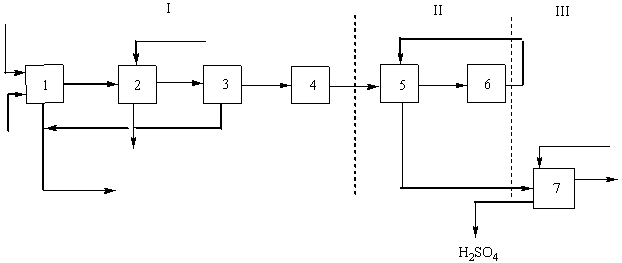
Выполнение расчета. 1.Составляем блок-схему производства.
|
| |||||
 | ||||||
03
![]()


 011
011
![]() 12 23 302
12 23 302
![]()
![]()
![]() 012
012
![]()
![]() 301
301
011 - Сера жидкая
012 - Воздух
12 - SO2 содерж. газ
23 - SO3 содерж. газ
03 - Вода
301 - Выхлопные газы
302 – Серная кислота
2. Составление уравнений по каждому узлу.
1.Составляем уравнения по первому узлу:
0.92*N011=N12SO2
N12SO2=N12*0.08 N011=X1
0.92*N011=N12*0.08 N12=X3
0.92*X1=X3*0.08 (1)
2. Составляем уравнения по второму узлу:
а) 0,99*N12SO2=N23SO3
0.99*N12*0.08=N23SO3 N23SO3=X4
0.99*X3*0.08=X4 (2)
б) N12*(0.21-0.08)=2N23SO3
X*(0.21-0.08)=2X4 (3)
3.Составляем уравнение по третьему узлу:
а) G302*0.925=2000 базисное уравнение G302=X7
X7*0.925=2000 (4)
б) 0.998*N23SO3=2000/Mr(H2SO4)
0.998*X4=2000/98 (5)
в) N301=N301SO2 + N301N2 + N301SO3 + N301O2
N301SO2=N12SO2*(1-0.99)=N12SO2*0.01=N12*0.08*0.01
N301N2= 0.79*N012
N301SO3=N23SO3*(1-0.998)=0.002*N23SO3
N301O2=N12*(0.21-0.08)-1/2*N12*(0.21-0.08)=N12*0.13*(1-
1/2)=0.13/2*N12
N301=N12*0.08*0.01+0.79*N012+0.002*N23SO3+0.065*N12
N301=0.0658*N12+0.79*N012+0.002*N23SO3
X6=0.0658*X3+0.79*X2+0.002*X1 (6)
N012=X2
N301=X6
Но надо учесть , что N12=N012 ,т.е. X2=X3 (7)
6 неизвестных и 7 уравнений. Выбрасываем уравнение (3) и получаем систему уравнений:
![]() 0,92*X1=0.08*X3
0,92*X1=0.08*X3
0.99*0.08*X3=X4
0.925*X7=2000
0.998*X4=20.41
X6=0.0658*X3+0.79*X2+0.002*X4
X3=X2
![]() 0.92*X1-0.08*X3=0
0.92*X1-0.08*X3=0
0.0792*X3-X4=0
X7=2162.2
X4=20.45
0.8558*X3+0.002*X4- X6=0
![]() 0.92*X1-0.08*X3=0
0.92*X1-0.08*X3=0
0.0792*X3-20.45=0
X7=2162.2
X4=20.45
0.8558*X3+0.002*20.45-X6=0
![]()
0.92*X1-0.08*X3=0
X3=257.23
X7=2162.2
X4=20.45
0.8558*X3+0.041-X6=0
![]() 0.92*X1=0.08*257.23
0.92*X1=0.08*257.23
X3=257.23
X7=2162.2
X4=20.45
0.8558*257.23+0.041-X6=0
![]() X1=22.37=N011
X1=22.37=N011
X3=257.23=X2=N12=N012
X7=2162.2=G301
X4=20.45=N23SO3
X6=220.18=N301
1.Количество целевого продукта:
X7=G301=2162.2 кг 92.5% серной кислоты
2. Расход серы:
X1=N011=22.37 кмоль
ms=Ns*MS=22.37*32=715.84 кг
GSнач=715,84/0,92=778,1 кг было введено в систему
3. Расход воздуха:
X2=X3=N012=257.23 кмоль
Gвозд=Nвозд*Mвозд=257,23*29=7459,67 кг
4.Определение расхода кислорода и азота
GO2=7459,67*0,21=1566,7 кг
GN2=7459,67*0,79=5893,1 кг
5. Определяем количество SO2, содержащегося в газе:
X3=N12=257.23 кмоль
N12SO2=257.23*0.08=20.58 кмоль
GSO2=NSO2*MSO2=20.58*64=1317 кг
6. Определение SO3, содержащегося в газе:
X4=N23SO3=20.45 кмоль
GSO3=NSO3*MSO3=20.45*80=1636 кг
7. Расход воды на абсорбцию:
G03=G301*MH2O/MH2SO4=2162.2*18/98=397 кг
8. Выхлопные газы:
X6=N301=220.18 кмоль
G301=G301SO2+G301N2+G301SO3+G301O2=1317*0.01+5893.1+
0.002*1636+0.065*7459.67=13.17+5893.1+3.27+484.88=
6394.42 кг
3.Материальный баланс.
| Введено | Получено | ||||
| Реагенты | кг | % масс | Продукты | кг | %масс |
| Сера | 778,1 | 9 | Серная кислота: | 2162,2 | 25 |
| Вода | 397 | 4,6 | H2SO4 | 2000 | 23,2 |
| Воздух: | 7459,67 | 86,4 | H2O | 162,2 | 1,8 |
| 21% О2 | 1566,7 | 18,1 | Выхлопные газы: | 6394,42 | 74,1 |
| 79%N2 | 5893,1 | 69,3 | SO2 | 13,17 | 0,15 |
| N2 | 5893,1 | 68,25 | |||
| SO3 | 3,27 | 0,06 | |||
| O2 | 484,88 | 5,64 | |||
| Невязка | 78,15 | 0,9 | |||
| Всего | 8634,77 | 100 | Всего | 8634,77 | 100 |
Список литературы.
1. Г.Н. Кононова, В.В. Сафонов, Н.Г. Чабан. Разработка алгоритма и расчет материального баланса химико-технологической системы. Москва. 1995.
2. Учебник для химико-технологических специальностей ВУЗов под редакцией проф. И.П. Мухленова. Общая химическая технология. Часть 2 « Важнейшие химические производства». Москва «Высшая школа»1984.
3. А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен. Общая химическая технология. Издание второе исправленное и дополненное. Москва «Высшая школа» 1990.
4. Конспект лекций (лектор: Г.Н. Кононова)
Похожие работы
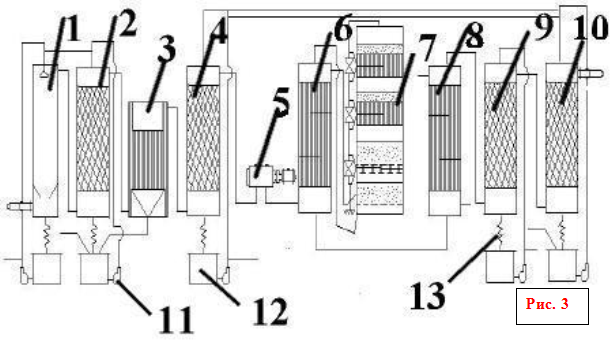
... , представлена на рис. 9. Производительность установки до 1500 т/сут по моногидрату. Расходные коэффициенты (на 1 т моногидрата): колчедан 0,82 т, вода 50 м3, электроэнергия 82 кВт·ч. Рис. 9. Технологическая схема производства серной кислоты из колчедана двойным контактированием ДКДА. 1 – полая промывная башня, 2 – промывная башня с насадкой, 3 – увлажнительная башня, 4 – электрофильтры, 5 – ...
дии на первой стадии получают SO2, путем обжига FeS2, затем SO3, после чего на третьей стадии получают серную кислоту. Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде. Например отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках ...
... для получения минеральных удобрений, а также солей, кислот, взрывчатых веществ. Серная кислота применяется и при производстве красителей, химических волокон, в металлургической, текстильной, пищевой промышленности и т. д. Серная кислота может существовать как самостоятельное химическое соединение H2SO4, а также в виде соединений с водой H2SO4*2H2O, H2SO4*H2O, H2SO4 *4H2O и с триоксидом серы ...
... как температура газов снижается добавкой холодного воздуха между слоями. Абсорбция SO3 производится так же, как и в технологической схеме. Важнейшие тенденции развития производства серной кислоты контактным способом: 1) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов; ...


0 комментариев