Навигация
Спиртами или алкоголями называют производные углеводородов, в молекулах которых один или несколько водородных атомов замещены на соответствующее число гидроксильных групп (—ОН).
Характер алифатического радикала, с которым связана гидроксильная группа, определяет предельность или непредельность спиртов:
H3C—CH2—CH2—OH CH2==CH—CH2—OH
пропиловый спирт аллиловый спирт
От числа гидроксильных групп, входящих в состав молекулы спирта зависит его атомность. Спирты бывают одноатомные (I), двухатомные (II), трехатомные (III) и многоатомные (IV):
CH3—CH2—OH HOCH2—CH2OH HOCH2—CH(OH)—CH2OH HOCH2—(CHOH)4—CH2OH гексит
этиловый этиленгликоль глицерин спирт
(I) (II) (III) (IV)
Одноатомные предельные спирты (алканолы)
Строение
Изучение спиртов лучше начать с рассмотрения предельных одноатомных, имеющих общую формулу CnH2n+1OH, или в общем виде R—OH.
В зависимости от характера углеродного атома (первичный, вторичный или третичный), с которым связана гидроксильная группа, различают спирты первичные, вторичные и третичные:
OH
|
CH3—CH2—CH2—OH H3C—CH—CH3 H3C—C—CH3
| |
OH CH3
пропиловый изопропиловый трет-бутиловый
спирт спирт спирт
(первичный) (вторичный) (третичный)
(Одновалентная спиртовая группа —СН2OН называется первичной, двухвалентная - ==СН—ОН - вторичной и трехвалентная - ººС—ОН - третичной спиртовой группой.)
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
| H | H—C—OH или CH3—OH | H структурные формулы | H .. .. H : C : O : H .. .. H электронная формула |
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Кислород в гидроксильной группе, обладая значительной электроотрицательностью, оттягивает электронную плотность связи O—Н в свою сторону. Поэтому такая связь частично поляризована: на атоме кислорода появляется частичный отрицательный, а на водороде — частичный положительный заряды:
d- d+
O ¬ H
Однако эта поляризация снижается за счет донорных свойств алкильных радикалов:
d- d+
R ® O ¬ H
Таким образом, подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол). Он немного "кислее", чем вода.
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
Номенклатура и изомерия
Номенклатура. Названия спиртов чаще всего связывают с названиями радикалов, с которыми связана гидроксильная группа:
H3C—OH C2H6—OH H3C—CH—OH
|
CH3
метиловый этиловый изопропиловый
спирт спирт спирт
По систематической номенклатуре спирты называют по названию соответствующего алкана с добавлением суффикса -ол (СН3ОН - метанол, C2H5—ОН - этанол и т.д.). Главную цепь нумеруют с того конца, к которому ближе расположена гидроксильная группа. Например:
CH3—CH2—CH2—OH CH3—CH—OH CH3—CH—CH2—CH—CH3
| | |
CH3 CH3 OH
пропанол-1 пропанол-2 4-метилпентанол-2
Иногда спирты рассматривают как производные простейшего спирта — метилового СH3—ОН, который называют также карбинолом:
CH3—CH2—OH
метилкарбонил
(этиловый спирт)
Изомерия. Строение спиртов зависит от структуры углеродной цепи и положения в ней гидроксильной группы. Например:
CH3—CH2—CH2—CH2—OH CH3—CH2—CH—OH3 CH3—CH—CH2OH
| | OH CH3
н-бутиловый спирт, втор-бутиловый изобутиловый
бутанол-1 спирт, бутанол-2 спирт, 2-ме-
тилпропанол-1
OH
| CH3—C—CH3
|
CH3
трет-бутиловый спирт,
2-метилпропанол-2
Получение
В природе спирты встречаются редко, чаще — в виде производных (сложные эфиры и др.), из которых они могут быть получены. Для получения спиртов важную роль играет органический синтез. Приведем некоторые способы синтеза спиртов.
1. Гидратация (присоединение воды к алкенам). Реакция проводится в присутствии катализаторов. При использовании в качестве катализатора серной кислоты (сернокислотная гидратация) реакция идет в две стадии:
H2C==CH2 + HO—SO2—OH ® H3C—CH2—OSO2—OH
этилсерная кислота
H3C—CH2—OSO2—OH + H2O ® H3C—CH2—OH + H2SO4
этиловый спирт
Если реакцию гидратации проводить при высокой температуре (300 - 350 °С) и давлении в присутствии катализатора (смеси фосфорной к вольфрамовой кислот), то реакция идет в одну стадию. Это—метод прямой гидратации. При получении этилового спирта этот метод вытеснил сернокислотную гидратацию. Гидратация алкенов имеет важное промышленное значение. Этот способ позволяет получать спирты из доступного и дешевого сырья — газов крекинга. Так, из 1 т этилене можно получить 1,4 т спирта. Впервые в нашей стране этиловый спирт начали получать гидратацией этилена с 1952 г. (г. Сумгаит).
2. Гидролиз моногалогенопроизводных. Реакцию проводят, нагревая галогеналкилы с водой или водным раствором щелочей:
C2H6Cl + H2O ® C2H6OH + HC
3. Получение метанола из синтез-газа. Процесс идет при 220—300 °С и сравнительно невысоком давлении с использованием катализатора из оксидов меди и цинка:
кат.
CO + 2H2 ® CH3OH
Из синтез-газа можно получать и другие спирты.
4. Восстановление альдегидов и кетонов. При восстановлении альдегидов образуются первичные, а при восстановлении кетонов — вторичные:
O
// 2H
H3C—C ® H3C—CH2OH
\ H
уксусный этиловый
альдегид спирт
2H
H3C—CO—CH3 ® H3C—CH—CH3
|
OH
ацетон изопропиловый
спирт
5. Спиртовое брожение (расщепление) моносахаридов C6H12O6 под влиянием ферментов:
зимаза
C6H12O6 —® C2H6OH + 2CO2
Физические и химические свойства
Физические свойства. Физические свойства некоторых одноатомных спиртов приведены в таблице.
Таблица 1. Физические свойства некоторых одноатомиых спиртов
| Название спиртов | Формула | tкип,°C | tпл,°C | d204 |
| Метиловый (метанол) | СН3ОН | 64,7 | -97,8 | 0,7930 |
| Этиловый (этанол) | C2H5OH | 78,3 | -117,3 | 0,7900 |
| Пропиловый (пропанол-1) | н-С3Н7ОН | 97,2 | -127 | 0,8040 |
| Изопропиловый (пропанол-2) | СH3СН(ОН)СН3 | 82,2 | -88 | 0,7850 |
| Бутиловый (бутанол-1) | н-C4H9OH | 117,7 | -79,9 | 0,8090 |
| втop-Бутиловый (бутанол-2) | СH3СН2СН(ОН)СН3 | 100 | -89 | 0,8080 |
| Изобутиловый (2-метилпропанол-1) | СН3СН(СН3)СН2OН | 108,4 | -108 | 0,8010 |
| трет-Бутиловый (2-метилпропанол-2) | (СН3)3СОН | 83 | +25 | 0,7880 |
| Амиловый (пентанол-1) | C5H11OH | 138 | -78,2 | 0,8140 |
| Гексиловый (гексанол-1) | C6H13OH | 157,2 | -51,6 | 0,8190 |
| Гептиловый (гептанол-1) | C7H15OH | 176,3 | -34,1 | 0,8220 |
| Октиловый (октанол-1) | C8H17OH | 195,0 | -16,3 | 0,8240 |
| Нониловый (нонанол-1) | C9H19OH | 213,5 | -5,0 | 0,8270 |
| Дециловый (деканол-1) | C10H21OH | 231,0 | +6,0 | 0,8290 |
Предельные одноатомные спирты от C1 до C12 — жидкости. Высшие спирты — мазеобразные вещества, от C21 и выше — твердые вещества.
Все спирты легче воды (плотность ниже единицы). Температура кипения спиртов нормального строения повышается с увеличением молекулярной массы. Спирты нормального строения кипят при более высокой температуре, чем спирты с изостроением. В воде хорошо растворяются метиловый, этиловый и пропиловый спирты. С увеличением молекулярной массы растворимость спиртов снижается. Низшие спирты легче воспламеняются и горят бесцветным пламенем. Спирты с большой молекулярной массой коптят при горении.
Температура кипения спиртов выше, чем галогеналкилов и углеводородов с тем же числом углеродных атомов. Это объясняется тем, что молекулы спирта, как и воды, являются ассоциированными жидкостями за счет водородных связей, возникающих между молекулами:
. . . : H—O : . . . H—O : . . . H—O : . . .
| | |
R R R
Водородная связь оказывает большое влияние на физические свойства спиртов.
Химические свойства. Основные химические свойства спиртов определяются реакционноспособной гидроксильной группой. Химические реакции могут идти или только по водороду гидроксильной группы, или протекать с участием всей группы.
Реакции гидроксильного водорода.
1. Взаимодействие спиртов со щелочными металлами (образование алкоголятов). Спирты, как известно, обладают чрезвычайно слабыми кислотными. Однако атом водорода гидроксильной группы, обладая некоторой подвижностью, способен обмениваться в реакциях замещения на активные металлы:
2C2H6OH + 2Na ® 2C2H6ONa + H2
этилат
натрия
Образующиеся продукты называют алкоголятами (от названия спиртов — алкоголи). Алкоголяты метилового спирта называются метилатами, а этилового — этилатами и т.д. Алкоголяты — твердые, неустойчивые вещества, легко подвергающиеся гидролизу:
C2H6ONa + H2O ® C2H6OH + NaOH
Алкоголяты щелочных металлов обладают более сильными основными свойствами, чем гидроксиды щелочных металлов.
2. Образование простых эфиров.
Взаимодействием алкоголятов с галогеналкилами можно получить простые эфиры:
C2H6—ONa + I—C2H6 ® C2H6—O—C2H6 + NaI
диэтиловый
эфир
Похожие работы
... к организации налоговых проверок на предприятиях, проводимых МИФНС России №3 по Нижегородской области. 1.3 Организация проведения налогового контроля в МИФНС России №3 по Нижегородской области по производству и обороту этилового спирта, алкоголя и спиртосодержащей продукции Налоговый контроль может осуществляться налоговыми организациями в различных формах. Одна из них постановка ...
... от положения гидроксильной группы при том и другом углеродном скелете возможны еще два изомерных спирта: 12 34 1 2 Метилпропанол – 2 Бутанол - 2 СН3 – СН – СН2 –СН3 Н3С – С – СН3 ОН ОН Число структурных изомеров в ...
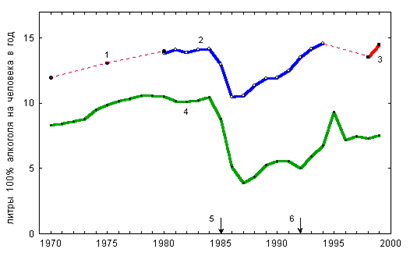
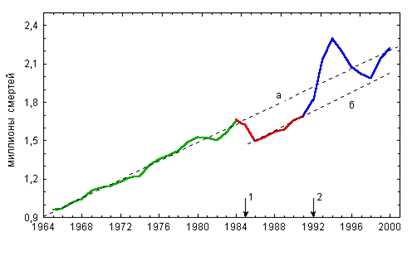
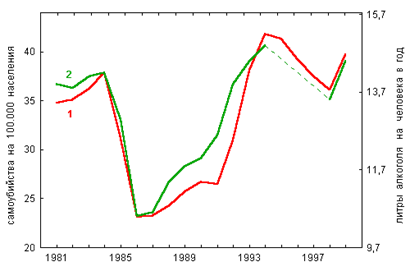
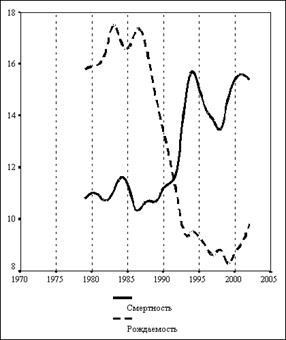
... оценивается экспертом как фактор, способствовавший наступлению смерти от основной причины, так как прием этилового алкоголя в значительных количествах провоцирует губительное обострение других заболеваний, особенно заболеваний сердечно-сосудистой системы человека. 4. Отравления суррогатами алкоголя В быту и на производстве используется большое количество технических жидкостей, которые по тем ...
... в состоянии продолжать жить, несмотря на указания совести о неправильности жизни…». На этом тезисе мы закончили предыдущую главу книги. Не развивая его, поскольку это не входит в достаточно узкую заявленную тематику оружия геноцида, обратимся к внутренним механизмам, которые включаются у людей после принятия психотропов. Мы знаем от чего люди убегают (от своей совести). Но за чем же люди гонятся? ...

0 комментариев