Московская Государственная Академия Приборостроения и Информатики.
ЦИНК.
Студент: Жариков С.А.
Факультет: ТИ-6
Преподаватель: Мосина Г.Н.
Москва 2001.
ОБЩИЕ СВЕДЕНИЯ.
Z=30
атомный вес = 65,37
валентность II
заряд 2+
массовые числа основных природных изотопов: 64, 66, 68, 67, 70
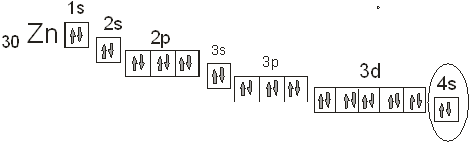
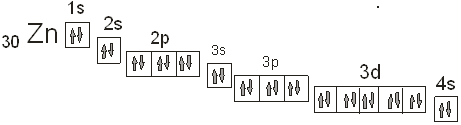
электронная структура атома цинка: KLM 4s2
| ¯ | ¯ | ¯ | ¯ | ¯ |
3d10
| ¯ |
4s2
ИСТОРИЧЕСКАЯ СПРАВКА.
С древних времён известны латуни, являющиеся сплавами Cu-Zn. Металлический цинк впервые получен в 1746 году в Англии нагреванием каламина с древесным углём.
РАСПРОСТРАНЕНИЕ В ПРИРОДЕ.
В природе цинк находиться только в виде соединений.
СФАЛЕРИТ (цинковая обманка, ZnS) имеет вид кубических жёлтых или коричневых кристаллов; плотность 3,9-4,2 г/см3 , твёрдость 3-4 по шкале Мооса. В качестве примесей содержит кадмий, индий, галлий, марганец, ртуть, германий, железо, медь, олово, свинец.
В кристаллической решётке сфалерита атомы цинка чередуются с атомами серы и наоборот. Атомы серы в решётке образуют кубическую упаковку. Атом цинка располагается в этих тетраэдрических пустотах.
ВЮРТЦИТ (ZnS) представляет собой коричнево-чёрные гексагональные кристаллы, плотностью 3,98 г/см3 и твердостью 3,5-4 по шкале Мооса. Обычно содержит цинка больше чем сфалерит. В решётке вюртцита каждый атом цинка тетраэдрически окружён четырьмя атомами серы и наоборот. Расположение слоёв вюртцита отличается от расположения слоёв сфалерита.
СМИТСОНИТ (цинковый шпат, ZnCO3) встречается в виде белых (зелёных, серых, коричневых в зависимости от примесей) тригональных кристаллов плотностью 4,3-4,5 г/см3 и твёрдостью 5 по шкале Мооса.
КАЛАМИН (Zn2SiO4*H2O*ZnCO3 или Zn4[Si2O7](OH)4*H2O*ZnCO3) представляет собой смесь карбоната и силиката цинка; образует белые (зелёные, синие, жёлтые, коричневые в зависимости от примесей) ромбические кристаллы плотностью 3,4-3,5 г/см3 и твёрдостью 4,5-5 по шкале Мооса.
ВИЛЛЕМИТ (Zn2SiO4) залегает в виде бесцветных или жёлто-коричневых ромбоэдрических кристаллов плотностью 3,89-4,18 г/см3 и твёрдостью 5-5,5 по шкале Мооса.
ЦИНКИТ (Zn O) - гексагональные кристаллы жёлтого, оранжевого или красного цвета с решёткой типа вюртцита и твёрдостью 4-4,5 по шкале Мооса.
ГАНИТ (Zn[Al2O4]) имеет вид тёмно-зелёных кристаллов плотностью 4-4,6 г/см3 и твёрдостью 7,5-8 по шкале Мооса.
Помимо приведённых, известны и другие минералы цинка:
монгеймит (Zn, Fe)CO3
гидроцикит ZnCO3*2Zn(OH)2
трустит (Zn, Mn)SiO4
гетеролит Zn[Mn2O4]
франклинит (Zn, Mn)[Fe2O4]
халькофанит (Mn, Zn) Mn2O5*2H2O
госларит ZnSO4*7H2O
цинкхальканит (Zn, Cu)SO4*5H2O
адамин Zn2(AsO4)OH
тарбуттит Zn2(PO4)OH
деклуазит (Zn, Cu)Pb(VO4)OH
леграндит Zn3(AsO4)2*3H2O
гопеит Zn3(PO4)*4H2O
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО ЦИНКА.
Цинк добывают из концентратов сфалерита, смитсонита и каламина.
Сульфидные полиметаллические руды, которые содержат пирит Fe2S, галеннит PbS,
халькопирит CuFeS2 и в меньшем количестве сфалерит после измельчения и размалывания подвергают обогащению сфалеритом методом селективной флотации. Если руда содержит магнетит, то для его удаления используют магнитный метод.
При прокаливании (700°) концентратов сульфида цинка в специальных печах, образуется ZnO, который служит для получения металлического цинка.
2ZnS+3O2=2ZnO+2SO2+221 ккал
Для превращения ZnS в ZnO измельчённые концентраты сфалерита предварительно нагревают в специальных печах горячим воздухом
Окись цинка также получают прокаливанием смитсонита при 300°.
Металлический цинк получают путём восстановления окиси цинка углеродом
ZnO+CÞZn+CO-57 ккал
водородом
ZnO+H2ÛZn+H2O
ферросилицием
ZnO+FeSiÞ2Zn+Fe+SiO2
метаном
2ZnO+CH4Þ2Zn+H2O+C
окисью углерода
ZnO+COÞZn+CO2
карбидом кальция
ZnO+CaC2ÞZn+CaS+C
Металлический цинк также можно получить сильным нагреванием ZnS с железом, с углеродом в присутствии CaO, с карбидом кальция
ZnS+CaC2ÞZn+CaS+C
ZnS+FeÛ2Zn+FeS
2ZnS+2CaO+7CÞZn+2CaC2+2CO+CS2
Металлургический процесс получения металлического цинка, применяемый в промышленном масштабе, заключается в восстановлении ZnO углеродом при нагревании. В результате этого процесса ZnO восстанавливается не полностью, теряется некоторое количество цинка, идущего на образование Zn[Al2O4], и получают загрязнённый цинк.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА.
Цинк - блестящий серебристый белый металл с плотностью 7,13 г/ см3 при 20° (тяжелый металл), температура плавления 419,44°, температура кипения 906°, твердость 2,5 - 2,9 по шкале Мооса. Имеет плотную гексагональную структуру кристаллов. Цинк становится при 100 - 150° и хрупким - выше 200°, он геомагнитен и имеет пять природных изотопов.
С химической точки зрения цинк менее активен, чем щелочные и щелочноземельные металлы, и более активен, чем олово, свинец, медь, ртуть, серебро, золото.
При сильном нагревании цинк воспламеняется и горит сине-зеленым пламенем.
Zn + 1/2 O2 = ZnO +83,5 ккал
Цинк окисляется кислородом воздуха при нагревании выше 225°, а в токе сухого кислорода выше 150°.
Металлический цинк не разлагает воду при комнатной температуре или кипячении, поскольку в присутствии воды поверхность цинка покрывается Zn(OH)2, который препятствует дальнейшему разрушению металла.
Цинк, нагретый почти до температуры плавления, энергично разлагает поры воды с образованием ZnO и H2.
Zn + H2O Û ZnO + H2
При комнатной температуре во влажном воздухе галогены образуют с цинком соответствующие гологениды. В сухом состоянии гологены взаимодействуют с металлическим цинком при высокой температуре.
Zn + F 2 = Zn F2 + 172,7 ккал
Zn + Cl2 = ZnCl2+99,55 ккал
Zn +Br2 =ZnBr2 +78,4 ккал
Zn + I2 = ZnI2 + 49,8 ккал
Нагревание порошкообразного цинка порошком серы приводит к образованию ZnS.
Zn + S = ZnS + 44 ккал
Под действием сероводорода поверхность металлического цинка покрывается плотной защитной плёнкой ZnS.
Zn+H2S Û ZnS + H2
Двуокись серы во влажной атмосфере и хлористый тионил взаимодействуют с цинком при нагревании.
3Zn + SO2 = ZnS + 2ZnO
Zn +SOCl2 = ZnCl2 + SO
Нагревание цинка в атмосфере аммиака дает нитрит Zn3N2.
Цинк непосредственно не вступает в реакцию с азотом, углеродом, водородом и другими элементами.
Обработка парами фосфора, нагретого до 440 - 780°, металлического цинка в атмосфере азота или водорода приводят к образованию Zn3P2 и ZnP2.
Поскольку нормальный потенциал системы Zn/ Zn2+ = -0,761 В, металлический цинк легко растворяется в кислотах и щелочах. При растворении цинка в разбавленных кислотах образуются соответствующие соли и водород.
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
Чистый металлический цинк медленно взаимодействует с разбавленными кислотами, поскольку образовавшийся атомарный водород покрывает поверхность цинка и выделение водорода уменьшается.
При образовании гальванического элемента Zn - Cu в соляной кислоте выделение водорода происходит очень интенсивно, и цинк легко растворяется, превращаясь в хлорид. Для образования гальванического элемента Zn - Cu в раствор соляной кислоты добавляют несколько капель сульфата меди. Медь, стоящая в электрохимическом ряду напряжений правее цинка, осаждается им, покрывает поверхность цинка и ускоряет, таким образом, растворение его в соляной кислоте.
По отношению к концентрированным серной и азотной кислотам цинк является восстановителем.
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 +3H2O
При действии щелочей на металлический цинк образуются гидроцинкаты и водород.
Zn + NaOH + 2H2O = Na2[Zn(OH4)] + H2
Цинк вытесняет менее активные металлы из растворов их солей и восстанавливает хромовую, марганцевую и молибденовую кислоты, соли железа (III) и олово (IV).
С помощью цинка можно осуществлять цинкотермическое разложение многих окислов, например: CdO, PbO, CuO, NiO.
Восстанавливая сероуглерод, цинковый порошок раскаляется.
С точки зрения физиологии цинк - необходимый элемент для живых организмов.
Цинк входит в состав фермента, имеющегося в красных кровяных тельцах (гемоглобин), с помощью которого происходит перенос двуокиси углерода в крови.
Для животных цинк загрязненный мышьяком, сурьмой, свинцом, кадмием становится токсичен. Вдыхание ZnCl2 в больших дозах смертельно.
ПРИМЕНЕНИЕ.
Во влажном воздухе поверхность цинка покрывается тонкой защитной пленкой окисла и основного карбоната, который в дальнейшем предохраняет металл от атмосферного действия атмосферных реагентов. Благодаря этому свойству цинк применяется для покрытия железных листов и проволоки. Также цинк применяется для извлечения серебра из серебросодержащего свинца по процессу Паркеса; для получения водорода в результате разложения соляной кислоты; для вытеснения металлов с более низкой химической активностью из растворов их солей; для изготовления гальванических элементов; в качестве восстановителя во многих химических реакциях; для получения многочисленных сплавов с медью, алюминием, магнием, свинцом, оловом и другими металлами.
Похожие работы
... ванны горячего цинкования. На некоторых заводах “цветы” получают иначе, - прижимая горячий оцинкованный лист к рифленому транспортеру. Демонстрационные опыты с цинком “Сатурново дерево” Реактивы. Водный (0,4-1%-ный) раствор ацетата свинца Pb(CH3COO)2, металлический цинк Zn в виде пластины или полосы размером 10150 мм, водный (30%-ный) раствор уксусной кислоты CH3COOH. Посуда и приборы ...
... железы, болезнями печени, плохим усвоением, недостатком этого минерала в воде, пище, а также слишком большим количеством фитина в продуктах питания, так как фитин «связывает» цинк, затрудняет его усвоение (кстати, нельзя принимать цинк вместе с селеном, так как два этих элемента взаимоисключают друг друга.). Если в пище слишком много белка, это тоже может быть причиной недостатка цинка в организме ...
... Также цинк может восстанавливать металлы менее активные чем он сам в нейтральной среде. Он восстанавливает металлы от хрома (-0,74 В) до серебра (0,79 В). Это его свойство часто используют для изготовления гальванических элементов. В щелочной среде цинк окисляется до иона , он также может восстанавливать водород из воды, восстанавливает многие неорганические соли, кислородные соединения. ...
... , что проявляется уменьшением содержания жира в печени. Цинк зависимыми являются такие жизненно важные гормоны, как инсулин, кортикотропин, соматотропин, гонадотропины. Цинк служит составной частью более 80 ферментов в организме человека, он необходим для образования эритроцитов и других форменных элементов крови. Цинк является важным компонентом ряда металлоферментов, таких как карбоангидраза, ...
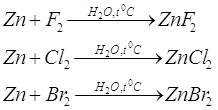

0 комментариев