Навигация
Анализ воды и форма его выражения
2.1. Анализ воды и форма его выражения
При оценке качества воды, предназначенной для удовлетворения хозяйственно – питьевых потребностей, обычно используется анализ ( тип 2 ), в процессе которого определяются : физические свойства ( температура, запах и вкус, прозрачность или мутность, цветность), Cl-, SО42-, НСО3-, СО32-, NO3-, Са2+,Мg2+, Fе2+, Fе3+, рН, СО2 ( свободная ), сухой остаток Р, NO2-, NН4+ и окисляемость. Анализ дает общую характеристику воды и производится в полустационарных или стационарных условиях. При этом можно контролировать анализ по сухому остатку с вычислением суммы К+ + Nа+ по разности.
В отдельных случаях ( главным образом для подземных вод ) может потребоваться подробный анализ с дополнительным определением Nа+, К+, Мn2+, Fе2О3 + АI2O3, SiO2, агрессивной СО2, Н2S. Этот вид анализа позволяет произвести общий контроль определений не только по сухому остатку, но и по суммам мг – экв анионов и катионов.
Наиболее распространенными формами выражения концентрации химических веществ являются объемная ( мг / л ) и нормальная ( мг – экв /л ) ; в более редких случаях концентрацию выражают в весовой ( мг / кг ) и молярной ( г – мол / л ) форме. В любом случае результаты анализа могут быть представлены в виде солей ( NаСl, Са SO4 и т.д. ), окислов ( Nа2О, СаО и т.д.), ангидридов (SO3, N2O5 и т. д.) или в ионной форме. Последняя форма наиболее полно отражает действительное состояние веществ, растворенных в воде, их диссоциацию, облегчает и ускоряет проверку анализа, и потому в настоящее время является общепринятой. Следует, однако, иметь в виду, что при этой форме выражения неионизированные или очень мало ионизированные соединения (чаще всего трехвалентного железа, алюминия, кремния) обозначаются в виде соответствующих окислов ( Fe2O3, Аl2O3, Si02 ), а растворенные неионизированные газы – всегда их формулами ( СО2, Н2S, О2 ).
При пересчете концентраций, выраженных в солевой или окисно – ангидридной форме, в ионную форму содержание соли, окисла или ангидрида умножают на отношение молекулярных весов данного иона и соответствующего ему соединения. Например, содержание Са2+ в исследуемой воде при окисной форме выражения анализа, т.е через СаО, оказалось равным [Са] = 100 мг / л. Молекулярные веса: Са = 40,08, СаО = 56,08. 40,08
Следовательно: [Cа2+] = ![]() = 71,5 мг / л.
= 71,5 мг / л.
В таблице 1 в качестве примера приведен химический анализ воды с определениями, выраженными в ионной и окисло – ангидридной формах записи.
Форма выражения химического состава воды.
Таблица 1.
| Ионная форма | Окисно – ангидридная форма | |||||||
| Наименование определений | Молекулярный или ионный вес | Эквивалентный вес | Концентрация | Наименование определений | Молекулярный вес | Концентрация в мг /л | ||
| в мг /л | в мг – экв / л | |||||||
| Сl- | 35,46 | 35,46 | 17,73 | 0,5 | Сl2 | 70,91 | 35,46 | |
| SO42- | 96,07 | 48,03 | 72,04 | 1.5 | SO3 | 80,07 | 60 | |
| НСО3- | 61,02 | 61,02 | 122,04 | 2 | СО2 | 44 | 88 | |
| СО3-2 | 60,01 | 30,01 | 0 | 0 | СО2 | 44 | 0 | |
| NО3- | 62,01 | 62,01 | 31 | 0,5 | N2O5 | 108 | 54 | |
| Са2+ | 40,08 | 20,04 | 60,12 | 3 | СаО | 56,08 | 84 | |
| Мg 2+ | 24,32 | 12,16 | 12,16 | 1 | МgO | 40,32 | 20,16 | |
| Fе 2+ | 55,85 | 27,93 | Следы | FеО | 71,81 | Следы | ||
| Fе3+ | 55,85 | 18,62 | не обнаружено | Fе2О3 | 159,7 | не обнаружено | ||
| рН | - | - | 7 | рН | - | 7 | ||
| СО2 ( свободная ) | 44 | 22 | 22 | 1 | СО2 (свободная ) | 44 | 22 | |
| Сухой остаток | - | - | 300 | 300 мг /л | Сухой остаток | - | 300 | |
| NO2- | 46 | 46 | следы | NO3 | 76 | следы | ||
| NН4+ | 18,03 | 18.03 | не обнаружено | NН3 | 17.03 | не обнаруженно | ||
| окисляемость | - | - | 18 | 18 мг /л | окисляемость | - | 18 | |
| Для пересчета концентрации Со, выраженных в мг /л, в СЭ (мг – экв/л) используется соотношение
Где Э – эквивалент на вес данного вещества Решающим показателем санитарного состояния воды является титр кишечной палочки (коли титр или коли индекс). Дополнительной характеристикой бактериальной загрязнённости служит число зародышей в одном литре исследуемой воды. | ||||||||
| 2.2. Проверка результатов анализа. Приступая к изучению анализов воды, необходимо прежде всего убедиться в их правильности. Правильность определения физических свойств (температуры. цветности, мутности или прозрачности, запаха и вкуса) может быть проверена только при поммощи повторных определений в аналогичных условиях; поэтому проектировщик, как правило, должен иметь серии анализов для одних и тех же точек и условий отбора. При количественной оценке мутности воды следует помнить, что этот показатель имеет наибольшую ценность при сравнении проб, но дает лишь приближенное представление о фактическом содержании взвешенных веществ. Последние для расчетных грязевых нагрузок должны быть определены весовым способом. Для контроля химического анализа сравнивают суммарное количество всех нелетучих составных частей, определенных анализов, с величиной сухого остатка. Естественно, что из –за неточностей в определениях всегда будет наблюдаться разница в сравниваемых величинах. Но, как правило, вес сухого остатка оказывается не более чем на 7 – 12 % выше суммы ионов солей. Такового рода контроль исключает возможность появления ошибки в анализе, а в отдельных случаях указывает на необходимость дополнительных определений. Не следует забывать, что при вычислении суммы ионов солей нужно брать только половину найденного анализом содержания НСО3-. Сумма всех нелетучих в мг / л по анализу определяется из выражения Р = Сl- + SO4-2 + ½ НСО3-2 + Са2+ +Мg2+ + Nа+ ( 2 )
Величину Nа+ находят по разности содержания отрицательных и положительных ионов. При нормальной форме выражения концентрации ( в мг – экв /л ) имеем
где К+ + Na+ - определяемое по разности содержание калия и натрия в мг – экв/л; | ||||||||
Σа – сумма мг – экв анионов ;
ΣКОПР– сумма мг – экв катионов, включенных в анализ.
Сумму щелочных ионов К+ + Nа+, выраженную в мг – экв/л, пересчитывают в мг /л по эквивалентному весу Nа+, равному 23, и вводят в формулу ( 2 ). Такой пересчет приводит к сравнительно небольшой ошибке, обычно не превышающей 1,6 % суммы всех составных частей общего солесодержания ( содержание К+ + Nа+ в общей сумме ионов, так же как и К в сумме К+ + Nа+, составляет не более 20 % ).
Кроме общего контроля анализа по сухому остатку следует сопоставить результаты некоторых отдельных определений.
1) Содержание в воде СО3-2, НСО3- и свободной СО2 сопоставляют с величиной рН. Зависимость между этими величинами применительно к открытым источникам, не содержащим СО3-2, с температурой природной воды 22С, определяют из формулы рН = 6,37 – lgCco2 + lgCнсо3- +lgf(1) , ( 4 ).
где Ссо2 – концентрация свободной углекислоты в мг / л ;
Снсо3 – концентрация НСО3- в мг /л ;
f(1) – коэффициент активности НСО3-.
Использование номограммы ( рис 1.2, существенно облегчает проверку определения СО2, НСО3- и рН. Например, по таблице 1 при [CO2 ] = 22 мг /л щелочность определяемая концентрацией НСО3, равна 2 мг /л ; для этих значений по номограмме ( при t = 20С ) имеем, что рН такой воды должно быть равно 6,9. Прямое определение показало, что рН = 7. Таким образом, отклонение составляет 0,1. Допустимая разница не должна превышать 0,2. Следовательно, аналитические определения СО2, НСО3 и рН проведены правильно.
Если в воде кроме НСО3- и СО2 находятся анионы других слабых кислот ( НSiO3-, НS-, Н2РО4-, органических ) или анионы СО3, а также при наличии только СО2 ( тогда рН <4 ), изложенная методика неприемлема.
2) Если в результате анализа обнаружена высокая окисляемость воды, то нужно проверить, не связано ли это с повышенным содержанием легкоокисляющихся закисного железа или сероводорода. Наличие сероводорода требует дополнительного количественного определения Н2S.
Высокая окисляемость при повышенном содержании Сl- и при наличии NН2- и NН4+ , сопровождаемая бактериальным загрязнением, определенно говорит о санитарной недоброкачественности воды, связанной с бытовыми стоками.
Например, сопоставление окисляемости воды в анализе из таблицы 1 с содержанием Сl-, NО2- и NН4+ говорит о благополучном санитарном состоянии воды: нормальные концентрации Сl-, SO42-, сочетаются с отсутствием ионов азотистой кислоты и аммиака. Если бы окисляемость была повышенной ( например, 50 – 100 мг /л О2 ), то при тех же показателях химического анализа можно было бы судить о вероятно высокой цветности воды за счет содержания в ней органических гуминовых кислот или же ( применительно к подземным водам ) о возможном наличии сероводорода.
3) При отдельном определении общей жесткости воды дополнение следует сопоставить ее величину, полученную экспериментально, с суммой Са2+ + Мg2+. Так же нужно сопоставить значения карбонатной и устранимой жесткостей, если последняя дается в анализе. Устранимая жесткость, как правило, меньше карбонатной ( численно равной содержанию НСО3- ) на 0,3 – 0,6 мг – экв / л, а при высокой степени минерализации воды – и более.
Если в распоряжении проектировщика имеется полный анализ воды с определением содержания всех ионов, включая К+ и Nа+, то основной проверкой правильности анализа является сопоставление сумм мг – экв катионов и анионов ; при этом
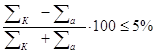 ( 5 )
( 5 )
Похожие работы
... воды в районе г. Сургута в летний период составлял 411 см, а в 1998 г. — 465 см, то общая минерализация — соответственно 152,7 и 130,6 мг/дм3. Общая сумма ионов в воде р. Оби на 20-25 % выше на границе Тюменской области, после впадения р. Вах, притоков в районе г. Сургута; общая минерализация снижается до 105-125 мг/дм3 в районе поселков Белогорье, Перегребное, Казым-Мыс(табл. 1). Таблица 1 ...
... the ecology of the lakes. The results of research entered into the database of ecological condition of reservoirs of Saint-Petersburg area. Суздальские озера находятся в черте города Санкт - Петербурга и являются излюбленным местом отдыха горожан, в связи с чем к качеству воды в этих озерах предъявляются повышенные требования. Нами было проведено исследование воды этих озер на содержание в ней ...
... - мощность ("глубина") безнапорного потока в ненарушенном состоянии и в точке работающей скважины (соответственно), а понижение уровней , получим после простых преобразований: , . Моделирование приречных водозаборов применяется, как правило, для относительно крупных месторождений со сложной геометрией речных контуров и других граничных условий, при существенной неоднородности параметров ...
... организмов в качестве биологического индикатора имеет свои преимущества и недостатки, которые определяют границы ее использования при решении задач биоиндикации. Водорослям принадлежит ведущая роль в индикации изменения качества воды в результате эвтрофирования (заболачивания) водоема. Зоопланктон также достаточно показателен как индикатор эвтрофирования и загрязнения (в частности органического и ...
0 комментариев