Навигация
2. Введение.
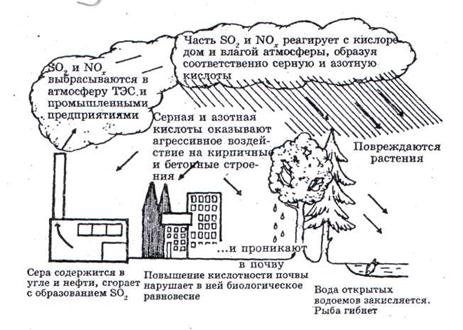
Загрязнение окружающей среды свинцом и его соединениями является для России наиболее острым и опасным. Свинец поставляет цветная металлургия, в том числе 94 % этого металла выбрасывается в атмосферу 5 предприятиями. Это Среднеуральский медеплавильный завод, АО “Святогор” – Красноуральский медеплавильный завод, Кировоградский медеплавильный комбинат, АО "Динополиметалл", завод "Электроцинк". Как видим, главные отравители воздуха свинцом находятся на территории Свердловской области, и эти предприятия привносят в атмосферу России 68,7 % всех свинцовых выбросов.
Однако, основным источником загрязнения атмосферного воздуха свинцом в РФ является автотранспорт, использующий свинецсодержащий бензин. автомобильный парк выбрасывает ежегодно в атмосферу 10 млрд. абсолютно смертельных доз свинца или в весовых единицах 250 килотонн металла. Так общее количество свинца, выбрасываемое в воздух в результате сгорания топлива в двигателях, в 1997 году составляло 301 килотонну, или примерно две-три смертельные дозы на человека в год.
Не малую роль в загрязнении свинцом играют отработанные аккумуляторы, отравляющие почву и воду соединениями свинца.
Столь масштабное загрязнение окружающей среды доказывает немаловажный факт: воды рек выносят в год 17-18 тыс. т. свинца, что примерно в 200 раз меньше количества выплавляемого металла.
Свинец влияет на нервную систему человека, что приводит к снижению интеллекта, вызывает изменение физической активности, координации слуха, воздействует на сердечно-сосудистую систему, приводя к заболеванию сердца. Это оказывает негативное влияние на состояние здоровья населения и в первую очередь детей, которые наиболее восприимчивы к свинцовым отравлениям.
В России постепенно увеличивается численность людей, имеющих профессиональный контакт со свинцом. Случаи хронической свинцовой интоксикации зафиксированы в 14 отраслях промышленности.
Среди профессиональных интоксикаций свинцовая занимает первое место, причем имеет место тенденция к её увеличению. Среди рабочих, пострадавших от воздействия свинца, около 40 % составляют женщины. Для них свинец представляет особую опасность, так как этот элемент обладает способностью проникать через плаценту и накапливаться в грудном молоке. Как правило, наиболее высокая концентрация свинца в атмосферном воздухе наблюдается в зимний период, что связано с дополнительными выбросами в атмосферу продуктов сжигания топлива. Неблагоприятные метеорологические условия в этот период года также способствуют накоплению свинца в нижних слоях атмосферы.
В нашем городе эта тема наиболее актуальна, так как автомобильный парк города с каждым годом увеличивается, следовательно увеличивается и количество свинца в окружающем воздухе и почве.
Цель моей работы изучить основные источники загрязнения окружающей среды свинцом, и влияние элемента на живую природу.
Я перед собой поставила следующие задачи:
Рассмотреть накопление свинца в природе, как загрязнителя окружающей среды;
Изучить некоторые продукты сгорания бензинов и их влияние на здоровье человека;
Определить роль химического источника тока в технике и экологии;
Освоить методику определения оксида углерода (II) в выхлопных газах автомобилей с помощью газоанализатора "Infralit 2 T";
Сформулировать рекомендации по защите окружающей среды от вредного влияния ионов свинца.
3. Свинец (82207,2Pb)
3.1. Распространение в природе.
Почвы 1-10 мг/кгПоверхностные воды 1-60 мкг/л
Морская вода 0,01-0,05 мкг/л
Атмосфера 0,0006 мкг/м3
3.2. Физические свойства.
Свинец – пластичный, мягкий металл. Температура плавления +327,40С, температура кипения +17250С, плотность – 11,34 г/см3, цвет – синевато-серый. Хорошо поддаётся литью, ковке, пайке и прокатке.
3.3. Химические свойства.
На воздухе свинец быстро покрывается тонким слоем оксида, защищающего его от дальнейшего окисления. Вода сама по себе не взаимодействует со свинцом, но в присутствии воздуха свинец постепенно разрушается водой с образованием гидроксида свинца (II):
2Pb+O2+2H2O=2Pb(OH)2
Однако при соприкосновении с жесткой водой свинец покрывается защитной пленкой нерастворимых солей (главным образом сульфата и основного карбоната свинца), препятствующего дальнейшему действию воды и образованию гидроксида. При нагревании свинец взаимодействует с большинством неметаллов:
Pb+Cl2=t=PbCl2
Так же, при высокой температуре свинец взаимодействует с водными растворами щелочей:
Pb0+4KOH+2H2O=K4[Pb+2(OH)6]+H2
Таблица 1. Растворимость свинца в некоторых веществах.
| Pb | HCl разб. | H2SO4 Разб. | H2SO4 концентр. | HNO3 | CH3COOH | Щелочи |
| Почти не Растворяется | Интенсивно Растворяется Pb+2H2SO4= =PbSO4+ +2H2O+ SO2 | Растворяется легко 3Pb+8HNO3= 3Pb(NO3)2+ +2NO+ +4H2O | Сравнительно легко растворяется Pb+2CH3COOH= =Pb(CH3COO)2+H2 | Растворяется, но с неболь. скоростью Pb+4KOH+2H2O= K4[Pb(OH)6]+H2 | ||
Для свинца характерны степени окисления +2 и +4. Значительно устойчивы и многочисленны соединения со степенью окисления свинца +2. Перевод Pb(II) в Pb(IV) возможен лишь при электролитическом окислении или действием наиболее сильных окислителей (Cl2, белильная известь и др.) при нагревании в щелочной среде. Например:
Pb(CH3COO)2+Cl2+4KOH=PbO2+2KCl+3KCH3COO+2H2O
Соединение свинца (IV) легко переходят в соединения свинца (II), следовательно соединение свинца (IV) являются сильными окислителями.
Таблица 2. Некоторые соединения свинца.
| Формула | PbO | Pb(OH)2 | PbCl2 | PbI2 | PbO2 |
| Получение | Нагревание расплавленного Pb на воздухе | Действие на расторимые соли Pb(II) | Действие HCl или раствор. Хлоридами на растворы солей Pb(II) | Выпадает из растворов солей Pb(II) | Действие сильных окислителей на оксид или соли Pb(II) |
| Применение | Аккумулятор, производство глазури, олиф, хрусталя, получение др. соединений Pb | Получение свинцовых белил | Получение др. соединений свинца | Окислитель в химической промышленности | |
| Формула | Pb(CH3COO)2 | PbSO4 | PbS | Pb(C2H5)4 | |
| Получение | Растворение Pb в уксусной кислоте | H2SO4 или растворимый сульфат+ соль Pb(II) | Действие сероводорода на соли Pb(II) | Взаимодействие Na4Pb с монохлорэтаном | |
| Применение | Обнаружение H2S, крашение тканей, получение др. соединений Pb | Получение др. соединений Pb | Обнаружение Pb | Антидетонатор | |
Все растворимые соединения свинца ядовиты. Соли, отвечающие несуществующей в свободном состоянии свинцовой кислоте H2PbO3, называются плюмбатами. Например, при сплавлении диоксида свинца с оксидом кальция образуется плюмбат кальция CaPbO3:
CaO+PbO2=CaPbO3
При сплавлении Pb(OH)2 с сухими щелочами получаются соли, называемые плюмбитами:
Pb(OH)2+2NaOH=Na2PbO2+2H2O
Похожие работы
... поведении в природе, в сознании фиксируется отрицательное отношение к флоре и фауне. Это ни в какой мере не учитывает особенности детей дошкольного и младшего школьного возраста: эмоциональной восприимчивости, подражательности, непосредственности поведения. Многие выпускники начальной школы были беспомощны, когда требовалось оказание помощи, проявление заботы, внимания к объекту. Даже если дети ...
... продолжают обустройство нефтяных месторождений по временным схемам - без пунктов сбора, подготовки и транспорта нефтяного газа. На базе Пермского межотраслевого научно-исследовательского института экологии топливно-энергетического комплекса сформирован специализированный Центр по борьбе с разливами нефти, создаются подобные службы и на нефтегазовых предприятиях. Но говорить о развитой система ...
... и ее ресурсами. Таким образом, экология является мировоззренческой, синтетической областью знаний, интегрирующей естественнонаучные и гуманитарные знания. Стратегической задачей экологии является развитие теории взаимодействия природы и общества на основе нового взгляда, рассматривающего человеческое общество как неотъемлемую часть биосферы. 2. Среды жизни, экологические факторы Все ...
... Почва, город, экология /под ред. академика РАН Добровольского/. М.: Фонд «За экономическую грамотность», 1997. 29. Салеева Л.П. Содержание экологического образования // Биология в школе, 1987. №3. 30. Ситаров В.А., Пустовойтов В.В. Социальная экология: Учебное пособие для студентов высш. пед. учебн. заведений/. М.: Издательский центр «Академия», 2000. 280 с. 31. Социально- ...

0 комментариев