Навигация
Как в захвате, так и завершении фагоцитоза роль фракции более существенна в макрофагах морских свинок
3. Как в захвате, так и завершении фагоцитоза роль фракции более существенна в макрофагах морских свинок.
ВЛИЯНИЕ МОДИФИКАТОРОВ БИОЛОГИЧЕСКОГО ОТВЕТА ПРИРОДНОГО
ПРОИСХОЖДЕНИЯ НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ МАКРОФАГОВ
(ОНКОЛОГИЧЕСКИЙ АСПЕКТ)
Несмотря на значительные успехи химиотерапии некоторых видов злокачественных новообразований, результаты применения противоопухолевых химиопрепаратов при наиболее распространенных локализациях рака остаются малоудовлетворительными. Становится все более очевидным, что одним из основных препятствий для успешной химиотерапии злокачественных опухолей является гетерогенность популяции неопластических клеток, которая выражается, в частности, в наличии в ней клонов клеток, резистентных к химиотерапевтиче-ским агентам. Более того, такая резистентность может относиться к целым классам препаратов, что может ограничивать эффективность и комплексной полихимиотерапии. Еще более осложняет положение генетическая нестабильность опухолевых клеток, которые, имея высокий уровень спонтанных мутаций, чрезвычайно легко подвергаются мутагенному воздействию химиопрепаратов и продуктов их метаболизма. Это в значительной мере усиливает гетерогенность опухолевой популяции, способствует генерации еще большего числа резистентных к химиотерапии клонов, усиливает их способность к метастизированию, рецидиву на фоне продолжающейся химиотерапии.
В конечном счете даже весьма радикальная (на 99,5 %) редукция опухолевой массы в процессе химиотерапии почти неизбежно приводит к возобновлению процесса за счет резистентных клонов — предшествовавших или возникших в процессе химиотерапии. Более того, такие клоны оказываются в далеко зашедшей стадии опухолевой прогрессии и, следовательно, более злокачественными.
В этих условиях вполне закономерными представляются поиски путей элиминации опухолевых клеток с так называемой множественной лекарственной устойчивостью с помощью других механизмов, в частности литического потенциала иммунокомпетентных клеток. Особый интерес в этом отношении представляют макрофаги. В отличие от других типов иммуноцитов их активность в меньшей степени подавляется в процессе интенсивной циторедуктивной терапии, они способны к эффективным противоопухолевым реакциям в соотношении эффектор/мишень, приближающемся к 1:1 и, инфильтрируя опухолевую строму, имеют достаточную возможность для контакта с опухолевой клеткой. Показана возможность активации цитолитического действия макрофагов с помощью различных модификаторов биологического ответа (МБО) после воздействия противоопухолевых химиопрепаратов, в то время как активность других эффекторных систем может быть существенно подавлена. Поэтому в настоящее время идет активная разработка методов адъювантной иммунотерапии с включением активаторов макрофагов. При этом предварительная оценка эффекта последних проводится in vitro и в основном по способности индуцировать цитолитическую и цитостатическую активность. По сохранению такой способности в процессе применения химиотерапевтических противоопухолевых препаратов оценивается и «совместимость» МБО с ними. Однако индукция цитотоксичности является только одной стороной активации макрофагов, под влиянием МБО происходят другие значительные изменения функциональной активности этих клеток, в частности усиливается продукция и секреция целого ряда ростовых факторов. В рамках такого подхода было изучено влияние БЦЖ и циклофосфамида на перитонеальные макрофаги мышей. Названные препараты выбраны как модельные в виду их достаточной изученности как индукторов противоопухолевой активности макрофагов in vitro и in vivo, а также достаточно широкого применения в клинической практике.
Известно, что цитотоксическая активность макрофагов in vitro достигает своего максимума к 48—72 ч культивирования, а затем быстро снижается. Была проведена оценка ростстимулирующей активности резидентных и БЦЖ-активированных макрофагов в процессе культивирования in vitro.
Установлено, что способность поддерживать рост опухолевых клеток прогрессивно снижается у резидентных макрофагов и нарастает у БЦЖ-активированных. Если в первые 3 дня прирост числа клеток на БЦЖ-активированных макрофагах достоверно ниже, чем на резидентных (что может быть объяснено цитотоксической активностью), то затем наблюдается противоположная ситуация.
Таким образом, если индуцированная БЦЖ-активация противоопухолевой активности макрофагов носит преходящий характер, то активация продукции ростовых факторов более устойчива во времени. Более того, при тестировании цитотоксической и ростстимулирующей активности макрофагов, выделяемых из перитонеальной полости мышей в различные сроки после введения БЦЖ, было выявлено, что цитотоксическая активность (цитолитическая и цитостатическая) максимальна на 10-й день. На 15-й и 20-й дни проявляется только цитолитическая, а цитостатическая активность исчезает. Ростстимулирующая активность максимальна на 15-й и 20-й дни. Следовательно, in vitro активация макрофагов БЦЖ приводит к транзиторной экспрессии противоопухолевой активности и длительной устойчивой ростстимулирующей активности.
С учетом этих данных становится понятным характер взаимодействия БЦЖ-активированных макрофагов и опухолевых клеток в процессе длительного ко-культивирования in vitro: в первые дни за счет цитотоксичности значительно снижается количество жизнеспособных клеток, одновременно цитостатические факторы тормозят их пролиферацию, но затем благодаря выделяемым ростовым факторам интенсивность пролиферации выживших опухолевых клеток значительно превышает таковую у резидентных макрофагов, в результате чего их общее количество достигает и даже превышает исходный уровень.
В ряде случаев при культивировании малых доз опухолевых клеток — до 10 на лунку (т. е. в соотношении эффектор/мишень 5000:1) — цитотоксической активности может быть достаточно для элиминации всей опухолевой популяции, однако в тех случаях, когда ростовая фракция превысит определенный порог цитотоксической активности, наблюдается интенсивный рост оставшихся опухолевых клеток. Именно это объясняет отсутствие достоверности результатов культивирования малых доз клеток, так как отклонения от средней величины отличались большей амплитудой.
Таким образом, способность макрофагов, активированных БЦЖ, контролировать рост опухолевых клеток in vitro ограничена и проявляется только в соотношениях эффектор/мишень, весьма далеких от реально возможного in vivo,— 500:1 — 5000:1. При этом противоопухолевая активность транзиторна, а опухольстимулирующая носит более длительный и устойчивый характер. Поэтому была предпринята попытка потенцировать противоопухолевую активность БЦЖ-активированных макрофагов путем воздействия на них циклофосфамидом. По данным литературы, этот противоопухолевый препарат является вполне «совместимым» с БЦЖ-агентом (т. е. стимулирует БЦЖ-индуцированную цитотоксичность) и, следовательно, может быть компонентом комбинированной химиоиммунотерапии на основе применения БЦЖ .
Циклофосфамид вводили мышам внутрибрюшинно в дозе 200 мг/кг, за 9 дней до того получивших также внутрибрюшинно 1 мг БЦЖ. На следующий день перитонеальные клетки выделяли и оценивали их цитотоксическую активность, способность поддерживать рост опухолевых клеток в субоптимальных концентрациях и влиять на рост автономно растущей опухолевой популяции в условиях ко-культивирования. Оказалось, что циклофосфамид самостоятельно индуцировал существенную цитолитическую и цитостатиче-скую активности, кроме того, достоверно усиливал БЦЖ-индуцированную цитотоксичность.. При этом в присутствии макрофагов, активированных комбинацией БЦЖ с циклофосфамидом, уровень пролиферации опухолевых клеток в зависимых от ростовых факторов концентрациях (102 клеток на лунку) был 2,9'104±3,25-103 и значительно превышал таковой при культивировании опухолевых клеток на БЦЖ-активированных макрофагах — 3,7-103±1,4-102, практически не отличаясь от их роста в присутствии нестимулированных макрофагов — 3,2-104±4,82-103.
Таким образом, несмотря на весьма высокий уровень цитотоксичности макрофагов, индуцированный их обработкой вслед за БЦЖ еще и циклофосфамидом, такие макрофаги теряли способность даже к ограниченному контролю ко-куль-тивируемой с ними популяции опухолевых клеток.
С учетом весьма значительной в этой серии экспериментов потери клеток под влиянием факторов цитотоксичности (в отдельных опытах цитолитическая активность достигала 70 %) и прироста клеток, сравнимого с таковым после ко-культивирования на резидентных макрофагах, можно считать, что совместное применение БЦЖ и циклофосфамида оказывает аддитивное действие на продукцию ростовых факторов макрофагами.
Таким образом, имеющиеся в литературе данные о совместимости БЦЖ и циклофосфамида, будучи совершенно справедливыми в отношении противоопухолевой активности активированных макрофагов, не отражают возможного конечного результата такого совмещения, явно нежелательного с клинической точки зрения. Следует отметить, что характер ответа макрофагов на активацию МБО in vivo имеет сходство с таковым in vitro. Как показано еще в первых работах по применению БЦЖ, иммунотерапия этим препаратом эффективна только в течение короткого срока, а затем происходит стимуляция опухолевого процесса, причем противоопухолевую активность макрофагов, достаточно быстро угасающую как in vitro, так и in vivo, как правило, не удается восстановить повторными введениями препарата, ее вызвавшего, и в случае успеха такая реактивация кратковременна.
Данные литературы достаточно однозначно указывают на отсутствие корреляции между цитотоксической активностью БЦЖ-активированных макрофагов in vitro и их влиянием на опухолевые клетки in.vivo. Если исходить из представленных нами данных, это становится вполне объяснимым: уничтожение in vitro даже большинства опухолевых клеток при последующем стимулировании роста оставшихся приводит к явному нивелированию эффекта цитолитического действия, особенно если учесть его относительную кратковременность по сравнению с ростстимулирующим действием. Кроме того, выявляемая in vitro цито-статистическая активность зависит от таких факторов, как аргиназа, истощение культуральной среды ввиду повышенного метаболизма активированных макрофагов, продукция токсических радикалов, атомарного кислорода и др. В условиях in vivo эти эффекты могут не проявляться в связи с притоком аргинина, других питательных веществ к клеткам, наличием антагонистов радикалов и т. д.
Как известно, при опухолевом процессе макрофаги способствуют развитию опухоли на «органном» уровне путем улучшения микроокружения (имеется в виду стимуляция ангиогенеза, формирование стромы опухоли, элиминация продуктов распада опухолевых клеток). Продуцируемые макрофагами иммуносупрессивные факторы, в частности простагландин Е2, способны инактивировать другие иммунологические механизмы рези-стентности к опухолевому росту. Такие факторы, как интерлейкин-1 (ИЛ-1), фактор некроза опухоли (ФНО), выделяемые активированными макрофагами, способны подавлять пролиферацию большей части известных линий опухолевых клеток, однако они являются и стимуляторами роста некоторых из них .
Учитывая высокую степень гетерогенности опухолевой популяции и усиление роста таковой под влиянием продуктов активированных макрофагов, нельзя исключить появления устойчивых и даже зависимых от ФНО и ИЛ-2 клонов. И если в относительно непродолжительных до времени сроках взаимодействия макрофагов и опухолевых клеток в условиях экспериментальных моделей такие эффекты не проявятся, то в реальных условиях вероятностью такого отбора пренебрегать нельзя. Это особенно актуально, если учитывать, что макрофаги практически неизбежно вовлекаются в реализацию любого иммунотерапевтического воздействия, поэтому продемонстрированные здесь негативные последствия их активации могут сказаться и на эффективности всей программы иммунотерапии, направленной изначально на другие эффекторы иммунной системы.
Таким образом, продукция макрофагами факторов, стимулирующих рост опухолевых клеток, является весьма существенным компонентом ответа этих клеток на МБО. Соответственно при оценке и отборе потенциальных МБО необходимо оценивать не только их способность к индукции противоопухолевых реакций, но и возможность экспрессии побочной ростстимулирующей активности. Только углубленное изучение этого вопроса., направленного на выявление факторов, стимулирующих рост опухолевых клеток, путей их биосинтеза в макрофагах и их регуляцию, может лечь в основу разработки методов селективного подавления нежелательных в онкологической ситуации ростстимулирующих свойств активированных МБО макрофагов при одновременной сохранности и активации их противоопухолевой активности.
ПЕРИТОНЕАЛЬНЫЕ МАКРОФАГИ КАК МОДЕЛЬ ДЛЯ ИЗУЧЕНИЯ АТЕРОГЕННОГО
ПОТЕНЦИАЛА СЫВОРОТКИ КРОВИ
Накопление липидов в гладкомышечных клетках (ГМК) и макрофагах интимы аорты является характерной чертой атеросклероза человека и экспериментальных животных. Было показано, что сыворотки крови больных ишемической болезнью сердца (ИБС) с ангиографи-чески подтвержденным коронарным атеросклерозом в отличие от сывороток крови здоровых лиц обладают способностью вызывать накопление липидов в культивируемых клетках интимы аорты человека. Это свойство было названо атерогенностью, поскольку накопление липидов сопровождалось другими атеросклеротическими проявлениями на клеточном уровне — усилением пролиферативной активности и синтеза внеклеточного матрикса. Однако связь между атерогенностью и атеросклерозом окончательно не выяснена.
Исследования по этой проблеме основаны на первичном культивировании субэндотелиальных клеток интимы аорты человека. Сложность работы обусловлена необходимостью постоянного обеспечения стерильным аутопсийным материалом, а также высокой стоимостью выделения и культивирования клеток.
Ранее было показано, что способностью аккумулировать внутриклеточно холестерин при культивировании с атерогенной сывороткой обладают ГМК аорты человека и мононуклеарные клетки периферической крови. Эти данные позволяют считать, что для определения атеро-генности сыворотки крови могут быть использованы не только субэндотелиальные клетки интимы аорты.
Целью работы было определение возможности использования легкодоступных перитонеальных макрофагов для определения атерогенности сыворотки крови.
Кровь для исследований бы взята у больных ИБС, подтвержденной при коронарной ангиографии, и здоровых доноров. ГМК были выделены из аорты мужчин, взятой в асептических условиях спустя 24 ч после внезапной смерти, ступившей от инфаркта миокарда. Человеческие перитонеальные макрофаги были выделены из асцитической жидкости больных недостаточностью кровообращения. Мышиные перитонеальные МФ получены от нестимулированных мышей.
Влияние сыворотки крови здоровых доноров и больных ИБС на уровень холестерина в клетках
| Тип клеток | Контроль, мкг | Уровень холестерина в клетках, % контрольных величин | |
| на 1 мг белка | здоровые доноры | больные ИБС | |
ГМК:
интимы аорты
59±5 110±7 370±43
67±4 118±13 179±10
32±3 95±8 264±31
44±4 108±3 284±28
медии аортыМышиные макрофаги
Человеческие макрофаги
В таблице приведено содержание общего холестерина в ГМК интимы и медии аорты человека, в перитонеальных мышиных и человеческих макрофагах, инкубированных 24 ч в присутствии 20 % сывороток крови здоровых доноров и больных ИБС. Видно, что инкубация клеток в 20 % сыворотке крови здоровых доноров не приводит к статистически значимому повышению уровня холестерина в клетках, а инкубация в 20 % сыворотке крови больных ИБС вызывает достоверное повышение содержания внутриклеточного холестерина как в ГМК, так и в перитонеальных макрофагах. Таким образом, так же, как ГМК интимы и медии аорты, перитонеальные макрофаги мышей и человека могут быть использованы для оценки атерогенного потенциала сыворотки крови. Кроме того, накопление холестерина в макрофагах происходит в 1,5—2,5 раза быстрее, чем в ГМК. Оба эти факта, а также более легкий способ получения культуры макрофагов позволяют считать, что эти клетки могут быть использованы для оценки атерогенного потенциала сыворотки крови значительно чаще, чем ГМК.
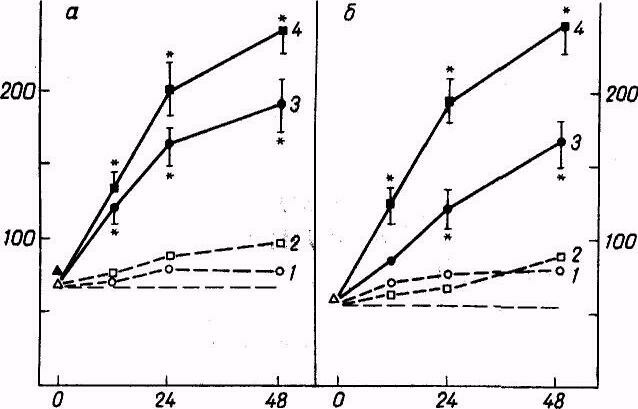
При культивировании мышиных, человеческих макрофагов и ГМК с 10 атерогенными и 10 неатерогенными сыворотками крови установлена прямая корреляционная связь между аккумуляцией холестерина в макрофагах и в ГМК интимы аорты. Кроме того, аккумуляция холестерина в человеческих и мышиных макрофагах находится в прямой зависимости от концентрации сыворотки (рис 1) и времени культивирования (рис 1А). При культивировании макрофагов с сывороткой здоровых лиц такого эффекта не выявлено.
Во время инкубации человеческих и мышиных макрофагов с сыворотками крови больных ИБС выявлено повышение содержания в клетке свободного холестерина и триглицеридов в 1,5— 2 раза, эфиров холестерина в 2,5—3 раза. При этом. уровень фосфолипидов не изменялся.
В группе здоровых доноров только у 22 (28 %) из 80 человек сыворотки крови вызывали аккумуляцию холестерина в культуре клеток. В группе больных ИБС у 83 % человек сыворотки крови вызывали достоверное повышение уровня общего холестерина в макрофагах, т. е. обладали атерогенными свойствами.
Не выявлено корреляции между атерогенностью крови больных ИБС и содержанием в сыворотке общего холестерина, триглицеридов, апо-А1, апо-В и ХС ЛПВП.
Полученные данные свидетельствуют о наличии прямой корреляции между аккумуляцией липидов в ГМК и макрофагах, а также о том, что способность выявлять атерогенность сыворотки крови. При использовании перитонеальных макрофагов не отличается от данных, полученных ранее при использовании ГМК интимы аорты. Во время культивирования перитонеальные макрофаги аккумулируют свободный и эстерифицированный холестерин, триглицериды, т. е. те же липиды, которые при инкубации включают в себя ГМК интимы аорты. Использование ГМК затруднено из-за сложностей получения асептического материала в достаточном для работы объеме. Человеческие и особенно мышиные макрофаги лишены этих недостатков. Эти факты доказывают, что культура перитонеальных макрофагов вместе с культурой ГМК интимы аорты может быть использована как тест-система для оценки атерогенного потенциала сыворотки крови.
Макрофаги, возможно, являются одним из главных клеточных акцепторов липидов в сосудистой стенке. Давно уже было показано наличие макрофагов, насыщенных липидами, в атеросклеротических бляшках. Экспериментальные работы, в которых использовалась культура клеток, выявили способность макрофагов интенсивно накапливать эфиры холестерина при инкубации с химически модифицированными липопротеидами.
Использование культуры макрофагов позволит продолжить изучение природы атерогенности сыворотки крови больных ИБС и ее роли в патогенезе атеросклероза.
Рис. 1 Связь между накоплением холестерина в клетках и концентрацией сыворотки
По оси абсцисс — концентрация сыворотки (в %); по оси ординат — содержание холестерина (в мкг на 1 мг белка) в человеческих (а) и мышиных (б) макрофагах. /, 2 — культивирование в сыворотках здоровыхдоноров,3,4— больных ИБС.

Рис.1А Связь между накоплением холестерина в клетках и временем инкубации.
По оси абсцисс—время инкубации (в ч). Остальные обозначения те же, что и на рис 1
ВЛИЯНИЕ ГАМК, ГОМК И ГЛУТАМИНОВОИ КИСЛОТЫ НА ФУНКЦИОНАЛЬНУЮ
АКТИВНОСТЬ ФАГОЦИТОВ
За последние годы проводится интенсивное изучение роли нейроактивных аминокислот в иммунологических процессах. Это связано с широким использованием данных аминокислот в неврологической и психиатрической практике, однако одновременно с их прямыми эффектами получены данные об их влиянии на иммунологические процессы. Получены данные о влиянии гамма-аминомасляной (ГАМК), гамма-оксимасляной (ГОМК) и глутаминовой кислот на количество антителообразующих, розеткообразующих клеток и другие показатели иммунитета. Опыты проводились в двух сериях: в I серии на интактных мышах изучалось влияние нейроактивных аминокислот на функциональное состояние МФ и нейтрофилов. Во II серии влияние тех же веществ на состояние фагоцитов изучалось на фоне предварительной иммунизации животных. Иммунизацию проводили 5% взвесью эритроцитов барана в количестве 1 мл на 3-й день после введения препарата. Контрольную группу составляли интактные мыши, получавшие физиологический раствор (контроль I), и животные, получавшие физиологический раствор и иммунизированные эритроциты барана (контроль II).
Введение интактным животным (I серия) нейроактивных аминокислот сопровождалось существенными сдвигами активности кислой фосфатазы в МФ и нейтрофильных лейкоцитах. Необходимо отметить, что изменение активности в изученных группах носило разнонаправленный характер. Так, в условиях введения ГАМК активность фермента в МФ и лейкоцитах крови повышалась по сравнению с контрольной группой в 1,7 раза, при введении же ГОМК происходило достоверное снижение активности кислой фосфатазы лишь в МФ. Показатели активности фермента при введении интактным мышам глутаминовой кислоты не отличались от таковых контрольной группы.
Изучение влияния биологически активных веществ на фоне предварительной иммунизации эритроцитами барана во всех опытных группах II серии выявило существенное понижение активности кислой фосфотазы в нейтрофильных лейкоцитах. Относительно низкие показатели активности в изучаемых клетках крови были зарегистрированы при введении ГОМК и глутаминовой кислоты, которые были ниже соответственно в 2 и 1,4 раза контрольного уровня. Активность изучаемого фермента в МФ опытных групп II серии не отличалась от таковой в контроле, за исключением группы, в которой на фоне иммунизации вводили ГОМК, где содержание кислой фосфатазы понижалось почти в 2 раза.
В серии проведенных цитологических исследований было установлено, что нейроактивные аминокислоты в испытуемых дозах не вызывают в клетках фагоцитарного ряда дистрофических и деструктивных изменений. Так, ни в одной изучаемой группе I серии не было выявлено признаков распада, фрагментации и лизиса цитоплазмической и ядерной мембран, пикноза и рексиса ядер. В то же время в группах, где вводили ГАМК и ГОМК, ядра моноцитов выглядели гипертрофированными и гипохромными, цитоплазма—умеренно вакуолизированной. Не исключено, что нейроактивные аминокислоты в биологически допустимых дозах не оказывают цитотоксического влияния на моноциты и нейтрофильные лейкоциты в крови интактных мышей. Однако существенные сдвиги в активности основного маркёра лизосом—кислой фосфатазы наводят на мысль, что изучаемые биологически активные вещества, не оказывая непосредственного токсического действия на клеточную мембрану, вызывают все-таки дестабилизацию внутриклеточных мембранных структур, и, в первую очередь, лизосомальных. Принимая во внимание то обстоятельство, что активность лизосомальных ферментов во многом зависит от функционального состояния мембран, а точнее—от степени её проницаемости, была проведена специальная серия экспериментов по изучению проницаемости лизосомальных мембран при помощи прижизненного флюорохромирования фагоцитов акридиновым оранжевым (АО). Результаты исследований с применением АО показали, что изменение тинкториальных свойств клеток-мишеней наблюдалось при введении в организм мышей всех исследуемых нейроактивиых аминокислот. При введении ГАМК, ГОМК и глутаминовой кислоты период полураспада (Т 1/2) заметно сокращается, а при экспозиции Т '/а, в течение которого происходит поэтапное изменение тинкторнальных свойств составных компонентов клеток (цитоплазма, ядро, участки локализации лизосом), количество фагоцитов с зеленой флюоресценцией ядер в опытных группах I серии достоверно снижалось. Аналогичная направленность четко прослеживалась во всех опытных группах II серии.
Резюмируя вышеизложенное, можно заключить, что нейроактивные аминокислоты оказывают существенное влияние на активность кислой фосфатазы в фагоцитах. Особо следует отметить, что полученный эффект в группах введения ГАМК и ГОМК был диаметрально противоположным: этот факт прослеживается наиболее четко в тех случаях, когда в качестве объекта изучения активности кислой фосфатазы выступали МФ. Введение же ГАМК и глутаминовой кислоты на фоне предварительной иммунизации не отражалось на активности кислой фосфатазы в МФ, в то время как в нейтрофильных лейкоцитах все изучаемые нейроактивные аминокислоты вызывали достоверное понижение активности фермента.
Эксперименты с применением в качестве индикатора проницаемости лизосомальных мембран АО показали, что нейроактнвные аминокислоты, не обладая цитодеструктивным действием па клетки-мишени, вызывают дестабилизацию лизосомальных мембран, направленную в сторону увеличения их проницаемости. Сопоставление показателей проницаемости лизосомальных мембран животных I и II серий показывает, что для повышения проницаемости под влиянием нейроактивных аминокислот формирование гуморального иммунитета является условием необязательным.
Таким образом, нейроактивные аминокислоты оказывают избирательное влияние на морфофункциональное состояние лизосомального аппарата фагоцитов. Это подтверждается полученными данными о проницаемости лизосомальных мембран в отношении токсического красителя и количественного определения активности основного маркера лизосом – кислой фосфотазы.
IV. Заключение
Приведенная лишь малая часть экспериментов по моделированию различных воздействий, говорит в пользу того, что процессы нарушений или изменения фагоцитирующей активности очень удобно изучать путем постановки опытов на перитонеальных МФ. Можно сказать, что данная модель давно стала базовой для проверки разнообразных химических и фармакологических препаратов в качестве агентов, воздействующих на клеточное звено иммунитета; для изучения процессов взаимодействия инфекционных агентов с фагоцитами. Также она используется для изучения не только фагоцитарной функции – но и наоборот, различных процессов, связанных с самими инфекционными агентами. Можно упомянуть, что проводятся исследования по изучению фагоцитов перитонеального экссудата у генетически диабетических мышей, у генетически иммунодепрессивных крыс и т.д.
Конечно те данные, которые получают исследователи достаточно относительны, ведь несмотря на высокое качество проводимых опытов, они все же проводятся in vitro, что неизменно накладывает свой отпечаток – клетки здесь лишены той гаммы цитокиновых воздействий, которая присутствует в живом организме, они не взаимодействуют со стромальными компонентами и другими клетками. Достоинством метода является его простота, доступность и, что немаловажно, наглядность, а также высокая скорость получения результатов и широкие возможности по постановке «регистрационных» реакций. Однако, как видно, этим в современной патологии мы не можем ограничиться. Поэтому в современных научных и клинических исследованиях применяют и другие методы и модели. О некоторых из них кратко будет рассказано ниже.
НЕКОТОРЫЕ ДРУГИЕ МОДЕЛИ ИЗУЧЕНИЯ ФАГОЦИТОЗА.
Одна из самых реалистичных моделей фагоцитоза – это модель in vivo. Данная модель позволяет получать достоверную информацию и моделировать процессы с учетом влияния внутренней среды. Однако она более сложна в реализации и порой не дает возможности работать с организмом человека. Модель in vivo существует в двух вариантах
Модель на фагоцитах сыворотки крови. Конечно, в этом случае объектом нашего внимания будут не МФ, а моноциты крови и нейтрофильные лейкоциты. Модель позволяет изучать влияние на состояние фагоцитов и фагоцитарной функции общих, системных процессов, таких как гипоксия, гипобария, радиация и проч. Также путем внутрисосудистого введения различных веществ можно получить данных об их воздействии. Изучается влияние и внутренних системных активных веществ: гистамина, простогландинов
Модель фагоцитоза в очаге хронического воспаления. Одна из самых «клинических» моделей. Здесь объектом внимания являются как тканевые МФ, так и эпителиоидные клетки, гигантские многоядерные клетки, клетки инородных тел и др. Большое внимание уделяется явлению незавершенного фагоцитоза, процессам подавления миграции, снижения кислород-зависимой цитотоксичности.
Очень оригинальная модель была разработана в лаборатории иммунологии Института акушерства и гинекологии им. Отта РАМН (авторы: О.А.Павлов,С.А.Сельков,А.В.Селютин, Е.Е.Андреева и др.). Они изучали роль плацентарных МФ в проблемах родовой деятельности и, особенно – в проблеме невынашивания беременности. Макрофагам фетоплацсптарного комплекса (МФК), по мнению исследователей, до недавнего времени уделялось неоправданно мало внимания. Лишь в последние годы появился ряд публикаций, посвященных этим клеткам. Многие функции МФК только предстоит выяснить, однако уже сейчас становится очевидным, что среди популяций различных клеток, составляющих ткань плаценты, МФК являются наиболее вероятными кандидатами на роль регуляторного (а, возможно, и ключевого) звена в ряде репродуктивных процессов. С точки зрения патогенеза развития родовой деятельности при преждевременных и срочных родах МФК представляют особый интерес в силу особенностей ряда свойств и положения этих клеток.
Плацентарные макрофаги (клетки Кащенко—Гофбауэра) принадлежат к системе мононуклеарпых фагоцитов, имеющих единое происхождение с обычными МФ. Эти клетки в значительном количестве содержатся в ткани плаценты и составляют подавляющее большинство ее иммунокомпетентных клеток. По данным некоторых авторов, макрофаги составляют до 40% популяции нетрофобластных клеток ворсин хориона.
Традиционно считалось, что прерогативой мононуклеарных фагоцитов в фетоплацентарном комплексе является удаление клеточного детрита, защита от микроорганизмов, участие в системе защиты плода от местного материнского иммунного ответа. Они также участвуют в реализации и модуляции иммунного ответа и представляют первую линию защиты против инфекции, обеспечивая неспецифические иммунные реакции и продуцируя регуляторные сигналы для специфических. Таким образом, уникальность положения МФК состоит в том, что, с одной стороны, они, как эффекторные клетки, вступают в непосредственный контакт с инфекционными агентами и иными продуктами, проникающими в организм хозяина (в данном случае в единую систему "мать—плацента—плод"), а, с другой стороны, будучи активированными в результате этого контакта, способны продуцировать множество растворимых сигнальных молекул, влияющих на функции близлежащих клеток.
В число этих факторов входят и цитокины, содержание которых меняется с началом спонтанной родовой деятельности — ФНОа, ИЛ-1, ИЛ-6 и ИЛ-8. Предполагается, что эти цитокины, продуцируемые макрофагами, стимулируют синтез ПГ и тем самым инициируют сократительную активность матки. Более того, показано, что макрофаги могут самостоятельно продуцировать ПГЕ2 ПГ2а, которые непосредственно воздействуют на миометрий. Макрофаги также способны к секреции трансформирующего ростового фактора-β (ТРФ-β), который играет важную роль в эмбриональном морфогенезе и влияет на функции клеток трофобласта и эндометрия. Недавно в экспериментах in vitro получены убедительные доказательства участия клеток плаценты в процессе родов. Авторы продемонстрировали связанное с родовой деятельностью увеличение секреции ФНО-α макрофагами, взятых у женщин в результате спонтанных родов или индуцированных родов путем искусственно родоразрешения, а также ИЛ-1 и ИЛ-6 эндотелиальными клетками плаценты. Все эти данные свидетельствуют о вкладе клеток плаценты, в том числе макрофагов, в повышение уровня цитокинов в пределах фетоплацентарного комплекса при спонтанной родовой деятельности. Предположения о возможной роли ПМ в преждевременном и срочном родоразрешении заставляют взглянуть на эту клеточную популяцию как на важнейший элемент, оказывающий влияние на гестационные процессы. В этой связи активация ПМ может рассматриваться как событие, ведущее к преждевременным или срочным родам. Установлена положительная корреляция между повышением уровня некоторых цитокинов (туморнекротизирующий фактор-α, интерлейкин-1 и -6), которые секретируются в том числе активированными макрофагами, и наступлением преждевременных и срочных родов. Попытались выявить связь между наличием родовой деятельности на разных сроках беременности и степенью активации ПМ in vitro, о которой судили по уровню экспрессии антигенов МНС II и фагоцитарной активности клеток, опосредованной Fс- и СЗ-рецепторами. при наличии родовой деятельности. Увеличивалось количество клеток, экспрессирующих МНС II и СКЗ и обладающих способностью к фагоцитозу. На более поздних сроках беременности не удалось выявить достоверного увеличения активности ПМ при родовой деятельности. Согласно данным снижение уровня фагоцитоза происходило за счет снижения активности отдельной клетки, в то время как количество фагоцитов существенно не изменялось. Для того, чтобы выяснить, отражает ли наблюдаемая тенденция существующую закономерность, или является следствием неоднородности исследуемого материала, необходимо исследовать дополнительное количество плацент.
Полученные результаты свидетельствуют о перспективности применения обогащенных культур ПМ для изучения ряда аспектов иммунологиии репродукции, в частности для выяснения клеточных механизмов, лежащих в основе нормальных и преждевременных родов.
Литература.
Д.И. Маянский, Клетка Купфера и система мононуклеарных фагоцитов, Москва, 1983
Методы изучения in vitro клеточного иммунитета, под ред. Блума и Глэйда, Москва,1974
И.И.Мечников, Лекции по сравнительной патологии воспаления, Москва, 1947
Терапевтический архив, 1990, Т62, N11
Вопросы медицинской химии, 1988, Т34, Вып.1
Лабораторное дело,1984, N5
Лабораторное дело,1985, N1
Лабораторное дело,1992, N2
Лабораторное дело,1989, N4
Иммунология, 1983, N1
Иммунология, 1983, N2
Иммунология, 1987, N6
Иммунология, 1989, N4
Иммунология, 1999, N1
Бюллетень экспериментальной биологии и медицины, 1988, N1
Бюллетень экспериментальной биологии и медицины, 1989,N11
Бюллетень экспериментальной биологии и медицины, 1990,N1
Бюллетень экспериментальной биологии и медицины,2000, Т129, N6
Бюллетень экспериментальной биологии и медицины,1999, Т127, N4
Журнал микробиологии эпидемиологии и иммунобиологии 1990,N5
Архив патологии, 1994, Т56, N1
Медицинская иммунология, 2001, Т3, N3
Экспериментальная и клиническая медицина, 1989, Т29, N3
Экспериментальная и клиническая медицина, 1989, Т29, N6
Цитология, 1992, Т34,N7
Санкт-Петербургский государственный университет
им. акад. И.П.Павлова
КАФЕДРА ПАТОФИЗИОЛОГИИ
РЕФЕРАТ
Макрофаги перитонеального экссудата как модель
фагоцитоза и нарушений фагоцитарной активности
Выполнил
студент Карпов С.А.
305 группы лечебного факультета
Преподаватель Степанян М.Л.
Санкт-Петербург
200
Похожие работы
... (промоции) происходит в органах и тканях, где происходит «зарождение» стволовой злокачественной клетки и организуется первичный злокачественный очаг. 3. Предпосылки мононуклеарного онкогенеза Для создания теории «Мононуклеарного онкогенеза» как естественного механизма возникновения, роста и развития злокачественного процесса мы посчитали возможным подвергнуть сомнению существующую теорию о ...
0 комментариев