Навигация
Радиохимические механизмы
1. Радиохимические механизмы
По этим представлениям, радиозащитные вещества либо их метаболиты непосредственно вмешиваются в первичные пострадиационные радиохимические реакции. К ним относятся:
— химическая модификация биологически чувствительных молекул-мишеней созданием смешанных дисульфидов между SH-группой аминокислоты белковой молекулы и SH-группой протектора;
— передача водорода протектора пораженной молекуле-мишени;
— инактивация окислительных радикалов, возникающих преимущественно при взаимодействии ионизирующего излучения с водой пораженной ткани.
2. Биохимико-физиологические механизмы
Эти представления объясняют действие радиозащитных веществ их влиянием на клеточный и тканевый метаболизм. Не участвуя в самой защите, они косвенно способствуют созданию состояния повышенной радиорезистентности, мобилизуя собственные резервы организма. К этой группе можно отнести:
— высвобождение собственных эндогенных, способствующих защите веществ, таких как эндогенные SH-вещества, в особенности восстановленный глутатион или эндогенные амины (например, гистамин);
— подавление ферментативных процессов при окислительном фосфорилировании, синтезе нуклеиновых кислот, белков и др., ведущих к снижению общего потребления кислорода, а в пролиферативных тканях—к отсрочке или торможению деления клеток. Этот эффект объясняется взаимодействием протектора с группами ферментов в митохондриях и эндоплазматическом ретикулуме или с белками клеточных мембран. Он носит также название «биохимический шок»;
— влияние на центральную нервную систему, систему гипофиз — надпочечники, на сердечно-сосудистую систему с созданием общей или избирательной тканевой гипоксии. Сама по себе гипоксия снижает образование пострадиационных окислительных радикалов и радиотоксинов, восстанавливает тканевый метаболизм. Затем она может привести к высвобождению эндогенных SH-веществ.
Современный исследователи склоняются в пользу биохимических механизмов радиозащиты. Особенно обращает внимание фармакологический аспект взаимодействия радиопротекторов с рецепторами на различных уровнях организма. Возможности защитного действия вещества ограничены количеством воспринимающих рецепторов. Радиозащитное действие серосодержащих веществ, в том числе цистамина и гаммафоса, вероятнее всего, реализуется благодаря их взаимодействию с рецепторами радиочувствительных клеток.
Производные индолилалкиламинов — мексамин и серотонин, вызывающие в тканях организма поствазоконстрикторную гипоксию, связаны с рецепторами сердечно-сосудистой системы. Однако известны результаты опытов in vitro и in vivo, которые вызывают сомнения в гипоксической теории защитного действия мексамина и серотонина, в отдельных случаях дополняя ее другими компонентами защитного действия. По данным Свердлова и соавторов (1971), мексамин не утрачивал защитного действия у мышей в условиях тканевой гипероксии. Клеточный компонент защитного действия мексамина обнаружили Богатырев и соавторы (1974) in vitro на облученных клетках костного мозга, полученных от мышей, которым за 15 мин до этого вводили защитную дозу мексамина. Не существует точной корреляции между тканевой гипоксией, вызванной мексамином, и его защитным действием. Мексамин вызывает гипоксию в селезенке продолжительностью несколько часов, хотя в более позднее время после введения он уже не обладает радиозащитным действием.
Радиозащитный эффект мексамина нельзя объяснять только его несомненным и значительным гипоксическим действием. Следует согласиться с представлением, что мексамин реализует свое защитное действие и непосредственным влиянием на обменные процессы в клетках.
Проблема понимания механизма радиозащитного действия химических веществ тесно связана с выяснением закономерности развития пострадиационных, изменений. Любая существенная информация в этих областях основных радиобиологических исследований уточняет наши представления о механизмах как радиационного поражения, так и радиозащиты.
ПРИМЕНЕНИЕ РАДИОПРОТЕКТОРОВ У ЧЕЛОВЕКА
Предостерегающий опыт знакомства человечества с поражающим действием атомных взрывов в Японии в конце второй мировой войны обязал радиобиологов всего мира постоянно изыскивать возможности снижения риска непосредственных и отдаленных последствий ионизирующего излучения. Большую лепту в радиационный риск вносят различные антропогенные загрязнения.
Современные радиозащитные вещества до сих пор далеко не соответствуют требованиям, которые к ним предъявляются. Их действие нельзя по понятным причинам испытывать при остром тотальном облучении людей.
Единственным путем обнаружения защитного эффекта у людей является введение исследуемого протектора в предполагаемой эффективной дозе перед локальным облучением. При этом следует учитывать, что в действительности локальное облучение не может быть оптимальным для оценки вещества, предназначенного для защиты человека преимущественно от тотального облучения. Таким способом ученому Владимирову и соавторам (1971) удалось установить радиозащитное действие цистамина дигидрохлорида, введенного онкологическим больным в дозе 0,8—1,2 г (перорально) за час до начала локального облучения грудной клетки в дозе 2,15 Гр. Действие оценивали по выходу аберрантных митозов в стадиях анафазы и телофазы в костном мозге грудины, взятом через 24 ч после облучения. Другим критерием защитного действия служит в локально облученном организме количественное исследование хромосомных аберраций в ядрах лимфоцитов периферической крови. Анализу подвергаются митозы в метафазе. В ряде сравнительных опытов Владимиров и Джаракян (1982) определили возможности этих и других методов по оценке радиозащитного действия преимущественно цистамина при тотальном и локальном облучении экспериментальных животных и человека. На основе обширного экспериментального и клинического материала был сделан вывод, что однократная пероральная доза цистамина дигидрохлорида (1,2 г) обеспечивает человеку защиту с ФУД, равным 1,35.
В России цистамин разрешен для клинического применения при радиотерапии с целью уменьшения нежелательных пострадиационных эффектов. Таблетка содержит 0,4 г действующего вещества. Цистамин вводится по 0,6 г один раз в сутки за час до облучения при количестве лейкоцитов не менее 5000 в 1 мкл крови, лимфоцитов—18—20% и общей дозе 40— 50 Гр (местно). При суммарных дозах 100—120 Гр и количестве лейкоцитов 4000 в 1 мкл рекомендуется пероральная доза (0,8 г в сутки) перед каждым следующим облучением. У чувствительных лиц после приема цистамина могут появиться признаки раздражения пищеварительного аппарата, которые обычно не служат препятствием для продолжения приема препарата. Острые заболевания желудочно-кишечного тракта, острая сердечно-сосудистая недостаточность и нарушения функций печени являются относительными противопоказаниями к приему цистамина.
Другим радиопротектором, применяемым у нас в стране, является гидрохлорид мексамина. Таблетка содержит 0,05 г препарата. Эта доза рекомендована для однократного перорального приема за 30—40 мин до каждого сеанса лучевой терапии. При хорошей переносимости доза может быть увеличена до 0,1 г. Исключение составляют признаки непереносимости, такие как тошнота, головокружение и рвота. Нежелательные эффекты устраняются или смягчаются введением кофеина. При продолжающейся непереносимости прием мексамина следует прекратить. Противопоказаниями к приему мексамина служат выраженный склероз сосудов сердца и мозга, сердечно-сосудистая недостаточность, бронхиальная астма, болезни почек с функциональными нарушениями и беременность. Цистамин и мексамин необходимо предохранять от света при хранении.
Использование химических радиопротекторов при радиотерапии не получило широкого распространения, поскольку, по мнению радиологов, нельзя различить защиту здоровых и опухолевых тканей. Защита опухолевых клеток от действия ионизирующего излучения, безусловно, нежелательна. Цистеамин или АЭТ явно обеспечивают защиту экспериментальных опухолей. Некоторое различие в защите нормальных и злокачественных тканей не зависит от использованного протектора, а обусловлено неодинаковым кровотоком. Здоровые ткани с хорошим кровенаполнением будут иметь, несомненно, более высокую концентрацию радиопротектора, нежели область опухоли со значительно ограниченным кровоснабжением.
В США клинические испытания гаммафоса начались в марте 1979 г. Испытания проводились параллельно с двумя целями. Прежде всего следовало определить однократную максимально переносимую дозу гаммафоса в клинических условиях. Затем предстояло подобрать схему повторной дозировки гаммафоса на протяжении нескольких недель. Гаммафос ввели 50 больным однократно в нарастающих дозах от 25 до 910 мг/м2, 15 больных получили его повторно. До однократной дозы 100 мг/м2 у больных не отмечалось никаких побочных эффектов. Гаммафос вводили путем медленного вливания в течение 20—50 мин, контролируя кровяное давление, пульс, ЭКГ и дыхание. Вливание заканчивали за 15—20 мин до начала облучения. Максимальная переносимая однократная внутривенная доза была определена в 750 мг/м2. Внутривенно дозу 170 мг/м2 можно повторять 4-кратно в течение недели. Однократное и повторное введение гаммафоса сопровождалось тошнотой и рвотой, понижением кровяного давления, сонливостью и аллергическими кожными реакциями. В другой группе из 53 больных было установлено, что гаммафос не влияет отрицательно на противоопухолевое действие алкилирующих средств, что в сочетании с результатами экспериментов побуждает к дальнейшему клиническому исследованию свойств гаммафоса.
При индивидуальной защите людей от действия ионизирующего излучения вследствие взрыва ядерного оружия внутривенное вливание не может рассматриваться в качестве способа применения радиопротектора. Наиболее адекватен пероральный способ введения. По данным сотрудников отделения медицинской химии Армейского исследовательского института им. Уолтера Рида в Вашингтоне, опубликованным в работе Harris и Phillips (1971), люди переносят пероральную дозу гаммафоса 140 мг/кг, что для человека со средней массой тела 70 кг составляет общую однократную дозу 9,8 г, которая могла бы приниматься после растворения в достаточном объеме питьевой воды.
Другую практическую возможность представляет собой внутримышечная инъекция радиопротектора. На основе межвидового сравнения распределения и концентрации гаммафоса в тканях при внутривенном введении Washburn и соавторы (1976) предположили, что доза 20 мг/кг может обеспечить защиту человека от тотального облучения с ФУД 1,5. Для человека с массой тела 70 кг однократная парентеральная доза составила бы 1,4 г гаммафоса. Такую дозу можно приготовить в приемлемом для введения объеме соответствующего растворителя.
Несмотря на все подающие надежды данные, свидетельствующие о хорошем защитном действии гаммафоса в эксперименте и клинике, даже этот препарат не обладает идеальными свойствами для использования в радиотерапии. По мнению очень многих ученых желательно иметь более эффективное и менее токсичное вещество. Национальный институт исследований рака в США субсидирует поиск новых химических радиопротекторов. Его проведение было поручено исследовательскому центру в Филадельфии (Fox Chase Cancer Center). Из 50 до сих пор испытанных веществ около 20 защищали мышей от костномозговой гибели при острой лучевой болезни. Однако ни одно из них по своим свойствам не превосходило гаммафос.
В Японии было испытано радиозащитное вещество 2-меркаптопропионилглицин, который уже с 1963 г. используется в клинике как средство детоксикации. Оно вводится людям в дозах 100 и 500 мг перорально или внутривенно. Каких-либо побочных эффектов не отмечается. В опытах на мышах оптимальная внутрибрюшинная защитная доза составляет 20 мг/кг. От летального действия тотального гамма-облучения она защищает с ФУД 1,4. Терапевтический индекс высок, поскольку внутрибрюшинная токсическая доза МПГ у мышей по ЛД50 составляет 1400 мг/кг.
При радиотерапии злокачественных опухолей в тазовой области с суточной дозой облучения 1,5 Гр (5-кратно в течение недели) до суммарной дозы 60 Гр или до общей дозы 40,5 Гр при послеоперационном облучении внутривенное введение МПГ больным в дозе 250 мг в 20% растворе глюкозы за 15—30 мин до каждого облучения оказывало благоприятное влияние на количество лейкоцитов в периферической крови и на выход хромосомных аберраций.
В случае, если бы удалось получить высокоэффективный радиопротектор, не обладающий побочными токсическими эффектами, его использование в ядерной войне было бы ограничено продолжительностью защитного действия, так как трудно с точностью во времени предсказать применение противником ядерного оружия. Существует, однако, случай обоснованного использования радиопротекторов в рамках самопомощи, а именно: перед вынужденным вxoждeниe в зону радиоактивного следа от ядерного взрыва. Здесь возможны и организационные меры, прежде всего рациональное чередование пребывания отдельных лиц в зоне и вне ее, чтобы ограничить суммарную дозу радиации.
Наряду с этим действенная защита людей создается механической (физической) защитой. К ней относится как общая защита в убежищах, подвалах зданий, самих домах, в складках местности и за природными преградами, так и частичная физическая защита преимущественно радиочувствительных тканей, кроветворного костного мозга и слизистой оболочки пищеварительного аппарата.
В чрезвычайных условиях необходимо помнить об использовании любой возможности защиты от действия ионизирующего излучения. Введение химических радиопротекторов представляет собой в настоящее время малоэффективную меру, которую, однако, можно предоставить большому количеству подверженных опасности людей.
В мирных условиях нельзя рекомендовать долговременное повторное (например, ежедневное) введение доступного радиопротектора цистамина лицам, работающим с ионизирующим излучением, исследователям, медицинскому персоналу, работникам АЭС и т.п. Риск возникновения побочных эффектов цистамина, особенно при хроническом введении, намного превышает вероятность риска возможного внешнего облучения. Цистамин также не предназначен для защиты людей от действия излучений при загрязнении организма радиоактивными веществами. Цистамин показан к применению у лиц, работающих с источниками ионизирующих излучений только в такой явно аварийной ситуации, которая угрожает им однократным облучением в основном всего тела в дозе более 1 Гр. Рекомендованная однократная защитная доза цистамина составляет 0,8–1,2 г. В случае необходимости можно вводить цистамин повторно с 6-часовыми интервалами до общей дозы 30 г.
К клиническому применению цистамина у больных, подвергающихся лучевой терапии, следует подходить индивидуально с учетом их переносимости самой терапии. В наших экспериментах на крупных лабораторных животных комбинация цистамина с метоклопрамидом оказалась пригодной для устранения послецистаминовой рвоты. Эта комбинация рекомендуется и больным для приема внутрь. По экспериментальным данным, гаммафос — более перспективный радиопротектор, чем цистамин. Вопрос об адекватности применения доступного радиопротектора цистамина у больных, подвергающихся лучевой терапии,— решит практика.
Радиопротекторы представляют большой интерес как с научной, так и с практической точки зрения.
ЛИТЕРАТУРА:
1. Артомонова В.Г., Шаталов Н.Н. Профессиональные болезни. Учебник. –2-е изд., перераб. и доп. –М.: Медицина, 1988. –416с., ил.
2. Куна П. Химическая радиозащита. Монография. –М.: Медицина, 1989. –193с.: ил.
3. Ярмоненко С.П. Противолучевая защита организма. –М.: Атомиздат, 1969. –264с.
4. Романцев Е.Ф. Радиация и химическая защита. (Изд. 2-е, переработ. и доп.). –М.: Атомиздат, 1968. –248с.
5. Радиация. Дозы, эффекты, риск. (Обзор НКДАР при ООН): Пер. с англ. –М.: Мир, 1990. –79с., ил.
Похожие работы
... 1,7*1017 Бк вследствие поступления в Мировой океан радиоактивных отходов. Наиболее загрязнены районы умеренных широт, особенно в Северном полушарии. В связи с этим перед радиобиологией возникают новые проблемы: всестороннее исследование радиационного поражения радиационного поражения многоклеточных организмов при их тотальном облучении, познание причин различной радиочувствительности организмов, ...
... любого изотопа при написании первым всегда указывается массовое число изотопа над строкой, а затем символ химического элемента, а произносят наоборот: сначала элемент, затем масса изотопа. Соединения, меченные радиоактивными изотопами, делят на две группы веществ. Во-первых, это конкретные химические соединения, у которых один атом (или несколько) заменён на атом радиоактивного изотопа того же ...
... электрических соединений на всех напряжениях переменного постоянного тока для нормальных режимов. Такие схемы должны обеспечивать сочетание максимальной надежности и экономичности электроснабжения потребителей. Переключения в электрических схемах распредустройств подстанций, счетов и зборок должны производится по распоряжению или с ведома вышестоящего дежурного персонала (или старшего электрика ...
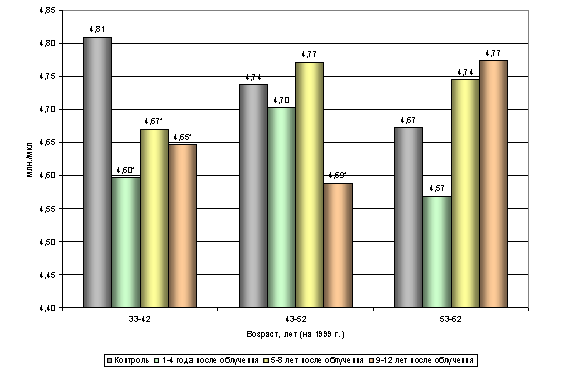
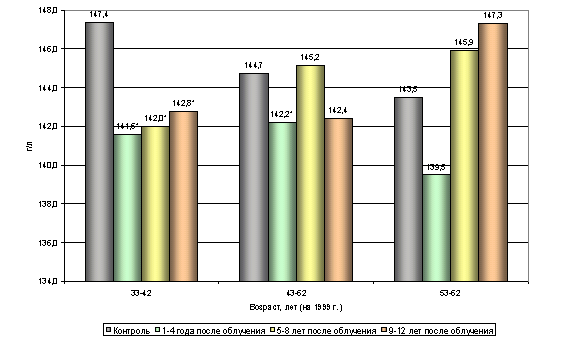
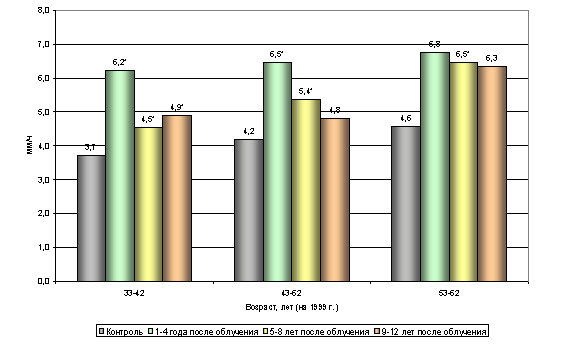
... этих показателей. Наблюдаемые возрастные различия указанных параметров не проявляют видимой закономерности, не поддаются трактовке и обусловлены, вероятно, рядом неучтенных влияний. 3.2. Динамика показателей периферической крови. Обобщенный анализ динамики изучаемых показателей по всему массиву обследованных (без учета возраста) позволил отметить следующие факты. При анализе постэкспозиционной ...
0 комментариев