Навигация
Современное представление электропроводности растворов
2. Современное представление электропроводности растворов
В работах [1 - 6] предложена теоретическая модель многочастотных взаимодействий ионов в растворах электролитов и выведено уравнение электропроводности.
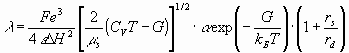 (1)
(1)
Которое получается из двух эквивалентных представлений потока ![]() и
и ![]() . Прировняв по j и выразив получим
. Прировняв по j и выразив получим ![]() .
.
Здесь 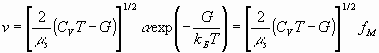 (2)- скорость ионов (fM – максвелловское распределение по скоростям [7]),
(2)- скорость ионов (fM – максвелловское распределение по скоростям [7]),
![]() (3)- напряженность внешнего электрического поля,
(3)- напряженность внешнего электрического поля,
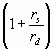 - параметр экранирования учитывающий колебательный характер,
- параметр экранирования учитывающий колебательный характер,
причем 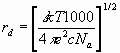 - дибаевский радиус экранирования. Соответствует параметру затухания в гидродинамике.
- дибаевский радиус экранирования. Соответствует параметру затухания в гидродинамике.
Было показано [7], что уравнение (1) справедливо для водных растворов в широком диапазоне концентраций сильных и слабых кислот и оснований, а также солей от 0 до 10 моль/л.
Из выражения (1) видно, что молярная электропроводность раствора зависит от значений диэлектрической проницаемости , энергии межмолекулярных взаимодействий растворителя в жидкой фазе Н, приведенной массы сольватированных ионов электролита s, степени диссоциации , потенциальной энергии ионов в растворах G, определяемых следующими соотношениями:
![]() , (4)
, (4)
![]() , (5)
, (5)
![]() , (6)
, (6)
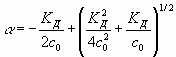 , (7)
, (7)
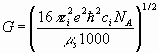 (8)
(8)
где F – число Фарадея; е – заряд электрона; СV=5R/2 – теплоемкость; k – постоянная Больцмана; Т – температура, К; ![]() ,
, ![]() - массы сольватированных ионов, г; М – молекулярная масса растворителя, г; ns – сольватное число иона;
- массы сольватированных ионов, г; М – молекулярная масса растворителя, г; ns – сольватное число иона; ![]() - эффективный радиус молекулы растворителя, см; ri и zi – радиус (см) и заряд иона; rs и rd – радиус сольватированного иона и дебаевский радиус экранирования; р – дипольный момент молекулы растворителя, ед.СГС; КД – константа диссоциации электролита;
- эффективный радиус молекулы растворителя, см; ri и zi – радиус (см) и заряд иона; rs и rd – радиус сольватированного иона и дебаевский радиус экранирования; р – дипольный момент молекулы растворителя, ед.СГС; КД – константа диссоциации электролита; ![]() - постоянная Планка; NA – число Авогадро; - приведенная масса молекулы электролита, г; сi – молярная концентрация ионов (сi= c0); с0 – исходная молярная концентрация электролита.
- постоянная Планка; NA – число Авогадро; - приведенная масса молекулы электролита, г; сi – молярная концентрация ионов (сi= c0); с0 – исходная молярная концентрация электролита.
3. Изоморфизм уравнений
При рассмотрении движения в поле вязких сил удобно ввести понятие подвижности b. Подвижность определяется как предельная скорость, приобретаемая телом под действием силы, равной единице, т. е.
![]()
Таким образом, абсолютная подвижность в системе CGS равна скорости в сантиметрах в секунду, приобретаемой под действием силы в 1 дин. При рассмотрении движения ионов в качестве единицы силы обычно пользуются равным единице градиентом потенциала, действующим на ионный заряд.
Эквивалентная ионная электропроводность , связана простым соотношением с подвижностью. Из определения удельной электропроводности следует, что представляет собой ток, текущий через проводник с равным единице поперечным сечением под действием градиента потенциала, равного единице. Полный ионный заряд в единице объема равен Fc, если с измеряется в эквивалентах на единицу объема. Этот заряд, движущийся со скоростью b’, вызывает ток :
![]() (9)
(9)
или
![]() (10)
(10)
Следовательно, для абсолютной подвижности имеем
![]() (11)
(11)
Для макроскопической частицы, движущейся в идеальной гидродинамической среде, можно вычислить сопротивление трения. Оно выражается через размеры частицы и вязкость среды. Для сферической частицы Стоксом [8] выведена формула
![]() (12)
(12)
где r - радиус сферы. Если ион движется по закону Стокса, его радиус определяется соотношением
![]() (13)
(13)
Если b выражено через предельную эквивалентную электропроводность согласно уравнению (11), то получаем
![]() (14)
(14)
Выразив r в ![]() , а и в обычных единицах, придем к соотношению
, а и в обычных единицах, придем к соотношению
![]() (14а)
(14а)
Движение малых ионов не подчиняется закону Стокса, так как не выполняются необходимые предпосылки. Подвижность связана с коэффициентом диффузии D соотношением
![]() (15)
(15)
где k—постоянная Больцмана. Это ведет к так называемой формуле Эйнштейна — Стокса:
![]() (16)
(16)
Формула Эйнштейна — Стокса справедлива при тех же предположениях, что и уравнение (14).
Связав рассмотренные выше уравнения, через подвижность при условии ее неизменности, получим
![]() (17)
(17)
Сугубо качественно, для произвольного электролита КА в диэлектрической среде имеет место:
![]() (18)
(18)
Причем, k1 и k2 – константы скоростей, ![]() и
и ![]() - сольватированые катион и анион. Очевидно, что при смещении равновесия (18) влево плотность зарядов (равно как и плотность числа частиц) падает, вязкость уменьшается, диффузия увеличивается, электропроводность растет. При смещении равновесия вправо имеет место обратные эффекты. Другими словами, динамика равновесия (18) характеризуется столкновительными инвариантами кинетической теории газов, определяемыми относительными скоростями V смещения ионов в (18) и напряженности внешнего поля E, см. уравнения (2, 3).
- сольватированые катион и анион. Очевидно, что при смещении равновесия (18) влево плотность зарядов (равно как и плотность числа частиц) падает, вязкость уменьшается, диффузия увеличивается, электропроводность растет. При смещении равновесия вправо имеет место обратные эффекты. Другими словами, динамика равновесия (18) характеризуется столкновительными инвариантами кинетической теории газов, определяемыми относительными скоростями V смещения ионов в (18) и напряженности внешнего поля E, см. уравнения (2, 3).
Выражение (2) представляется несколькими вариантами
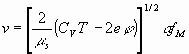 (19)
(19)
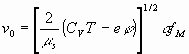 (20)
(20)
Представление скорости (19) отвечает направленному движению зарядов при наличии внешнего поля. Это соответствует явлениям вязкости и электропроводности.
Если же внешнее поле отсутствует (Е = 0), следует уравнение (20) соответствующее диффузии.
Таким образом, для двух возможных значений скоростей по выражениям (19), (20) из уравнения b=V/eE следует:
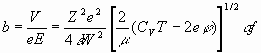 (21)
(21)
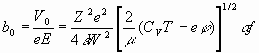 (22)
(22)
Из взаимосвязи (17) выражая коэффициент диффузии и вязкость, через электропроводность, можно теоретически определить эти неточно экспериментально определяемые характеристики раствора.
Взаимосвязь диффузии с электропроводностью была проведена Нернстом и Хартли:
![]() . (23)
. (23)
Где ![]() - средний молярный коэффициент активности.
- средний молярный коэффициент активности.
Предельное значение D при бесконечном разбавлении, когда ![]() , определяется формулой
, определяется формулой
![]() (24)
(24)
было получено Нернстом.
Проверка проводилась, используя эквивалентную электропроводность хлоридов LiCl, NaCl, KCl.
В уравнениях (17) неизвестной величиной является rs – приведенный радиус молекулы АВ, который можно найти, используя уравнение
![]() (25)
(25)
теоретически радиусы иона и сольватированного иона можно оценить по формулам [1-6]:
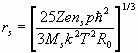 , (26) где
, (26) где
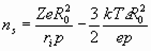 , (27) где
, (27) где
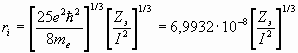 (28)
(28)
rs – радиус сольватированного иона,
ns – число молекул растворителя окружающих ион,
ri – радиус иона,
Zэ – экранированный заряд ядра,
Z – заряд иона,
I – энергия ионизации,
R0 – радиус молекулы растворителя,
р – дипольный момент молекулы растворителя,
- диэлектрическая проницаемость среды,
Мs – молекулярная масса растворителя.
Zэ – экранированный заряд ядра находится используя константы экранирования Слейтера определяемые по стандартным правилам приводимым в различных учебниках по теоретической основе неорганической химии, в частности [9].
Таблица 1
Радиусы ионов, сольватные числа и радиусы сольватированных ионов рассчитанные по уравнениям 26 – 28
| Ион | I, эв | Zэ |
| ns |
|
| Li+ | 75,62 | 2,7 | 0,5446 | 7,3873 | 4,4246 |
| Na+ | 47,29 | 6,55 | 1,0004 | 3,2301 | 3,3583 |
| K+ | 31,81 | 7,75 | 1,3785 | 1,8682 | 2,7980 |
| Cl- | 3,82 | 4,875 | 1,8100 | 1,0090 | 2,2786 |
Таблица 2
Приведенные радиусы молекул рассчитанные по формуле 25
| Молекула |
|
| LiCl | 1,5040 |
| NaCl | 1,3575 |
| KCl | 1,2559 |
Выражая из уравнения (17) вязкость и коэффициент диффузии через электропроводность (Т = 298К), получим отдельно для каждого i-го иона:
![]() (29)
(29)
![]() (30)
(30)
Переходя к вязкости и диффузии, как свойствам раствора, необходимо учитывать взаимную корреляцию движения ионов противоположного знака, поэтому вязкости и коэффициенты диффузии отдельных ионов одной молекулы, объединяем в приведенное значение.
Например, для 1-1 электролита
![]() (31)
(31)
![]() (32)
(32)
Соответственно при бесконечном разбавлении
![]() (33)
(33)
![]() (34)
(34)
Неренст и Хартли для определения коэффициента диффузии одного единственного электролита предложили уравнение (23)
![]() (35)
(35)
где D0 – предельное значение коэффициента диффузии по Нернсту (33)
Сравнивая теоретические уравнения электропроводности (1) и диффузии по Неренсту – Хартли (35), учтя в последнем максвеловское распределение по скоростям и параметр экранирования, можно показать, что
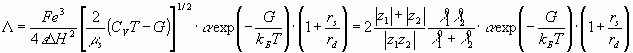 (36, 37)
(36, 37)
Электропроводности экспериментально найденные, и рассчитанные по уравнениям (36, 37), приведены в таб. 4.3 – 4.5.
Из полученных данных можно сделать вывод, что электропроводность найденная по уравнению (36) хорошо согласуется с экспериментально найденной в случаях хлоридов натрия и калия, хуже для хлорида лития, но электропроводность рассчитанная по уравнению (37) для хлорида лития практически совпадает с данными полученными по уравнению (36), в остальных случаях уравнение (37) дает небольшое расхождение с опытом.
Роль среднего значения кинетической энергии ионов в уравнении (1), которая, согласно теореме вариала, равна по модулю среднему значению полной энергии, играет функция 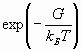 , причем
, причем 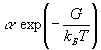 - есть максвелловское распределение по скоростям.
- есть максвелловское распределение по скоростям.
В уравнении (35) выражение ![]() равно
равно ![]() , а это есть –полная энергия молекулы при данной концентрации.
, а это есть –полная энергия молекулы при данной концентрации.
Роль распределения для коэффициента диффузии играет функция ![]() , которую, если учесть при средне молярном коэффициенте активности, можно представить в виде
, которую, если учесть при средне молярном коэффициенте активности, можно представить в виде 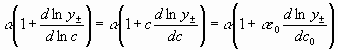 .
.
Применив поправку 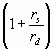 , окончательно получим
, окончательно получим
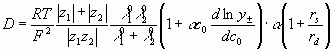 (38)
(38)
С другой стороны, учитывая уравнение (37) получим:
![]() (39)
(39)
Здесь - электропроводность экспериментальная, либо рассчитанная по уравнениям (36, 37). Нернст и Хартли получили уравнение (39) без учета вероятностного распределения, поэтому должно быть
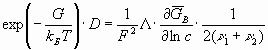
или
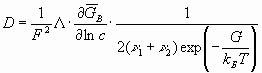 (40)
(40)
Используя уравнение Стокса – Эйнштейна (16)
![]()
выразим вязкость, через коэффициент диффузии найденный по уравнению (38) получим
![]() (41)
(41)
или по (40)
![]() (41а)
(41а)
Так же вязкость можно определить через подвижность найденную по уравнению (21)
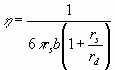 (42)
(42)
Используя значения эквивалентных электропроводностей (рис. 4.1), данные таблицы 2, уравнений 30, 35, 38, 40 и уравнений 29, 41, 41а, 42, где вместо i также табличное значение электропроводностей, были подсчитаны значения вязкости и коэффициента диффузии выбранных солей см. таб. 4 – 12.
В концентрационных зависимостях Dлит дана с относительной погрешностью 10%, лит с относительной погрешностью 5%.
Таблица 4
Результаты оценок электропроводностей, функции от среднемолярного коэффициента активности, степени диссоциации, параметр экранирования и функции распределения для раствора LiCl
| C mol/l | лит [13, 10] | (36) | (37) |
| |
| f |
| 0,0000 | 115,03 | 115,0272 | 102,6938 | 0,0000 | 1,0000 | 1,0000 | 1,0000 |
| 0,0010 | 111,89 | 111,7256 | 99,9015 | -0,0201 | 0,9727 | 1,0111 | 0,9892 |
| 0,0030 | 110,54 | 110,2571 | 98,7011 | -0,0321 | 0,9610 | 1,0192 | 0,9813 |
| 0,0050 | 109,35 | 108,9754 | 97,6305 | -0,0391 | 0,9506 | 1,0247 | 0,9759 |
| 0,0100 | 107,45 | 106,9120 | 95,9211 | -0,0496 | 0,9341 | 1,0350 | 0,9661 |
| 0,0500 | 99,92 | 98,6459 | 89,0524 | -0,0663 | 0,8686 | 1,0782 | 0,9259 |
| 0,1000 | 95,86 | 93,9805 | 85,2381 | -0,0579 | 0,8333 | 1,1107 | 0,8968 |
| 0,5000 | 82,21 | 77,5348 | 71,7584 | 0,0600 | 0,7147 | 1,2474 | 0,7838 |
| 0,6000 | 80,00 | 74,8439 | 69,5160 | 0,0873 | 0,6955 | 1,2710 | 0,7658 |
| 1,0000 | 73,26 | 66,5405 | 62,5579 | 0,2015 | 0,6369 | 1,3499 | 0,7086 |
| 1,2300 | 69,50 | 62,1439 | 58,7745 | 0,2776 | 0,6042 | 1,3881 | 0,6824 |
| 2,0000 | 60,69 | 51,7162 | 49,7563 | 0,6206 | 0,5276 | 1,4949 | 0,6143 |
| 2,5140 | 55,20 | 45,6671 | 44,3722 | 0,9317 | 0,4799 | 1,5548 | 0,5791 |
| 3,0000 | 50,00 | 40,2781 | 39,4739 | 1,2812 | 0,4347 | 1,6061 | 0,5506 |
| 3,5000 | 45,00 | 35,3091 | 34,8919 | 1,6871 | 0,3912 | 1,6546 | 0,5249 |
| 5,1000 | 31,90 | 23,1378 | 23,4169 | 3,1493 | 0,2773 | 1,7902 | 0,4593 |
| 7,7500 | 16,78 | 10,8205 | 11,3334 | 5,0527 | 0,1459 | 1,9741 | 0,3832 |
| 10,4200 | 7,14 | 4,1320 | 4,4640 | 4,3115 | 0,0621 | 2,1295 | 0,3289 |
| 14,0823 | - 5,1179 | 2,3131 | 0,2745 |
Таблица 5
Результаты оценок коэффициента диффузии раствора LiCl
| C mol/l | Dтеор (30) | Dтеор (35) | Dтеор (38) | Dтеор (40) | Dлит [10] | Dлит [11] |
| 0,0000 | 1,3226 | 1,1808 | 1,1808 | 1,3226 | 1,1802 | |
| 0,0010 | 1,2865 | 1,1570 | 1,1386 | 1,2733 | 1,1621 | |
| 0,0030 | 1,2710 | 1,1429 | 1,1208 | 1,2521 | 1,1500 | |
| 0,0050 | 1,2573 | 1,1346 | 1,1075 | 1,2362 | 1,1431 | |
| 0,0100 | 1,2354 | 1,1222 | 1,0886 | 1,2134 | 1,1336 | |
| 0,0500 | 1,1489 | 1,1025 | 1,0422 | 1,1545 | 1,1146 | |
| 0,1000 | 1,1022 | 1,1124 | 1,0402 | 1,1468 | 1,1059 | |
| 0,2000 | 1,1475 | 1,0973 | ||||
| 0,3000 | 1,1838 | 1,0886 | ||||
| 0,4500 | 1,2352 | 1,0886 | ||||
| 0,5000 | 0,9452 | 1,2516 | 1,0978 | 1,1861 | 1,0973 | |
| 0,6000 | 0,9198 | 1,2839 | 1,1071 | 1,1920 | 1,1016 | |
| 0,7000 | 1,3161 | 1,1059 | ||||
| 1,0000 | 0,8423 | 1,4187 | 1,1454 | 1,2183 | 1,1232 | |
| 2,0000 | 0,6978 | 1,9135 | 1,2362 | 1,2849 | 1,1750 | |
| 3,0000 | 0,5749 | 2,6936 | 1,2834 | 1,3095 | 1,2355 | |
| 3,5000 | 0,5174 | 3,1728 | 1,2687 | 1,2839 | 1,2649 | |
| 5,1000 | 0,3668 | 4,8993 | 1,0982 | 1,0851 | ||
| 7,7500 | 0,1929 | 7,1468 | 0,5907 | 0,5639 | ||
| 10,4200 | 0,0821 | 6,2716 | 0,1978 | 0,1831 | ||
| 14,0823 | 0,0000 | -4,8622 | 0,0000 | 0,0000 |
Таблица 6
Результаты оценок вязкости раствора LiCl
| C mol/l | теор (29) | теор (41) | теор (41а) | теор (42) | лит [10] | лит [12] | эксп |
| 0,0000 | 0,9433 | 1,0619 | 0,9481 | 1,0177 | 0,8937 | 0,9125 | |
| 0,0010 | 0,9697 | 1,1013 | 0,9848 | 1,0191 | 0,8586 | ||
| 0,0050 | 0,9923 | 1,1322 | 1,0143 | 1,0211 | 0,9228 | ||
| 0,0100 | 1,0098 | 1,1518 | 1,0334 | 1,0227 | 0,9024 | ||
| 0,0500 | 1,0859 | 1,2031 | 1,0861 | 1,0308 | |||
| 0,1000 | 1,1319 | 1,2055 | 1,0933 | 1,0380 | 0,9613 | ||
| 0,1250 | 1,0412 | 0,9044 | 0,9663 | ||||
| 0,2500 | 1,0552 | 0,9221 | 0,9928 | ||||
| 0,5000 | 1,3199 | 1,1422 | 1,0571 | 1,0790 | 0,9534 | 1,0156 | 1,0337 |
| 0,6000 | 1,3563 | 1,1326 | 1,0519 | 1,0877 | |||
| 1,0000 | 1,4811 | 1,0947 | 1,0292 | 1,1204 | 1,0212 | 1,0628 | 1,0986 |
| 1,2300 | 1,5612 | 1,0844 | 1,0256 | 1,1381 | |||
| 2,0000 | 1,7879 | 1,0143 | 0,9759 | 1,1942 | 1,2208 | ||
| 2,5140 | 1,9657 | 0,9835 | 0,9557 | 1,2301 | 1,1504 | ||
| 3,0000 | 2,1701 | 0,9770 | 0,9575 | 1,2632 | |||
| 3,5000 | 2,4112 | 0,9883 | 0,9766 | 1,2969 | |||
| 5,1000 | 3,4014 | 1,1418 | 1,1556 | 1,4030 | |||
| 7,7500 | 6,4663 | 2,1229 | 2,2235 | 1,5781 | |||
| 10,4200 | 15,1968 | 6,3379 | 6,8471 | 1,7584 | |||
| 14,0823 | 2,0172 |
Таблица 7
Результаты оценок электропроводностей, функции от среднемолярного коэффициента активности, степени диссоциации, параметр экранирования и функции распределения для раствора NaCl
| C mol/l | лит [13, 10] | (36) | (37) |
| |
| f |
| 0,0000 | 126,45 | 126,4452 | 126,4559 | 0,0000 | 1,0000 | 1,0000 | 1,0000 |
| 0,0010 | 123,74 | 123,8839 | 124,1052 | -0,0160 | 0,9786 | 1,0100 | 0,9930 |
| 0,0030 | 121,93 | 122,1710 | 122,5421 | -0,0264 | 0,9643 | 1,0173 | 0,9879 |
| 0,0050 | 120,64 | 120,9423 | 121,4142 | -0,0329 | 0,9541 | 1,0223 | 0,9844 |
| 0,0100 | 118,53 | 118,9344 | 119,5879 | -0,0435 | 0,9374 | 1,0316 | 0,9780 |
| 0,0500 | 111,06 | 111,7609 | 113,1362 | -0,0731 | 0,8783 | 1,0706 | 0,9515 |
| 0,0700 | 109,62 | 110,3868 | 111,9977 | -0,0784 | 0,8669 | 1,0836 | 0,9428 |
| 0,1000 | 106,74 | 107,5453 | 109,4273 | -0,0825 | 0,8441 | 1,0999 | 0,9320 |
| 0,2000 | 101,71 | 102,5226 | 105,0841 | -0,0829 | 0,8043 | 1,1412 | 0,9053 |
| 0,5000 | 93,62 | 94,0614 | 97,8557 | -0,0551 | 0,7404 | 1,2233 | 0,8544 |
| 1,0000 | 85,76 | 85,3416 | 90,3338 | 0,0092 | 0,6782 | 1,3158 | 0,8005 |
| 1,5000 | 79,86 | 78,5873 | 84,3315 | 0,0894 | 0,6316 | 1,3868 | 0,7614 |
| 2,0000 | 74,71 | 72,6592 | 78,8992 | 0,1885 | 0,5908 | 1,4467 | 0,7300 |
| 3,0000 | 65,57 | 62,2472 | 68,9945 | 0,4430 | 0,5185 | 1,5470 | 0,6801 |
| 4,0000 | 57,23 | 53,0225 | 59,8362 | 0,7554 | 0,4526 | 1,6317 | 0,6408 |
| 5,0000 | 49,46 | 44,7258 | 51,3076 | 1,0944 | 0,3911 | 1,7062 | 0,6080 |
| 5,5203 | 1,2691 | 1,7421 | 0,5928 |
Таблица 8
Результаты оценок коэффициента диффузии раствора NaCl
| C mol/l | Dтеор (30) | Dтеор (35) | Dтеор (38) | Dтеор (40) | Dлит [10] | Dлит [11] |
| 0,0000 | 1,4539 | 1,3912 | 1,3912 | 1,4539 | 1,3910 | |
| 0,0010 | 1,4227 | 1,3690 | 1,3535 | 1,4103 | 1,3694 | 1,3738 |
| 0,0030 | 1,4019 | 1,3546 | 1,3300 | 1,3830 | 1,3565 | 1,3565 |
| 0,0050 | 1,3871 | 1,3455 | 1,3144 | 1,3649 | 1,3478 | 1,3478 |
| 0,0100 | 1,3628 | 1,3307 | 1,2904 | 1,3367 | 1,3349 | 1,3392 |
| 0,0500 | 1,2769 | 1,2895 | 1,2242 | 1,2559 | 1,3020 | 1,3046 |
| 0,0700 | 1,2604 | 1,2821 | 1,2181 | 1,2460 | 1,3046 | 1,3046 |
| 0,1000 | 1,2273 | 1,2764 | 1,2017 | 1,2250 | 1,2813 | |
| 0,2000 | 1,1694 | 1,2760 | 1,1920 | 1,2057 | ||
| 0,2200 | 1,2775 | 1,2787 | ||||
| 0,5000 | 1,0764 | 1,3146 | 1,2086 | 1,2085 | ||
| 0,5700 | 1,3259 | 1,2701 | 1,2701 | |||
| 1,0000 | 0,9861 | 1,4040 | 1,2493 | 1,2395 | 1,2822 | 1,2787 |
| 1,5000 | 0,9182 | 1,5157 | 1,2874 | 1,2741 | ||
| 2,0000 | 0,8590 | 1,6536 | 1,3216 | 1,3078 | 1,3098 | |
| 3,0000 | 0,7539 | 2,0075 | 1,3724 | 1,3631 | 1,3522 | |
| 4,0000 | 0,6580 | 2,4422 | 1,3787 | 1,3781 | 1,3772 | |
| 5,0000 | 0,5687 | 2,9138 | 1,3259 | 1,3358 | 1,3738 | |
| 5,5203 | 3,1569 |
Таблица 9
Результаты оценок вязкости раствора NaCl
| C mol/l | теор (29) | теор (41) | теор (41а) | теор (42) | лит [10] | лит [12] | эксп |
| 0,0000 | 0,9507 | 0,9985 | 0,9555 | 1,0320 | 0,8937 | 0,9545 | |
| 0,0010 | 0,9715 | 1,0264 | 0,9850 | 1,0307 | 0,9544 | 0,882 | |
| 0,0030 | 0,9859 | 1,0445 | 1,0045 | 1,0299 | |||
| 0,0050 | 0,9965 | 1,0569 | 1,0178 | 1,0293 | |||
| 0,0100 | 1,0142 | 1,0766 | 1,0393 | 1,0284 | 0,896 | ||
| 0,0500 | 1,0824 | 1,1348 | 1,1062 | 1,0254 | |||
| 0,0700 | 1,0966 | 1,1405 | 1,1149 | 1,0248 | |||
| 0,1000 | 1,1262 | 1,1561 | 1,1340 | 1,0242 | 0,9020 | 0,9583 | 0,9467 |
| 0,1250 | 1,0239 | 0,9053 | 0,9598 | ||||
| 0,2000 | 1,1819 | 1,1655 | 1,1522 | 1,0237 | 0,9653 | ||
| 0,2200 | 1,0238 | ||||||
| 0,2500 | 1,0240 | 0,9154 | 0,9636 | ||||
| 0,5000 | 1,2841 | 1,1494 | 1,1496 | 1,0271 | 0,9361 | 0,9717 | 1,0031 |
| 0,8860 | 1,0345 | 0,9815 | 0,9831 | ||||
| 1,0000 | 1,4018 | 1,1120 | 1,1208 | 1,0370 | 1,063 | ||
| 1,5000 | 1,5053 | 1,0791 | 1,0904 | 1,0486 | 1,0276 | 0,9984 | |
| 1,8300 | 1,0568 | 1,0760 | 1,0051 | ||||
| 2,0000 | 1,6091 | 1,0512 | 1,0622 | 1,0610 | 1,0773 | 1,0091 | 1,12 |
| 3,0000 | 1,8334 | 1,0122 | 1,0191 | 1,0870 | |||
| 4,0000 | 2,1006 | 1,0077 | 1,0081 | 1,1138 | |||
| 5,0000 | 2,4306 | 1,0477 | 1,0400 | 1,1411 | |||
| 5,5203 | 1,1555 |
Таблица 10
Результаты оценок электропроводностей, функции от среднемолярного коэффициента активности, степени диссоциации, параметр экранирования и функции распределения для раствора KCl
| C mol/l | лит [13, 10] | (36) | (37) |
| |
| f |
| 0,0000 | 149,89 | 149,8840 | 149,7958 | 0,0000 | 1,0000 | 1,0000 | 1,0000 |
| 0,0010 | 145,90 | 146,0854 | 146,2624 | -0,0164 | 0,9734 | 1,0092 | 0,9939 |
| 0,0030 | 144,92 | 145,2336 | 145,6019 | -0,0271 | 0,9668 | 1,0160 | 0,9895 |
| 0,0050 | 143,61 | 144,0036 | 144,5005 | -0,0338 | 0,9581 | 1,0207 | 0,9865 |
| 0,0100 | 140,80 | 141,3354 | 142,0616 | -0,0450 | 0,9394 | 1,0292 | 0,9809 |
| 0,0500 | 134,41 | 135,3996 | 137,0724 | -0,0779 | 0,8967 | 1,0653 | 0,9579 |
| 0,1000 | 130,01 | 131,2067 | 133,5506 | -0,0915 | 0,8674 | 1,0924 | 0,9409 |
| 0,5000 | 117,25 | 118,4013 | 123,3921 | -0,0968 | 0,7822 | 1,2066 | 0,8727 |
| 0,7000 | 113,60 | 114,4728 | 120,2643 | -0,0880 | 0,7579 | 1,2445 | 0,8512 |
| 1,0000 | 111,07 | 111,4574 | 118,3158 | -0,0693 | 0,7410 | 1,2922 | 0,8249 |
| 1,5000 | 107,20 | 106,6835 | 114,9154 | -0,0253 | 0,7152 | 1,3579 | 0,7900 |
| 2,0000 | 104,12 | 102,6718 | 112,0035 | 0,0311 | 0,6946 | 1,4132 | 0,7617 |
| 2,2220 | 102,70 | 100,8436 | 110,5826 | 0,0584 | 0,6852 | 1,4356 | 0,7505 |
| 3,0000 | 100,70 | 97,3787 | 108,5911 | 0,1519 | 0,6718 | 1,5061 | 0,7164 |
| 3,5000 | 0,1979 | 1,5466 | 0,6976 | ||||
| 3,9000 | 0,2187 | 1,5770 | 0,6837 | ||||
| 5,0000 | 0,1568 | 1,6534 | 0,6502 | ||||
| 6,0000 | -0,1237 | 1,7157 | 0,6240 | ||||
| 7,0000 | -0,7022 | 1,7731 | 0,6009 |
Таблица 11
Результаты оценок коэффициента диффузии раствора KCl
| C mol/l | Dтеор (30) | Dтеор (35) | Dтеор (38) | Dтеор (40) | Dлит [10] |
| 0,0000 | 1,7234 | 1,7223 | 1,7223 | 1,7234 | 1,7220 |
| 0,0010 | 1,6775 | 1,6941 | 1,6650 | 1,6608 | 1,6969 |
| 0,0030 | 1,6662 | 1,6757 | 1,6476 | 1,6398 | 1,6805 |
| 0,0050 | 1,6512 | 1,6641 | 1,6297 | 1,6196 | 1,6710 |
| 0,0100 | 1,6189 | 1,6449 | 1,5948 | 1,5806 | 1,6563 |
| 0,0500 | 1,5454 | 1,5881 | 1,5304 | 1,5006 | 1,6105 |
| 0,1000 | 1,4948 | 1,5648 | 1,5025 | 1,4626 | 1,5932 |
| 0,2000 | 1,5498 | 1,5880 | |||
| 0,3000 | 1,5477 | 1,5880 | |||
| 0,5000 | 1,3481 | 1,5556 | 1,5025 | 1,4277 | 1,5984 |
| 0,7000 | 1,3062 | 1,5708 | 1,5161 | 1,4321 | 1,6122 |
| 1,0000 | 1,2771 | 1,6030 | 1,5645 | 1,4687 | 1,6347 |
| 1,1800 | 1,6273 | 1,6502 | |||
| 1,5000 | 1,2326 | 1,6788 | 1,6424 | 1,5321 | 1,6788 |
| 2,0000 | 1,1972 | 1,7759 | 1,7273 | 1,6058 | 1,7280 |
| 3,0000 | 1,1578 | 1,9840 | 1,9206 | 1,7810 | 1,8248 |
| 3,5000 | 2,0632 | 1,8662 | |||
| 3,9000 | 2,0990 | 1,8973 | |||
| 5,0000 | 1,9923 | ||||
| 6,0000 | 1,5092 | ||||
| 7,0000 | 0,5129 |
Таблица 12
Результаты оценок вязкости раствора KCl
| C mol/l | теор (29) | теор (41) | теор (41а) | теор (42) | лит [10] | лит [12] | эксп |
| 0,0000 | 0,8669 | 0,8718 | 0,8713 | 1,0536 | 0,8937 | 0,9714 | |
| 0,0010 | 0,8906 | 0,9019 | 0,9041 | 1,0523 | 0,9706 | 0,982 | |
| 0,0030 | 0,8966 | 0,9114 | 0,9157 | 1,0513 | |||
| 0,0050 | 0,9048 | 0,9214 | 0,9272 | 1,0507 | 0,9698 | ||
| 0,0100 | 0,9229 | 0,9416 | 0,9500 | 1,0496 | 0,986 | ||
| 0,0500 | 0,9667 | 0,9812 | 1,0007 | 1,0459 | |||
| 0,1000 | 0,9995 | 0,9994 | 1,0267 | 1,0440 | 0,991 | ||
| 0,2000 | 1,0425 | 0,9682 | |||||
| 0,3000 | 1,0422 | ||||||
| 0,5000 | 1,1082 | 0,9994 | 1,0517 | 1,0433 | 1,005 | ||
| 0,6900 | 1,0454 | 0,8950 | 0,9753 | ||||
| 0,7000 | 1,1438 | 0,9904 | 1,0485 | 1,0456 | |||
| 1,0000 | 1,1699 | 0,9598 | 1,0224 | 1,0499 | 1,012 | ||
| 1,4300 | 1,0574 | 0,9000 | 0,9882 | ||||
| 2,0000 | 1,2480 | 0,8693 | 0,9351 | 1,0685 | 1,03 | ||
| 2,2220 | 1,2652 | 0,8523 | 0,9177 | 1,0730 | 0,9150 | 1,0013 | |
| 3,0000 | 1,2904 | 0,7819 | 0,8431 | 1,0895 | 0,9350 | 1,0157 | 1,04 |
| 3,9000 | 1,1095 | 1,0292 | |||||
| 5,0000 | 1,1348 | ||||||
| 6,0000 | 1,1584 | ||||||
| 7,0000 | 1,1825 |
Таким образом, плазменное приближение при исследовании водных растворов электролитов и составляющих их частиц, основанное на структурном единстве статистической механики для микро- и макроскопических объектов, открывает определенные перспективы для решения ряда проблем систем зарядов.
Прежде всего, это удовлетворительная аппроксимация проблемы диффузии и вязкости растворов электролитов различной концентрации и при различных температурах.
Выводы:
Показана принципиальная возможность объединения таких диссипативных свойств, как электропроводность, вязкость и диффузия.
Предложена новая теоретическая модель расчетов коэффициентов диффузии растворов электролитов, базирующаяся на применении известного уравнения Нернста – Хартли экспериментальных (или теоретических) данных по электропроводности и применении множителя ![]() , учитывающего колебательный характер равновесия “диссоциация – рекомбинация ионов” и силу сопротивления среды осциллирующими ионами.
, учитывающего колебательный характер равновесия “диссоциация – рекомбинация ионов” и силу сопротивления среды осциллирующими ионами.
Способ не требует введения подгоночных параметров и позволяет оценивать D от нулевых разбавлений до концентрированных растворов электролитов.
Используя уравнение Стокса – Эйнштейна показана возможность приближенного определения вязкости растворов электролитов используя найденные значения диффузии в большой области концентраций электролитов без подгоночных параметров.
Также рассмотрен известный способ теоретической оценки вязкости водных растворов электролитов, основанный на новой интерпретации подвижности.
Список литературы
Балданов М. М., Мохосоев М. В. //Докл. АН СССР. 1985. Т. 284. №6. с. 1384.
Балданов М. М. //Изв. Вузов. Химия и хим. технология. 1986. Т. 29. №8. с. 38.
Балданов М. М., Танганов Б. Б., Мохосоев М. В. Электропроводность водных растворов слабых кислот //Докл. АН СССР. 1988, Т. 299, №4, с. 899-904.
Балданов М. М., Танганов Б. Б., Мохосоев М. В. Электропроводность растворов и кинетическое уравнение Больцмана //Журн. Физ. Химии. 1990, Т. 64, №1, с. 88-94.
Балданов М. М., Танганов Б. Б. Проверка теории электропроводности на метанольных растворах электролитов //Журн. Физ. Химии. 1992, Т. 66, с. 1263-1271.
Балданов М. М., Танганов Б. Б., Мохосоев М. В. Метод расчета электропроводности спиртовых растворов электролитов //Журн. Физ. Химии. 1992, Т. 64, с. 1263-1271.
Балданов М. М., Танганов Б. Б. Применение уравнения электропроводности для оценки констант диссоциации электролитов и количественного определения бинарных электролитов //Региональная конференция “Аналитика Сибири и Дальнего Востока – 93”. Тезисы докладов. – Томск, 1993. – с. 19.
Stokes G. G. //Trans. Camb. phil. Soc., 1845, V. 3, p. 287.
К.Б. Яцимерский, В.К. Яцимерский, “Химическая связь”. Киев: Изд. Вища школа, 1975, с. 70.
Справочник химика. Т. III. М. – Л.: Химия. 1965, с. 672, 719.
Дзюба С.А., Попов В.И., Моралев В.И., Цветков Ю.Д. Определение коэффициентов диффузии парамагнитных частиц на основе концентрационной зависимости формы спектров ЭПР //Журн. физ. химии. 1987, Т. 51, №8, с. 2188-2193.
Краткий справочник физико – химических величин. Изд. 8-е, перераб./Под ред. А. А. Равделя и А. М. Пономаревой. – Л.: Химия, 1983. – 232 с.
Лобо В. М. М. //Электрохимия, 1991, Т.27, с.613.
Для подготовки данной работы были использованы материалы с сайта http://www.sciteclibrary.ru/
0 комментариев