Навигация
Синтез тетрахлорида олова
1. Синтез тетрахлорида олова.
| Вещество | Молярная масса, М г/моль | Масса m, г | Кол-во вещества, ν моль | Физические константы | ||
| mтеор | mпракт | νтеор | νпракт | |||
| Олово | 119 | 38,84 | 38,84 | 0,326 | 0,326 | |
| Оксид марганца (IV) | 87 | 56,72 | 150 | 0,652 | 1,72 | |
| Соляная кислота | 36,5 | 95,19 | 473,2 | 2,61 | ω = 36,5% ρ = 1,183г/мл | |
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
Sn + 2Cl2 = SnCl4
Собрать прибор (рис. 6) и тщательно высушить его.
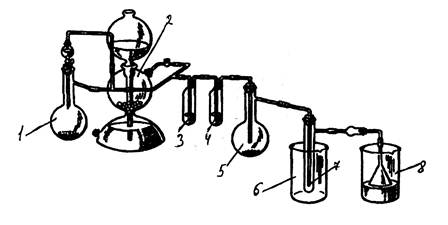
Рис 6. Прибор для получения хлорида олова (IV).
В колбу Вюрца емкостью 500 мл (1) засыпали оксид марганца (IV), в капельную воронку залили концентрированную соляную кислоту. В аппарат Киппа (2) засыпали мрамор (карбонат кальция), залили соляную кислоту. В реакционную колбу на 25 мл (5) засыпали металлическое олово. В промывалку (3) налили дистиллированную воду, в промывалку (4) – 96%-ю серную кислоту. В химический стакан (6) засыпали лёд. Хлоркальциевую трубку заполнили хлоридом кальция, воронку опустили в стакан со щёлочью (8).
Открыв кран на аппарате Киппа, продували прибор углекислым газом около 15 мин:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Прекратив подачу CO2, открыли капельную воронку, начали нагревать колбу (1):
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
Когда колба (5) заполнится хлором, начали нагревать её.
Sn + 2Cl2 = SnCl4
Олово начало гореть жёлто-белым пламенем. Нагрев возобновляли только в случае замедления реакции. По окончании реакции пробирка (7) заполнилась жёлтой жидкостью – хлоридом олова (IV).
Выход:
m(SnCl4)практ = 18,49 г
ν(SnCl4)теор = ν(Sn) = 0,326 моль
m(SnCl4)теор = ν(SnCl4)*M(SnCl4) = 0,326*261 = 85,09 г
ω = ![]() =
= ![]() =
= ![]()
2. Идентификация тетрахлорида олова.
1) К полученному веществу прилили несколько капель водного раствора аммиака. Выпал белый осадок (α-оловянная кислота):
SnCl4 + 4NH4OH = H2SnO3↓ + 4NH4Cl + H2O
Этот осадок легко растворяется как в кислоте, так и в щёлочи:
H2SnO3 + 4HCl = SnCl4 + H2O
H2SnO3 + 2NaOH + H2O = Na2[Sn(OH)6]
2) К 2-3 каплям полученного вещества добавили 1 каплю концентрированной соляной кислоты, железные опилки и нагрели до появления пузырьков. Затем к раствору прибавили 2 капли раствора нитрата ртути (II). Выпал белый осадок:
Fe + SnCl4 = FeCl2 + SnCl2
SnCl2 + 2Hg(NO3)2 = Hg2Cl2↓+ Sn(NO3)4
3) На предметное стекло нанесли 1 каплю раствора полученного вещества, внесли кристаллик хлорида цезия. Вокруг кристаллика появился белый осадок:
H2[SnCl6] + 2CsCl = Cs2[SnCl6]↓ + 2HCl
Таким образом, на основе проведённых реакций, а также на основе метода синтеза можно сказать, что мы получили хлорид олова (IV).
Выводы.
Была собрана и изучена литература по тетрахлориду олова.
Был проведён синтез тетрахлорида олова.
С помощью качественных реакций было идентифицировано полученное вещество.
Список литературы
Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. – 3-е изд., перераб. и доп. – М.: Высш. шк., 1998. – 743 с., ил.
Никольский, А.Б. и др. Химия.- Санкт-Петербург, 2001.- C. 326-328
Спицын В.И., Мартыненко Л.И. Неорганическая химия. Ч II: Учебник. – М.: Изд-во МГУ, 1994. – 624с: ил.
Фадеева, В.И. и др. Основы аналитической химии.- Москва, 2001.
Свиридов В.В. и др. Неорганический синтез: Учеб. пособие / В.В. Свиридов, Г.А. Попкович, Е.И. Василевская. – 2-е изд., испр. – Мн.: Унiверсiтэцкае, 2000. – 224 с.
Карякин Ю.В., Ангелов И.И. Чистые химические вещества. Изд. 4-е, пер. и доп. М., «Химия», 1974. 408 с., 66 рис.
Похожие работы
... из спирта. Получили 5,57г (выход 57%) 4-бром-4’-гидроксибифенила. т. пл. 163-1650. Лит.данные [3]: т.пл. 164-166о. 3. Обсуждение результатов Целью данной работы был синтез 4-бром-4’-гидроксибифенила. Мы рассмотрели три возможные способы его получения: 1) реакция кросс-сочетания; 2) ацилирование 4-бромбифенила с последующей реакцией Байера-Вилигера; 3) из соли 4-бромфенилдиазония. Поскольку ...
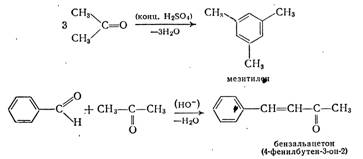
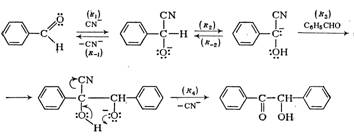
... вытяжку соединяют с органическим слоем из смеси, объединенный органический раствор в делительной воронке промывают 5 мл воды и отделяют водный слой. Сначала отгоняют бензол на водяной бане, потом бензальацетон в вакууме. Причем первые несколько миллилитров дистиллята, имеющего зеленоватый оттенок, отделяют. Собирают фракцию с температурой кипения 148—160°С (25 мм рт. ст.), имеющую светло-желтый ...
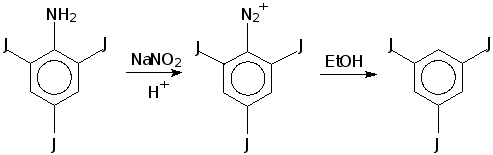
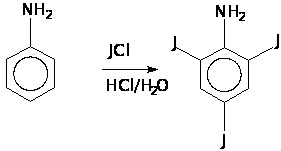
... порции осадка была равна 18,1 г, второй порции - 2,0 г, суммарная масса обеих порций - 20,1 г. Таким образом, выход 2,4,6-трийоданилина составил 99% от теоретически рассчитанного. 3.3. Синтез 1,3,5-трийодбензола 18 г 2,4,6-трийоданилина растворили при кипячении в 225 мл бензола и 45 мл этанола, добавили 9 мл концентрированной серной кислоты и 9 г твердого нитрита натрия, кипятили до окончания ...
... кристаллы отсасывают, промывают небольшим количеством ледяной воды и сушат при 110оС. Соли можно перекристаллизовывать из воды. NH3 + HReO4 = NH4ReO4 [12] По этой методике был проведен синтез перрената аммония. К 7 мл. концентрированной рениевой кислоты прилили 11 мл. раствора аммиака. В качестве индикатора использовался метилрот ( pH 6.2 - 6.4 ). Белый осадок перрената аммония ...




0 комментариев