Навигация
Определение содержания комплемента в сыворотке крови
2.1.8. Определение содержания комплемента в сыворотке крови.
Исследовали сыворотку крови, полученную из яремной вены животных. Предварительно готовили веронал-мединаловый буфер: 0,575 г веронала растворяли в 50 мл дистиллированной воды, подогретой до 60° С, охлаждали и добавляли 8,5 г хлорида натрия, 0,375 г мединала, 0,5 мл раствора содержащего 1 М MgCl2 и 0,3 М CaCl2 (100 мл Н2О + 19 г MgCl2×6Н2О г + 6 г CaCl2). Объем доводили до 200 мл дистиллированной водой. Буфер хранили в холодильнике. Перед употреблением буфер разводили дистиллированной водой (1:4). Физиологический раствор: 8,5 г хлорида натрия растворяли в 1 л дистиллированной воды и фильтровали.
Эритроциты барана. Кровь у барана брали из яремной вены в колбу с бусами и встряхивали в течение 10-15 мин для предотвращения свертывания. Дефибринированную кровь фильтровали через двойной слой марли. Эритроциты барана отмывали 3 раза центрифугированием по 10 мин при 3000 об/мин. Из отмытых эритроцитов готовили 5 % взвесь на физиологическом растворе и стандартизовали на ФЭК. С этой целью эритроциты лизировали: к 1 мл отмытых эритроцитов добавляли 9 мл дистиллированной воды. Лизированные эритроциты фотоколориметрировали при зеленом светофильтре против воды. Оптическая плотность лизата — 1,08 при длине 541 мкм в кювете 10 мм.
Для определения титра гемолизина, готовили вначале основное разведение гемолитической сыворотки 1:100 (0,1 мл сыворотки + 9,9 мл буфера), затем из этого разведения поучали разведения от 1:1000 до 1:4000.
| 1:1000 | 1:1200 | 1:1500 | 1:2000 | 1:2500 | 1:3000 | 1:3500 | 1:4000 | |
| Буфер, мл | 0,9 | 1,1 | 1. 4 | 1,9 | 2,4 | 2,9 | 3,4 | 3,9 |
| Гемолизин | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
Гемолитическую систему готовили следующим образом. К стандартизованной 5 % взвеси эритроцитов барана медленно, при постоянном помешивании, добавляли равный объем гемолизина в тройном титре. Так, если полный гемолиз наблюдался в пробирке с разведением гемолитической сыворотки 1:1200, то для приготовления гемолитической системы брали разведение 1:400 (0,1 мл цельной гемолитической сыворотки и 39,9 мл буфера). Пробирки с гемолитической системой встряхивали и инкубировали при 37° С в течение 1ч для сенсибилизации эритроцитов барана.
Исследуемую сыворотку, разводили 1:10, разливали в 10 пробирок и доводили буферным раствором (физиологическим) до 1,0 мл. После этого в каждую пробирку добавляли 1 мл гемолитической системы, то есть сенсибилизированных эритроцитов барана, 2-я пробирка — контрольная.
| Исследуемая сыворотка (1:10), мл | 0,05 | 0,1 | 0,15 | 0,2 | 0,25 | 0,3 | 0,35 | 0,4 | 0,45 | 0,5 |
| Буферный раствор | 0,95 | 0,9 | 0,85 | 0,8 | 0,75 | 0,7 | 0,65 | 0,6 | 0,55 | 0,5 |
| Сенсибилизированные эритроциты барана | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
Пробирки инкубировали при 37° С в течение 45 мин, охлаждали в холодильнике 10 мин, центрифугировали при 1500 об/мин и колориметрировали на ФЭК в кюветах (10мм) с зеленым светофильтром против воды и определяли процент гемолиза.
Для определения активности комплимента в гемолитических единицах готовили шкалу и кривую гемолиза. Для приготовления шкалы гемолиза к 1 мл стандартной 5 % взвеси эритроцитов барана прибавляли 3 мл дистиллированной воды в результате чего происходил гипотонический лизис эритроцитов (100 % гемолиз). Пробирку центрифугировали (при 1500 об/мин 10 мин) и готовили шкалу гемолиза:
| 100 % гемолиз эритроцитов на дистиллированной воде | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
| Буферный раствор, мл | 0,9 | 0,8 | 0,7 | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | 0,1 | 0 |
| Гемолиз, % | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
Полученные разведения и исходный раствор колориметрировали на ФЭК в кюветах (1 мм) и строили график зависимости коэффициентов экстинции от процента гемолиза. На оси абсцисс откладывали процент гемолиза, на оси ординат — показатели экстинции, соответствующие данному проценту гемолиза.
Расчет 50 % гемолитических единиц комплемента в 1 мл проводили следующим образом. После титрования исследуемой сыворотки, инкубации ее при 37° С в течение 45 мин, выдержки в течение 10 мин в холодильнике при 4° С и центрифугирования пробирку из шкалы гемолиза с одной 50 % единицей комплемента (№5) сравнивали с пробирками из ряда титрования сыворотки. Если содержимое пробирки №5 соответствовало по цвету пробирке №6, из ряда титрования комплемента исследуемой сывороткой, то есть дозе комплемента 0,3 мл, то расчет вели следующим образом.
0,3 мл сыворотки (разведение 1:10) соответствует одной 50 % гемолитической единице комплемента, а в 1 мл исследуемой сыворотки содержится:
0,3 мл (1:10) — 1
1,0 мл — Х
Х =![]() = 3,33 ел/мл.
= 3,33 ел/мл.
2.1.9. Определение содержания пропердина в сыворотке крови. Для определения титра пропердина исследуемую сыворотку разводили мединал-вероналовым буфером (рН 7,2-7,4), начиная с 1:10 до 1:320. В центрифужные пробирки вносили по 0,2 мл каждого разведения сыворотки, до 0,2 мл суспензии инулина (соответствует 3 мг сухого вещества) и по 0,2 мл комплемента в рабочем титре. В контрольный ряд пробирок вместо инулина добавляли по 0,2 мл буфера. Все пробы (опытные и контрольные) помещали на 1 ч в термостат при 37° С, после чего центрифугировали, переносили супернатант в отдельные пробирки по 0,3 мл и добавляли по 0,2 мл стандартной гемолитической системы. Реакцию учитывали после 20-минутной экспозиции при 37° С. За титр пропердина принимали то наибольшее разведение сыворотки, в котором наблюдается полная задержка гемолиза, и в каком разведении в контрольном ряду отличается полный гемолиз. Данные рассчитывали по формуле:
| Разведение, в котором отмечен полный гемолиз в контроле | — | Разведение, в котором отмечена полная задержка гемолиза в опыте | ×10 |
| Разведение, в котором отмечен полный гемолиз в контроле | |||
Полученные результаты выражали в ед/мл. При полной задержки гемолиза в разведении 1:35 в опыте, а в контроле — полный гемолиз в разведении 1:50, содержание пропердина в 1 мл испытуемой сыворотки составляет:
![]() ×10 = 3 ед/мл.
×10 = 3 ед/мл.
Тестированные показатели: комплементарную, лизоцимную, пропердиновую активность, а также содержание иммуноглобулинов в сыворотке крови, молоке и молозиве крупного рогатого скота определяли по методам В. Г. Дорофейчук, 1968; X. Я. Грант, Л. И. Яворский, И. А. Блумберг, 1973; И. М. Архангельский, 1976; В. Н. Андреев, Г. И. Подопригора, 1977; Е. С. Фортинская, А. М. Наумова, Е. А. Маркова, 1977; О. Н. Грызлова, П. А. Емельяненко, В. Н. Денисенко, 1978; Э. Бем, 1979; П. А. Емельяненко, О. И. Грызлова, Г. Н. Печникова и М. Н. Тулупова, 1980; Э. С. Коган, 1981; Г. В. Павлов, Г. Н. Печникова, Смолянская- О. О. Суворова, 1988; В. В. Биктимиров, 1993.
При определении лизоцима, учитывая замедленную активность фермента крупного рогатого скота, приводили тщательную подготовку материалов к исследованию, чтобы избежать ошибок, связанные с действием на тест-микробы других литических факторов исследуемой пробы.
При тестировании комплементарной активности сыворотки крови тщательно осуществляли подбор индикаторной системы чувствительной к комплементу крупного рогатого скота.
Для определения пропердина использовали модифицированный метод предложенный П. А. Емельяненко и др., 1980.
2.1.10. Изучение бактерицидной активности сывороток крови. Для определения бактериостатической и бактерицидной активности сывороток крови О. В. Смирнова, Т. А. Кузьмина (1966) предложили фотонефелометрический метод.
В нашей работе мы учитывали изменения оптической плотности питательной среды с микробами и питательной среды с испытуемой сывороткой крови и микробами сразу после соединения и через 3-, 5-, 7-, 9-, 12- и 24-часовой инкубации.
Для нефелометрического метода чистую культуру Е. coli высевали на МПА и выращивали в термостате при температуре 37° С в течение 24 ч. Затем смывали стерильным изотоническим раствором хлористого натрия и стандартизовали до содержания в 1 мл 2 млрд. микробных тел. Из этой взвеси производили посев на МПБ в пробирки и сутки выращивали в термостате при вышеуказанной температуре.
Для определения бактерицидной активности сывороток крови мы использовали питательную среду (обогащенный пептоном бульон Хоттингера), содержащую 200 мг% амминного азота.
В стерильные кюветы с рабочей длиной 10 мм стерильной пипеткой разливали по 4,5 мл бульона Хоттингера, затем добавляли по 0,5 мл испытуемой сыворотки крови и суточную бульонную культуру Е. coli по одной бактериологической петле (диаметр петли 4 мм).
Контрольные кюветы заполняли теми же компонентами, что и опытные с той лишь разницей, что в один кювет вместо сыворотки добавили 0,5 мл стерильного изотонического раствора хлорида натрия. Содержимое всех кювет тщательно перемешивали стерильной стеклянной палочкой, после чего все кюветы закрывали ватно-марлевыми пробками. Оптическую плотность среды определяли на фотоэлектроколориметре ФЭК-М, используя зеленый светофильтр. После этого кюветы ставили в термостат при температуре 37° С. Повторно определяли оптическую плотность содержимого кювет через 3, 5, 7, 9, 12 и 24 ч. Установку «0» на ФЭК-е производили с помощью кюветы, заполненной дистиллированной водой. Оценку бактерицидной активности сыворотки крови проводили по формуле:
А=100- 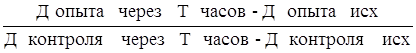 ×100,
×100,
Где: А — бактерицидная активность (в %);
Д — оптическая плотность;
Т — время экспозиции кювет в термостате (в часах).
Затем вычисляли среднюю «напряженность бактерицидной активности» (НБА) по формуле:
Средняя НБА = 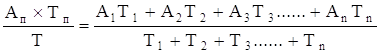 ,
,
Где: НБА — средняя напряженность бактерицидной активности молозивной сыворотки;
А1, А2, А3.....Аn — бактерицидная активность сыворотки молозива через 3, 5, 7, 9, 12 и 24ч (в %);
Т1, Т2, Т3....... Тn — продолжительность термостатирования (в часах).
2.1.11. Постановка опсонофагоцитарной реакции. При постановке опсонофагоцитарной реакции руководствовались методикой, описанной В. Я. Мозгис (1982). Для приготовления антигена культуру Е. coli выдерживали в термостате при температуре 37° С в течение 18-24 ч в МПБ, а затем на МПА в течение 24 ч. Проверяли на чистоту и смывали стерильным изотоническим раствором хлорида натрия. По оптическому стандарту доводили концентрацию до 2-х млрд. микробных тел в 1 мл. Приготовленную взвесь нагревали в водяной бане при 70° С в течение 30 мин.
Для опсонофагоцитарной реакции применяли только суточную агаровую культуру Е. coli.
Исследования проводили в следующей последовательности. В пронумерованные стерильные пробирки наливали до 0,5 мл 2 % прокипяченного и охлажденного раствора лимоннокислого натрия, 1 мл крови от исследуемых телят и тщательно смешивали, сюда же вносили по 0,5 мл антигена. После осторожного перемешивания пробирки помещали в термостат при 38° С на 3 мин, предварительно погрузив их на 2-3 мин в водяную баню с температурой 38° С. Затем пробирки из термостата извлекали, готовили мазки, сушили на воздухе, нумеровали, фиксировали в метиловом спирте в течение 5 мин и окрашивали по Романовскому-Гимза.
Для приготовления рабочего раствора краски, дистиллированную воду усредняли фосфатными буферами: 1. Двухосновной фосфат натрия (Na2HPO4×12H2O) — 17,814 г на 1 л (рН 8,302). 2. Одноосновной фосфат калия (KH2PO4) — 13,638 г на 1 л (рН 4,529). Если к литру дистиллированной воды прибааляли по 5 см3 того и другого раствора, то рН такой воды был равен 6,813.
Краску готовили ex tempore из расчета 1,5 капли краски на 1 мл усредненной воды с рН 6,813. Мазки окрашивали в течение 45 мин, промывали водопроводной водой и высушивали на воздухе. Окрашенные мазки исследовали под иммерсионной системой микроскопа и окуляра 7×.
Подсчет фагоцитированных микробов производили в 100 нейтрофилах. На основе подсчета определяли фагоцитарную интенсивность (среднее число поглощенных микробов одним нейтрофилом) и фагоцитарную активность (процент фагоцитирующих нейтрофилов). С кровью подопытных животных поставили 450 реакций.
Похожие работы
... новорожденных (в одном секторе, секции и т.д.) поросят и телят с разницей в возрасте не более 3-4 дней, т.е. с учетом особенностей становления кишечной микрофлоры. III. Пути повышения резистентности сельскохозяйственных животных Появление новых физических (радиация), химических (гормоны, антибиотики, пестициды, диоксины) и биологических (ВИЧ-инфекция, прионы) факторов, в том числе ...
... через 13, перманганат калия 1 : 1000 через 10 мин. Микроб очень чувствителен к антибиотикам тетрациклинового ряда, в меньшей степени — к пенициллину и синтомицину, устойчив к мицелину и колимицину. Эпизоотология. В естественных условиях болеют овцы независимо от возраста, пола и породности. Из лабораторных животных чувствительны кролики и белые мыши, менее восприимчивы морские свинки, голуби. ...
... но и после убоя при нарушении правил убоя, разделки и хранения мяса. САРКОСПОРИДИОЗЫ Саркоспоридиозы (саркоцистозы) - хронические, как правило, бессимптомно протекающие инвазионные болезни домашних и диких животных, а также человека. Возбудители - простейшие организмы саркоцисты. Характеризуются образованием в мышечной ткани цист (мишеровых мешочков), наполненных различными элементами. ...
... стоматит, который протекает так же, как ящур, с поражением конечностей. Однако эта болезнь поражает не только крупный рогатый скот, но и лошадей, ослов. Для дифференциации его от ящура прибегают к заражению патологическим материалом лошадей или ослов. Биопробу можно ставить на взрослых мышах, которые чувствительны к вирусу везикулярного стоматита, или на мышатах-сосунах (чувствительны к вирусу ...
0 комментариев