Навигация
Реакции электрофильного присоединения протекают медленнее, чем для нонена. Продукты определяются правилом Марковникова
1. Реакции электрофильного присоединения протекают медленнее, чем для нонена. Продукты определяются правилом Марковникова.
а) Галогенирование. Нонин обесцвечивает бромную воду:
Br2 Br2
C7H15-C≡CH → C7H15-CBr=CHBr→ C7H15-CBr2-CHBr2
б) Гидрогалогенирование:
HCl HCl
C7H15-C≡CH → C7H15-CCl=CH2 → C7H15-CCl2-CH3
в) Гидратация (реакция Кучерова) протекает в две стадии. На первой стадии образуется неустойчивый непредельный спирт, который затем изомеризуется в кетон.
Hg2+,H+
C7H15-C≡CH + Н2О ―→ [C7H15-C(OH)=CH2] → C7H15-CО-CH3
2. Реакции окисления и восстановления.
а) Окисление перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
C7H15-C≡CH + 3[O] + H2O → C7H15-COOH + H-COOH
б) Гидрирование при нагревании с металлическими катализаторами:
Н2 Н2
C7H15-C≡CH → C7H15-CН=CH2 → C7H15-CН2-CH3
3. Качественные реакции на тройную связь – обесцвечивание бромной воды и раствора перманганата калия.
Применение:
В органическом синтезе.
Спирты.
Нониловый спирт.
Нонанол-1.
Молекулярная формула:
C9H19OH
Структурная формула:
CH3–CН2–СН2–СН2-СН2–СН2–СН2–СН2-СН2-OH
 |
Электронная формула:
Электронная плотность:
С9H19→O←H
Вид связи:
В молекуле нонилового спирта имеется 29 d -связей, d- связи C-C , C-H , C-O и O-H с углами между связями 109,5°.
Образование связей:
В спиртах атомы углерода находятся в состоянии sp3-гибридизации и способны образовывать 4 d -связи каждый.
Изомерия:
1) Изомерия углеродного скелета 2) Изомерия положения гидроксильной группы 3) Межклассовая изомерия с простыми эфирами.
а) CH3-CH2-CH2-CH2-CH2-CH-CH2-CH2-OH
│
CH3
3метилоктанол-1
б) CH3-CH2-CH-CH2-CH2-CH2-CH2-CH2-CH3
|
OH
нонанол-3
в) C5H11-O-C4H9
пентилбутиловый эфир
Нахождение в природе:
В виде различных соединений.
Получение:
1.Гидратация алкенов:CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH=CH2+H2O→CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH-CH3
│
OH
2. Гидролиз алкилгалогенидов под действием водных растворов щелочей.
C8H17-CH2Br+NaOH→C8H17-CH2-OH+NaBr
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичные спирты, а кетонов – вторичные:
а) C8H17-CH=O+2[H]→C8H17-CH2-OH
б) C7H15-CO-CH3+2[H]→C7H15-CH(OH)-CH3
4. Действие реактивов Гриньяра R-MgBr на карбонильные соединения:
H2O
H2CO+C8H17MgBr→ C8H17-CH2-O-MgBr→ C8H17-CH2-OH
-Mg (OH) Br
Физические свойства:
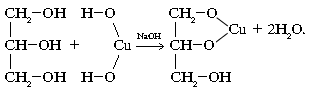
Нониловый спирт (в нормальных условиях) –жидкость. Нониловый спирт хорошо растворим в воде.
Химические свойства:
1.Реакции с разрывом связи O-H.
а) Реакции со щелочными металлами:
2C9H19-OH+2K→2C9H19-OK+H2↑
б) Образование сложных эфиров под действием минеральных и органических кислот:
H+
CH3-CO-OH + H-O-C9H19→CH3-CO-O-C9H19+H2O
Атом водорода отщепляется от спирта, а группа OH -от кислоты.
в) Окисление спиртов под действием перманганата калия. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
[O] [O]
C8H17-CH2-OH→C8H17-CH=O→C8H17-COOH
2.Реакции с разрывом связи C-O.
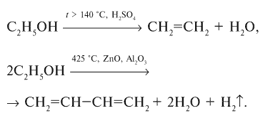
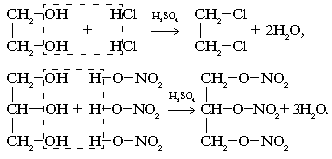
а) Внутримолекулярная дегидратация с образованием алкенов:
H2SO4
CH3–CН2– CН2-СН2-СН2–СН2–СН2–СН2-СН2-OH→CH3–CН2– CН2-СН2–СН2-СН2–СН2–СН=СН2+H2O
t>150°C
б) Межмолекулярная дегидратация с образованием простых эфиров:
H2SO4
2C9H19OH→C9H19-O-C9H19 + H2O
t<150°C
в) Слабые основные свойства проявляются в обратимых реакциях с галогеноводородами:
C9H19OH + HBr→C8H17-CH2Br+H2O
Применение:
Нонанол применяют в виде уксусного эфира в качестве растворителя, также используют в разнообразных органических синтезах.
Карбонильные соединения.
Альдегиды.
Нонаналь.
Молекулярная формула:
C9H18О
Структурная формула:
CH3–CН2–СН2–СН2-СН2–СН2–СН2–СН2-СН=O
 |
Электронная формула:
Электронная плотность:
∩
C8H17→С→O
↑
Н
Вид связи:
В молекуле нонаналя имеется 28 d -связей, d- связи C-C , C-H и C=O с углами между связями 109,5° и одна π –связь С═О.
Образование связей:
В альдегидах атомы углерода находятся в состоянии sp3-гибридизации и способны образовывать 4 d -связи каждый.
Изомерия:
1) Изомерия углеродного скелета 2) Межклассовая изомерия с кетонами.
а) CH3-CH2-CH2-CH2-CH2-CH-CH2-CH=O
│
CH3
3метилоктаналь
б) CH3–CН2–СН2–СН2-СН2–С–СН2–СН2-CH3
││
O
нонанон4
Нахождение в природе:
В виде различных соединений.
Получение:
1. Окисление первичных спиртов:
C8H17-CH2-OH+CuO→ C8H17-СH=O+Cu+H2O
2. Гидролиз дигалогеналканов:
C8H17-СHCl2+NaOH→ C8H17-СH=O+2NaCl+H2O
Физические свойства:
Нонаналь (в нормальных условиях) –легкокипящая жидкость. Нонаналь хорошо растворим в воде.
Химические свойства:
Похожие работы
... кости, с/х. культуры, быта. Все эти стороны органической химии раскроются перед вами в проессе дальнейшего изучения науки. Глава 1. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ЭЛЕКТРОННАЯ ПРИРОДА ХИМИЧЕСКИХ СВЯЗЕЙ § 1. ПРЕДПОСЫЛКИ ТЕОРИИ СТРОЕНИЯ Подобно тому, как в неорганической химии при изучении элементов и их соединений мы постоянно руководствовались периодическим законом и ...
... к импедансным измерениям Использовали нарезанный листовой цинк, размеры которого замеряли штангенциркулем. Электроды полировали стеклянным порошком до зеркального блеска, промывали дистиллированной водой, обезжиривали спиртом, осушали фильтровальной бумагой и использовали для определения адсорбции органических соединений. 2.3 Методика емкостных измерений Исследования проводили в 3-х ...
... и др. Пропанид и другие анилиды, кроме того, обладают гемолитическим действием. Препараты группы 2,4-Д нарушают воспроизводительную функцию животных [5,6]. ГЛАВА 4. МОИ УРОКИ Урок: Кислородсодержащие органические соединения Цели. Обобщить знания учащихся по данной теме, в игровой форме проверить их уровень знаний и навыки. Оборудование. На демонстрационном столе – химические реактивы, ...
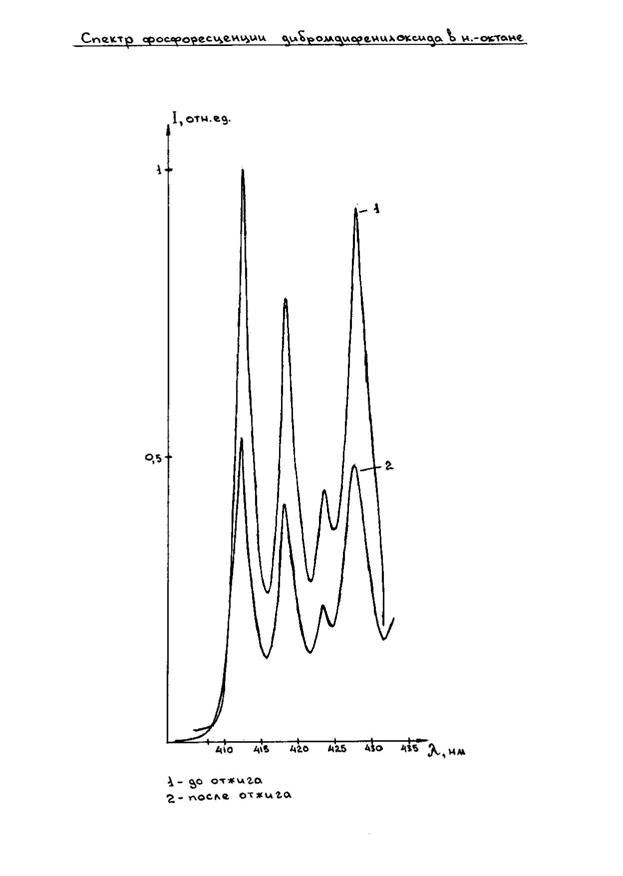
... между молекулами были установлены В.Л Ермолаевым при изучении данного явления для органических соединений в твердых растворах. Эти закономерности были выявлены на основании изучения влияния акцептора на параметры фосфоресценции донора и особенностей сенсибилизированной фосфоресценции. При экспериментальном изучении явления сенсибилизированной фосфоресценции донорно-акцепторные пары обычно ...

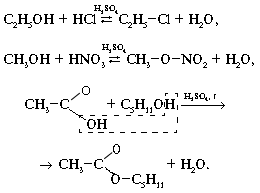
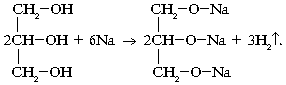

0 комментариев