Электролиз – окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита.
При электролизе энергия электрического тока превращается в химическую энергию, иначе говоря, осуществляется процесс, обратный по характеру происходящему в гальваническом элементе. Как и в случае гальванического элемента, на аноде происходит окисление, а на катоде – восстановление. Но при электролизе анодом является положительный электрод, а катодом – отрицательный.
Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, плотность тока и т.д.).
Различают электролиз расплавов и растворов электролитов.
Электролиз расплавов электролитов.
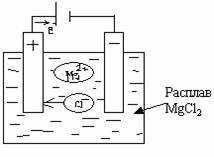
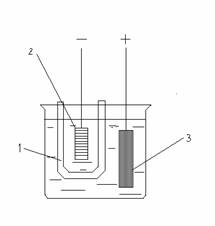
Электролиз расплава соли с использованием инертных электродов показан на следующей схеме:
Анод![]()
При высоких температурах расплав соли диссоциирует на ионы:
![]() .
.
Прохождение электрического тока через расплав обусловлено тремя одновременно протекающими процессами:
направленное движение катионов Мg2+ к катоду, а анионов Cl- - к аноду;
восстановление, происходящее на катоде:
![]()
окисление, происходящее на аноде:
![]()
Суммарное уравнение электролиза после уравнивания числа отдаваемых и присоединенных электронов принимает вид:
![]()
Схематически весь процесс можно представить следующим образом:
![]()
![]()
![]()
![]()
![]() Катод (-) Анод ( + )
Катод (-) Анод ( + )
Mg2+ 2Cl-
![]() Mg2+ + 2e- = Mg 2Cl- - 2e- = Cl2
Mg2+ + 2e- = Mg 2Cl- - 2e- = Cl2
![]()
Электролиз растворов электролитов
Электролиз растворов электролитов более сложен из-за возможности участия в электродных процессах молекул воды в восстановлении на катоде:
![]()
и окислении на аноде:
![]()
![]() .
.
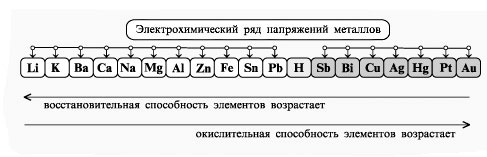
В тех случаях, когда на одном и том же электроде возможно протекание двух или большего числа процессов, наиболее вероятен тот, осуществление которого связано с минимальной затратой энергии. Это означает, что на катоде восстанавливаются в первую очередь окисленные формы окислительно-восстановительных систем с наибольшим электродным потенциалом, а на аноде окисляются восстановленные формы с наименьшим электродным потенциалом.
Для определения порядка протекания окислительно-восстановительных процессов на электродах при электролизе водных растворов можно руководствоваться следующими практическими правилами.
Катод.
В первую очередь восстанавливаются катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода, в порядке уменьшения Ео.
Катионы металлов с малым стандартным электродным потенциалом (от Li+ до Al3+ включительно) не восстанавливаются, а вместо них восстанавливаются молекулы воды (в кислой среде – ионы Н+).
Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия, восстанавливаются одновременно с молекулами воды.
Анод.
Характер окислительных процессов зависит также от материала электродов. Различают нерастворимые (инертные) и растворимые (активные) электроды.
Инертные электроды изготавливаются обычно из графита, угля, платины; в процессе электролиза они химически не изменяются, а служат лишь для передачи электронов во внешнюю цель.
При использовании инертных анодов следует учитывать следующее:
В первую очередь окисляются простые анионы в порядке возрастания их Ео, не превышающих + 1,5 В (S2-, J-, Br-, Cl-).
При электролизе водных растворов, содержащих анионы кислородосодержащих кислот (CO32-, NO3-, SO42-, PO43- и др.), на аноде окисляются не эти анионы, а молекулы воды.
В щелочных растворах на аноде окисляются ионы ОН-:
![]()
При использовании растворимых анодов (из Cu, Zn, Ag, Ni и др. металлов) электроны во внешнюю цель посылает сам анод за счет окисления атомов металла, из которого сделан анод:
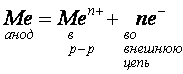 .
.
Рассмотрим конкретные примеры.
Электролиз водных растворов солей (инертные электроды)
![]()
![]() 1)
1) ![]()
![]()
![]() ( - ) Катод Анод ( + )
( - ) Катод Анод ( + )
Na+, Н2О Cl-, H2O
![]()
![]()
![]()
![]()
![]()
![]()
![]() 2)
2) ![]()
![]()
![]() ( - ) Катод Анод ( + )
( - ) Катод Анод ( + )
4К+, 4Н2О SO42-, Н2О
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3)
3) ![]()
( - ) Катод Анод ( + )
Zn2+, H2O SO42-, H2O
![]()
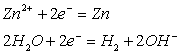
![]()
![]()
![]()
![]()
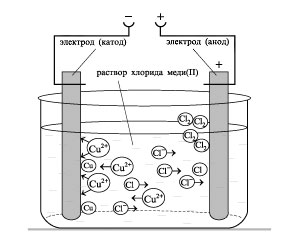
4) Электролиз водного раствора CuCl2 (активный медный анод)
![]()
![]()
![]()
![]()
![]() ( - ) Катод Анод ( + )
( - ) Катод Анод ( + )
Cu2+, H2O 2Cl-, H2O
![]()
![]()
![]()
![]()
![]()
Количественные характеристики электролитических процессов устанавливаются двумя законами Фарадея:
Масса веществ, выделившихся на электродах при электролизе, прямо пропорциональна количеству электричества, прошедшего через раствор или расплав электролита.
При пропускании одинакового количества электричества через растворы или расплавы различных элементов масса веществ, выделяющихся на электродах, пропорциональна молярным массам их эквивалентов.
Экспериментально установлено, что для выделения на электроде одной молярной массы эквивалента вещества необходимо затратить одно и то же количество электричества, равное ~96500 Кл. Оно получило название постоянной Фарадея F.
Оба закона можно объединить общей формулой:
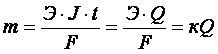 ,
,
где m – масса окисленного или восстановленного вещества, г; Э – молярная масса его эквивалента, г/моль; Q – количество электричества, прошедшее через элемент (Q = Jt, где J – сила тока, А; t – время, с).
Если Q = Jt = 1 Кл, то
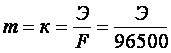 .
.
Величина К называется электрохимическим эквивалентом вещества. Она представляет собой массу вещества, окисляющегося или восстанавливающегося на электродах при прохождении через элемент 1 Кл электричества. Видно, что химический эквивалент связан с электрохимическим эквивалентом соотношением:
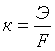 .
.
Показателем эффективности электролиза является выход по току η, %, определяемый как отношение массы вещества, фактически полученной в данных условиях электролиза mпракт, к массе вещества, теоретически вычисленной на основании закона Фарадея mтеор:
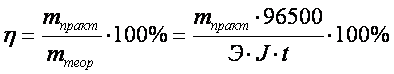 .
.
Области применения электролиза:
получение металлов;
очистка металлов от примесей (рафинирование);
извлечение ценных компонентов;
нанесение на поверхность металлических изделий слоев других металлов (гальваностегия);
получение точных металлических копий с рельефных предметов электроосаждением металла (гальванопластика).
Пожарная опасность процессов электролиза.
электролиз из расплавов предполагает присутствие высоких температур, что требует выполнения правил пожарной безопасности;
процессы очень энергоемкие, с использованием электричества, что требует выполнения правил электробезопасности;
возможность образования при протекании процессов водорода и кислорода, которые представляют собой пожароопасные и поддерживающие горение вещества;
возможность образования кислот и щелочей, способных вызвать активную коррозию металлических конструкций электролизера;
возможность образования хлора, который является отравляющим веществом.
Список литературыГлинка Н.Л. Общая химия. – Л.: Химия, 1978. – С. 285 – 293.
Шиманович И.Е. и др. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 155 – 159.
Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 65
Похожие работы
... . Из закона Ома следует, что при постоянной силе тока требуется тем большее напряжение, чем выше напряжений разложения раствора. Сопротивление раствора при увеличении концентрации электролита снижается до минимальной величины, а при больших концентрациях снова возрастает. Оно связано с подвижностью ионов в растворе. Подвижность ионов зависит от их радиуса, заряда и вязкости среды (табл. 3). В ...
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
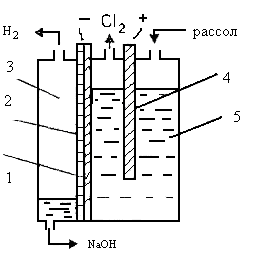
... и щелочи служат, главным образом, растворы поваренной соли, получаемые растворением твердой соли, или же природные рассолы. Растворы поваренной соли независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые ...
... затем сушат и точно взвешивают. По разности масс электродов, без осадка и с ним, находят массу определяемого вещества в растворе. Внутренний электролиз ЭГМ можно выполнить в накоротко замкнутом гальваническом элементе. При этом не требуется внешнего источника тока, так как осадок выделяется за счет энергии гальванического элемента. Такой вариант ЭГМ называют внутренним электролизом. Например, ...


0 комментариев