Студ. Гадиев Г.А., студ. Касаева М.С., доц. Алкацева В.М.
Кафедра металлургии цветных металлов.
Северо-Кавказский государственный технологический университет
Целью работы явилось исследование зависимости удельной электропроводности щелочных растворов вольфрамата натрия от их состава (WO3, NaOH) и температуры, а также поиск условий, отвечающих их наибольшей удельной электропроводности.
Исследования проводили на растворах с составом, близким к растворам, получаемым в результате электрохимического растворения вторичного вольфрамового сырья.
Измерения электропроводности растворов проводили с помощью переменно-токового кондуктометра ОК-102/1 с платинированными электродами.
Как показал предварительный анализ литературных данных [1-3], растворы, получаемые электрохимическим растворением вторичного вольфрамового сырья, содержат до 120 г/дм3 WO3, 20-200 г/дм3 NaOH, а температура их находится в пределах 40-70 оС. Несколько расширив эти границы, мы провели исследования на растворах состава 10-150 г/дм3 WO3 и 20-200 г/дм3 NaOH при температурах 20-70 оС, использовав планируемый эксперимент.
Исходя из этого, приняты следующие уровни независимых переменных:
WO3, г/л 10 – 80 – 150;
NaOH, г/л 20 – 110 – 200;
t, оС 20 – 45 – 70.
Значения независимых переменных в кодовом масштабе:
X1 = ![]() ; X2 =
; X2 = ![]() ; X3 =
; X3 = ![]() . (1)
. (1)
Для изучения электропроводности щелочных растворов вольфрамата натрия воспользовались планом Рехтшафнера. Матрица планирования приведена в табл.1.
Растворы, соответствующие по составу каждому пункту плана, готовили из однокомпонентных растворов Na2WO4 и NaOH, которые в свою очередь были приготовлены из реактивов марки ЧДА и ХЧ соответственно.
В соответствии с составами растворов (табл.1) готовили в каждом случае 200 мл раствора, содержащего Na2WO4 и NaOH. Приготовленный щелочной раствор вольфрамата натрия переводили в стакан и замеряли электропроводность в интервале температур 20-70 оС с шагом 5о. Поскольку составы растворов в некоторых пунктах плана одинаковы, то при замере электропроводности их объединили.
Пересчет показаний кондуктометра (S) на удельную электропроводность проводили по формуле
c = ![]() , См/м, (2)
, См/м, (2)
где К – постоянная ячейки.
Т а б л и ц а 1
Матрица планирования и результаты опытов
| № | Кодовый масштаб | Натуральный масштаб | c, | ||||
| оп. | X1 | X2 | X3 | WO3, г/л | NaOH, г/л | t, оС | См/м |
| 1 | - | - | - | 10 | 20 | 20 | 9,979 |
| 2 | - | + | + | 10 | 200 | 70 | 61,948 |
| 3 | + | - | + | 150 | 20 | 70 | 24,592 |
| 4 | + | + | - | 150 | 200 | 20 | 21,796 |
| 5 | - | - | + | 10 | 20 | 70 | 18,800 |
| 6 | - | + | - | 10 | 200 | 20 | 29,581 |
| 7 | + | - | - | 150 | 20 | 20 | 12,207 |
| 8 | + | 0 | 0 | 150 | 110 | 45 | 36,887 |
| 9 | 0 | + | 0 | 80 | 200 | 45 | 43,192 |
| 10 | 0 | 0 | + | 80 | 110 | 70 | 51,031 |
| 11 | 0 | 0 | 0 | 80 | 110 | 45 | 38,759 |
Значения удельной электропроводности растворов при 20-70 оС приведены в табл.2.
Обработкой экспериментальных данных, представленных в табл.1, получена кодовая модель зависимости удельной электропроводности щелочных растворов вольфрамата натрия от состава и температуры:
c = 38,788 – 0,4891 X1 + 13,1934 X2 + 11,1972 X3 – 1,4269 ![]() -
-
- 8,8044 ![]() + 1,0309
+ 1,0309 ![]() - 2,4959 X1X2 + 0,8983 X1X3 +
- 2,4959 X1X2 + 0,8983 X1X3 +
+ 5,8938 X2X3; (3)
Fрасч = 130740,15; F0,05;10;1 = 242.
Т а б л и ц а 2
Значения удельной электропроводности растворов
при 20-70 оС, См/м
| t, oC | № опыта | ||||||
| 1, 5 | 2, 6 | 3, 7 | 4 | 8 | 9 | 10, 11 | |
| 20 | 9,979 | 29,581 | 12,207 | 21,796 | 24,324 | 25,942 | 26,463 |
| 25 | 10,870 | 32,700 | 13,454 | 25,006 | 26,641 | 28,616 | 29,047 |
| 30 | 11,672 | 35,818 | 14,612 | 28,750 | 29,225 | 32,494 | 31,631 |
| 35 | 12,563 | 39,204 | 15,771 | 32,360 | 31,809 | 36,104 | 34,125 |
| 40 | 13,543 | 42,501 | 17,107 | 35,703 | 34,304 | 39,849 | 36,531 |
| 45 | 14,345 | 45,849 | 18,266 | 39,315 | 36,887 | 43,192 | 38,759 |
| 50 | 15,236 | 49,327 | 19,602 | 42,657 | 38,937 | 46,401 | 41,432 |
| 55 | 16,038 | 52,417 | 21,028 | 45,866 | 41,877 | 49,878 | 43,926 |
| 60 | 16,929 | 55,766 | 22,275 | 50,011 | 44,105 | 53,087 | 46,252 |
| 65 | 17,820 | 58,857 | 23,522 | 52,953 | 46,647 | 56,430 | 48,835 |
| 70 | 18,800 | 61,948 | 24,592 | 55,360 | 48,807 | 59,372 | 51,031 |
Поскольку чем выше удельная электропроводность раствора, тем ниже удельный расход электроэнергии на электрохимическое растворение вторичного вольфрамового сырья, то методом нелинейного программирования по модели (3) был найден максимум целевой функции c = 62,062 См/м и его координаты:
X1 = -0,7307 или 28,851 г/дм3 WO3;
X2 = 1 или 200 г/дм3 NaOH;
X3 = 1 или 70 оС.
Частные зависимости удельной электропроводности растворов при значениях других переменных на нулевом уровне приведены на рисунке.
Для описания зависимости электропроводности щелочных растворов вольфрамата натрия от температуры (25-70 оС) воспользовались формулой Кольрауша [4]:
ct = ct=25 [1 + a(t – 25) + b( t – 25)2], (4)
в которой за стандартную температуру принята t=25 оС.
| См×м |
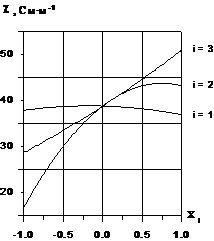
Частные зависимости удельной электропроводности растворов.
Экспериментальные данные хорошо описываются линейным уравнением вида
ct = ct=25 [1 + a(t – 25)]. (5)
Расчетные значения ct=25, a, а также коэффициента корреляции (rрасч) приведены в табл.3.
Т а б л и ц а 3
Коэффициенты математических моделей температурной зависимости удельной электропроводности растворов и оценка адекватности
| № оп. | ct=25, См/м | a, град.-1 | rрасч | rкрит |
| 1,5 | 10,8376 | 0,016174 | 0,9998 | 0,6319 |
| 2,6 | 32,6967 | 0,020039 | 0,9999 | 0,6319 |
| 3,7 | 13,3439 | 0,018915 | 0,9997 | 0,6319 |
| 4 | 25,3974 | 0,026951 | 0,9993 | 0,6319 |
| 8 | 26,8049 | 0,018436 | 0,9998 | 0,6319 |
| 9 | 29,1996 | 0,023353 | 0,9995 | 0,6319 |
| 10,11 | 29,1448 | 0,016793 | 0,9999 | 0,6319 |
Чтобы распространить полученные данные на растворы другого состава из изученной области, получены модели зависимости удельной электропроводности растворов при 25 оС (ct=25) и температурного коэффициента (a) от состава раствора (по WO3 и NaOH) в кодовом масштабе:
ct=25 = 28,8810 – 1,2642 X1 + 8,4122 X2 – 0,5482 ![]() - 7,8299
- 7,8299 ![]() -
-
- 2,4514 X1X2; (6)
Fрасч = 271,97; F0,05;6;1 = 234;
a = 0,01645 + 0,002328 X1 + 0,002952 X2 + 0,004045 ![]() +
+
+ 0,001043 X1X2; (7)
Fрасч = 105,90; F0,05;6;1 = 19,33.
Выполненные исследования связаны с физико-химическим обоснованием процесса прямого электрохимического растворения отходов металлического вольфрама в растворах натриевой щелочи.
Список литературы1. Гуриев Р.А., Алкацев М.И. Электрохимическое растворение вольфрама под действием переменного тока // Изв. вузов. Цв. металлургия. 1980. № 1. С. 61-64.
2. Резниченко В.А., Палант А.А., Ануфриева Г.И., Гуриев Р.А., Гаврилов В.К. Исследование процесса электрохимического растворения многофазных сплавов на основе вольфрама // Изв. АН СССР. Мет. 1985. № 2. С. 32-35.
3. Балихин В.С., Резниченко В.А., Корнеева С.Г., Корчагин И.В., Крепков П.Н. О переработке отходов торированного вольфрама // Цв. мет. 1972. № 11. С. 65-67.
4. Антропов Л.И. Теоретическая электрохимия. М.: Высшая школа, 1984. 51
Похожие работы
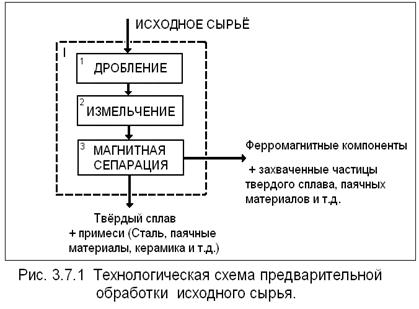
... в автоклавах, щелочи (для вольфрамита) и кислотами. Это позволяет интенсифицировать автоклавно-содовое разложение вольфрамовых концентратов, сократить расходы соды и в ряде случаев проводить процесс в одну стадию. Последнее увеличивает производительность автоклавов[4]. 4. Получение вольфрамового ангидрида 4.1 Переработка растворов вольфрамата натрия Растворы в, содержащие 60—150 г/л ...
... источник лома твердых сплавов − это отработавшее горнобуровое оборудование и конструкционные детали, а так же отходы и брак при производстве этой продукции. 3.2. Основные способы переработки твёрдых сплавов. 3.2.1. Хлорирование. 1) Подготовленные отходы хлорируют смесью хлора с диоксидом углерода при 850-900°С. Образовавшиеся хлориды вольфрама (WC16), титана (TiCl4) и кобальта ( ...
... были обнаружены в парах. Известен ряд двойных карбидов галлия различного состава с марганцем, железом, платиной, ниобием, хромом и некоторыми другими металлами. Соединения галлия с кремнием и бором не получены. 6. ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ...
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...




0 комментариев