Навигация
Клетки удаляют, используя для этого отмывающий раствор с детергентом, лизирующим клетки
3. Клетки удаляют, используя для этого отмывающий раствор с детергентом, лизирующим клетки.
4. Участки накопления секреторных продуктов проявляют, добавляя связанные с ферментом антитела (антиглобулиновый реагент).
5. Добавляют смесь субстрата с агарозой (используемые субстраты должны растворяться в агарозе и образовывать нерастворимые продукты реакции), на поверхности твердой фазы образуются коричневые или голубые пятна (в зависимости от используемых ферментов и субстратов), выявляя участки, где располагались клетки.
• Образовавшиеся пятна подсчитывают под микроскопом, это и будет количество секретирующих клеток.
В качестве твердой фазы может быть использована нитроцеллюлозная мембрана В этом случае есть ряд преимуществ: из-за высокой адсорбционной способности НЦМ требуется значительно меньшее количество антигена, используемого в качестве «ловушечного» реагента, кроме того, отпадает необходимость во включении агарозы в субстрат.
При параллельном определении количества секретирующих клеток и общего количества секретируемого антигена или антитела в лунке, что возможно при использовании другого субстрата, можно выявить количество секретируемого вещества единичной клеткой.
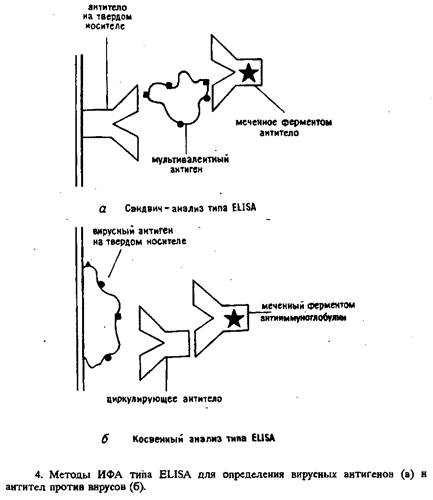
Данный метод нашел широкое применение для оценки количества клеток, секретирующих антиген, улавливаемый адсорбированными антителами, используется для определения количества клеток, секретирующих цитокины (ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИФН-у, ФНО-а).
Системы усиления сигнала.
При использовании высокоаффинных антител чувствительность отдельных вариантов ИФА очень высока и теоретически позволяет выявить единичные молекулы антигена, но на практике чувствительность ограничивается рядом факторов: активностью фермента, интенсивностью сигнала и методами учета сигнала. Системы усиления сигнала дают возможность повышать чувствительность различных вариантов ИФА. Рассмотрим некоторые такие системы:
На основе взаимодействия авидин-биотин.
Молекулы кофермента биотина (м.м. 244 Да) конъюгируют с антителами при помощи биотинил-N-гидроксисукцимида. Небольших размеров молекулу биотина проще присоединить к иммуноглобулину или другому белку без нарушения его иммунных или ферментативных свойств. Фермент в этом случае связывают с гликопротеином яичного белка авидином. Аффинносгь связывания авидина с биотином очень высока (константа диссоциации комплекса – 10-15 моль), конъюгат авидин-фермент прочно фиксируется на комплексе антиген-антитело-биотин. После добавления соответствующего субстрата проводят определение продукта реакции спектрофотометрически или по интенсивности люминесценции.
Одна молекула авидина состоит из четырех идентичных субъединиц, способна взаимодействовать с четырьмя молекулами биотина, что позволяет использовать его как связующую молекулу между двумя биотинсодержащими соединениями. В этом случае фермент тоже биотинилируют, а авидин выполняет функцию мостика, соединяя две молекулы, содержащие остатки биотина. К образовавшемуся комплексу антиген-антитело-биотин добавляют свободный авидин, а затем биотинилированный фермент. Проводят учет реакции.
Белок авидин может неспецифически сорбироваться на других молекулах, поэтому все чаще используют другой биотинсвязывающий белок - стрептавидин, обнаруженный в бактериях Streptomyces avidinii. Стрептавидин также образует прочный комплекс с биотином и состоит из четырех идентичных субъединиц.
Применение авидин-биотинового комплекса позволяет значительно повысить чувствительность ИФА, так как при синтезе конъюгата с одной молекулой АТ можно связать десятки молекул биотина. Получение конъюгатов (антител и ферментов с биотином) осуществляется достаточно легко и сопровождается минимальными изменениями их иммунологической и ферментативной активности. Конъюгаты ферментов с биотином могут быть использованы как универсальные реагенты.
Использование хемилюминесцентных реакций.
Хемилюминесцентные реакции можно использовать для получения сигнала в ИФА, при этом повышается чувствительность метода и сокращается время проведения анализа. В качестве метки в ИФА широко применяют пероксидазу хрена, для ее выявления можно использовать и различные хемилюминесцентные реакции. Хемилюминесцентные реакции основаны на способности люминола светиться при окислении перекисью водорода. В прямом анализе при ферментативной реакции образуется перекись водорода и окисляет люминол, катализатором этой реакции выступает пероксидаза хрена. Для усиления сигнала используются различные соединения, например, люциферин, фенолы, в этом случае интенсивность люминесценции усиливается в 10-100 раз, в отдельных вариантах в 500 раз (усиленный хемилюминесцентный анализ). Люминесцентный сигнал очень стабилен, его уровень достигает максимума за 30 с (для сравнения: цветная реакция с ОФД в качестве индикатора полностью развивается лишь за 30 мин).
При непрямом анализе люминолом или его производными метится антитело. Такая метка в свободном состоянии способна окисляться перекисью водорода с выделением света. Если она образовала комплекс, то теряет способность окисляться.
На основе каскадных систем.
Для повышения чувствительности ИФА можно использовать ферментные каскадные системы. В этом случае первый фермент, связанный с антителами, приводит к образованию восстанавливаемого субстрата для второй ферментной системы. Вторая ферментная система может быть субстрат-циклической или редоксициклической. Ферментными метками в этом случае могут служить фосфо-глюкоизомераза, альдолаза, щелочная фосфатаза. Конечный продукт реакции определяют визуально или спектрофотометрически.
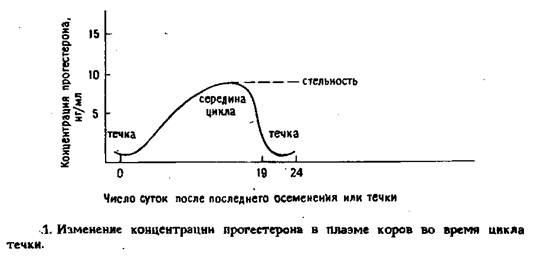
Системы амплификации в ИФА позволяют добиться высокой чувствительности. Такие ИФА-системы используются для определения уровня гормонов (ти-реостимулирующего, прогестерона и др.).
Практическое применение ИФА.
ИФА нашел широкое применение в различных областях медицины и биологии благодаря относительной простоте и высокой чувствительности метода. ИФА успешно применяется для:
• массовой диагностики инфекционных заболеваний (выявление различных специфических антигенов или антител к ним);
• выявления и определения уровня гормонов и лекарственных препаратов в биологических образцах;
• определения изотипов (IgG, IgM и другие) антител против конкретного антигена;
• выявления иммунных комплексов;
• выявления онкомаркеров;
• определения белков сыворотки крови (ферритин, фибронектин и др.);
• определения общего IgE и специфических IgE антител;
• скрининга моиоклональных антител;
• определения цитокинов в биологических жидкостях.
Чувствительность метода
ИФА пришел на смену широко используемым ранее в клинической практике методам агглютинации, преципитации и РИА. По сравнению с вышеназванными методами ИФА менее трудоемок и менее продолжителен по времени, удобен для выполнения большого числа однотипных анализов.
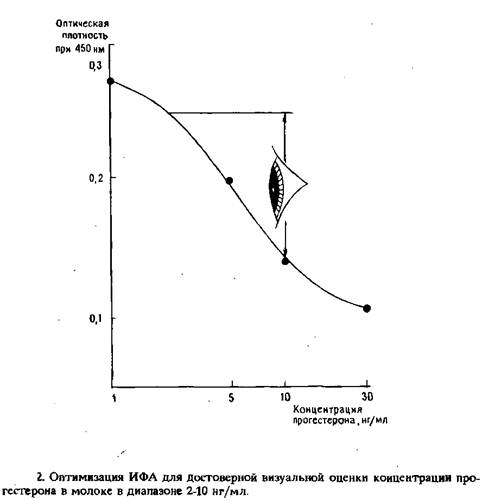
В ИФА сочетается уникальная специфичность иммунохимического анализа с высокой чувствительностью определения ферментной метки. Чувствительность метода (под чувствительностью подразумевают минимальное выявляемое количество антител или антигена) определяется следующими факторами: аффинностью антител, предпочтительнее использование моноклональных антител; специфической активностью фермента; интенсивностью сигнала; чувствительностью учета сигнала. Различные варианты ИФА различаются по своей чувствительности. Отдельные варианты твердофазного ИФА позволяют выявлять в образце единичные молекулы. Средняя чувствительность ИФА – 10-9 – 10-12 моль.
Список литературыГалактионов В.Г. Иммунология. Издательство Московского университета, 1998 г.
Кишкун А.А. Иммунологические исследования и методы диагностики инфекционных заболеваний в клинической практике. Медицинское информационное агентство, 2009 г.
Кондратьева И.А. Практикум по иммунологии. Учебное пособие для ВУЗов. Академия, 2004 г.
Лефковитс И., Пернис Б. Иммунологические методы исследования. Мир, 1988 г.
Ройт А., Бростофф Д., Мейл Д. Иммунология. Мир, 2000 г.
Соколов Е.И. Клиническая иммунология. Медицина, 1998 г.
Фримель Г. Иммунологические методы. Медицина, 1987 г.
Хаитов Р. М. Иммунология. Медицина, 2000 г.
Шигина Ю.В. Иммунология: Учебное пособие. Издательство РИОР, 2007 г.
Ярилин А.А. Основы иммунологии. Медицина, 1999
Похожие работы
... при хронической форме процесса, так как при острой форме данная процедура может способствовать распространению инфекции в вышележащие отделы мочеполовой системы. Методы лабораторной диагностики гонококковой инфекции: · микроскопические (бактериоскопические), · культуральные (бактериологические). · молекулярно-биологические. 2.3.1 Микроскопические методы исследования В случае если ...
... забывают о том, что определению афлатоксинов и других токсинов должно предшествовать их выделение путем экстракции. Это требование справедливо по отношению как к иммуноанализу, так и к более классическим аналитическим методам – тонкослойной хроматографии и высокоэффективной жидкостной хроматографии. Необходимость операции экстракции определяемого вещества затрудняет разработку соответствуй ющей ...
... и взаимодействия организма с возбудителем соответствующего инфекционного заболевания. Кроме того, ряд заболеваний со сходной клинической картиной (например, риккетсиозы, энтеровирусные инфекции) могут быть дифференцированы лишь серологически, что отражает значение серологических методов в диагностике инфекционных болезней. 3.6 Серологические реакции Серологические реакции обозначают в ...
... ВИЧ-инфекции и заболевания СПИДом можно только путём выявления в организме больного самого возбудителя. Однако сделать это достаточно сложно. Более распространенный способ диагностики СПИДа основан на обнаружении специфических противовирусных антител с помощью различных иммунологических реакций (иммуноферментный анализ, метод флуоресцирующих антител, реакция агглютинации латекса, имуноблоттинг). ...


0 комментариев