Навигация
Натрий: миграция, биофильность, технофильность, техногенное геохимическое давление
2. Натрий: миграция, биофильность, технофильность, техногенное геохимическое давление
Na, химический элемент I группы периодической системы Менделеева, атомный номер 11, атомная масса 22,98977; относится к щелочным металлам. Название (от араб. натрун) первоначально относилось к природной соде. Серебристо-белый металл, мягкий, легкий (плотность 0,968 г/см³), легкоплавкий (tпл 97,86 °C). На воздухе быстро окисляется. Взаимодействие с водой может сопровождаться взрывом. Занимает 6-е место по распространенности в земной коре (минералы галит, мирабилит и др.) и 1-е среди металлических элементов в Мировом океане. Применяют для получения чистых металлов (К, Zr, Та и др.), как теплоноситель в ядерных реакторах (сплав с калием) и источник свечения в натриевых лампах. Натрий участвует в минеральном обмене всех живых организмов.
Мировое производство натрия – 2*107 т/год, запасы натрия неограниченны, содержание натриия в человеческом организме - 100 г. Поступление с пищей и жидкостью – 4,4 г, выделение с мочой – 3,3 г, выделение с фекалиями – 0, 1 г, выделение с потом – 0, 87 г, в волосах человека содержится 0,0001 г натрия.
Технофильность (соотношение количества добываемого элемента к его содержанию в земной коре) натрия равна: 2*107/ 3 * 10 19 *100 = 0,67*10-10%
Биофильность (отношение среднего содержания элемента в живом веществе планеты к содержанию в земной коре) натрия равна: 0,02/2,5*100 = 0,8 %
Деструктивная активность - отношение массы элемента годовой добычи и выбросов в окружающую среду к массе элемента биологической продукции наземных растений в течении года натрия равна 5[3].
3. Биогеохимическая функция натрия
Биогенная функция натрия заключается в следующем: в пределах т. н. биогеохимических провинций возникают формы организмов, накапливающие иногда значительные количества химического элемента, т. е. имеет место интенсивная биогенная миграция. Известно также, что организмы участвуют в нарушении изотопного состава ряда лёгких химических элементов (углерода, кислорода, серы). Как правило, в биогенных процессах организмами поглощаются преимущественно более лёгкие изотопы.
4. Геохимическая характеристика натрия в различных средах
Натрий - типичный элемент верхней части земной коры. Содержание натрия в земной коре составляет 2,64%.
Среднее содержание его в литосфере 2,5% по массе, в кислых изверженных породах (граниты и другие) 2,77, в основных (базальты и другие) 1,94, в ультраосновных (породы мантии) 0,57. Благодаря изоморфизму Na+ и Ca2+, обусловленному близостью их ионных радиусов, в магматических породах образуются натриево-кальциевые полевые шпаты (плагиоклазы). В биосфере происходит резкая дифференциация Натрия: осадочные породы в среднем обеднены Натрием (в глинах и сланцах 0,66%), мало его в большинстве почв (среднее 0,63%). Общее число минералов Натрия 222. Na слабо задерживается на континентах и приносится реками в моря и океаны, где его среднее содержание 1,035% (Na - главный металлический элемент морской воды). При испарении в прибрежно-морских лагунах, а также в континентальных озерах степей и пустынь осаждаются соли Натрия, формирующие толщи соленосных пород. Главные минералы, являющиеся источником Натрия и его соединений, - галит (каменная соль) NaCl, чилийская селитра NaNO3, тенардит Na2SO4, мирабилит Na2SO4·10H2O, трона NaH(CO3)2·2H2O. Na - важный биоэлемент, в живом веществе в среднем содержится 0,02% Na; в животных его больше, чем в растениях.
5. Ресурсный цикл натрия
Согласно классификации Колосовского, натрий входит в цикл металлорудных ресурсов и металлов.
6. Производства по добыче натрия
Огромные отложения солей натрия в сравнительно чистом виде существуют на всех континентах. Они являются результатом испарения древних морей. Этот процесс по-прежнему продолжается в озере Солт-Лейк (штат Юта), Мертвом море и других местах. Натрий встречается в виде хлорида NaCl (галит, каменная соль), а также карбоната Na2CO3·NaHCO3·2H2O (трона), нитрата NaNO3 (селитра), сульфата Na2SO4·10H2O (мирабилит), тетрабората Na2B4O7·10 H2O (бура) и Na2B4O7·4H2O (кернит) и других солей.
Неиссякаемые запасы хлорида натрия есть в природных рассолах и океанических водах (около 30 кг м–3). Подсчитано, что каменная соль в количестве, эквивалентном содержанию хлорида натрия в Мировом океане, занимала бы объем 19 млн. куб. км (на 50% больше, чем общий объем Североамериканского континента выше уровня моря). Призма такого объема с площадью основания 1 кв. км может достичь Луны 47 раз[4].
Сейчас суммарное производство хлорида натрия из морской воды достигло 6–7 млн. т в год, что составляет около трети общей мировой добычи.
Основной промышленный метод получения натрия - электролиз расплава поваренной соли NaCl, содержащей добавки KCl, NaF, CaCl2 и другие, которые снижают температуру плавления соли до 575-585 °C. Электролиз чистого NaCl привел бы к большим потерям Натрия от испарения, так как температуры плавления NaCl (801 °C) и кипения Na (882,9 °C) очень близки. Электролиз проводят в электролизерах с диафрагмой, катоды изготовляют из железа или меди, аноды - из графита. Одновременно с Натрием получают хлор. Старый способ получения Натрия - электролиз расплавленного едкого натра NaOH, который значительно дороже NaCl, однако электролитически разлагается при более низкой температуре (320-330 °C).
Добыча соли ведется различными способами. К основным относятся 4 технологии: получение хлористого натрия в растворах, выпаривание соли на солнце (озерной и морской), подземная добыча каменной соли, производство вываренной соли вакуумным методом. Наиболее высококачественным видом соли является вакуумная, на которую, однако, приходится небольшая по количеству часть производства соли. Конкретные технологии производства соли в различных странах мира сильно разнятся - от самых примитивных солеварок, базирующихся на ручном труде годовой производительностью в несколько десятков тонн продукта до крупных полностью автоматизированных производств, рассчитанных на выпуск нескольких миллионов тонн соли ежегодно. Оригинальная технология получения соли используется в Японии, где отсутствуют ее крупные залежи и нет свободных участков земли для выпаривания соли на солнце. В этой стране соль для пищевой промышленности и, особенно, для индивидуального потребления населением получают непосредственно из морской воды на основе ионно-обменной технологии.
Хлористый натрий выпускается в основном в виде растворов и выпаренной на солнце соли: на эти виды приходится по 35% мирового производства, доля каменной соли в мировом производстве составляет около 30%.
Структура мирового производства соли (в %) приведена в табл. 1
Таблица 1
Структура мирового производства соли (в %)
| Всего | 100 |
| в том числе | |
| Выпаренная на солнце | 35 |
| Рассолы/растворы | 35 |
| Каменная | 30 |
Динамика мирового производства соли в отличие от многих других сырьевых товаров не подвержена резким конъюнктурным изменениям и характеризуется в целом умеренными темпами роста. В 1997г. общий объем ее мирового производства превысил уровень 1992г. на 5,5%. Умеренные темпы роста производства были характерны в последние годы почти для всех стран мира. Исключением являются две небольшие группы стран, где в связи с серьезными и длительными экономическими трудностями или военными действиями производство соли существенно сократилось (Украина, РФ, Иран, Беларусь, Сьерра-Леоне, Югославия, Азербайджан, Хорватия, Эфиопия) - первая группа, и вторая группа государств, где в результате освоения новых методов добычи или открытием новых производств выпуск соли заметно увеличился (Чили, Болгария, Тайланд, Намибия, Тайвань, Ботсвана, Греция, Мозамбик).
В конце 90-х годов к числу ведущих мировых производителей соли относились США, Китай, Канада, ФРГ, Индия, Мексика, Австралия, Франция, Великобритания и Бразилия. В 1997г. на долю этих десяти государств приходилось 68% мирового производства соли, в том числе (в %) – табл. 2:
Таблица 2
Ведущие мировые производители соли (%)
| США | 21,7 |
| Китай | 15,5 |
| Канада | 6,3 |
| ФРГ | 5,7 |
| Индия | 5,0 |
| Мексика | 4,4 |
| Австралия | 4,1 |
| Франция | 3,9 |
| Великобритания | 3,5 |
| Бразилия | 3,1 |
Похожие работы
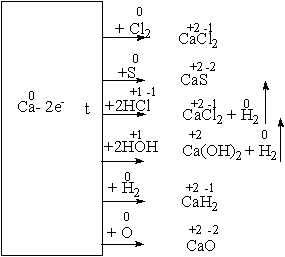
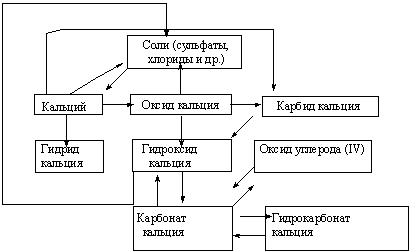
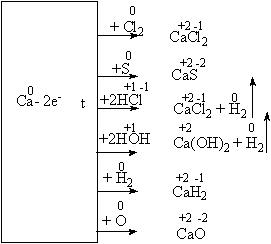
... среды. 3.1 Урок по теме «Кальций и его соединения» в 9-ом классе с. Карасу, позволяющий развить экологическое сознание школьников Цель урока: познакомить учащихся с основными способами получения кальция и его соединений, возможностями применения соединений кальция, показать необходимость контроля содержания ионов кальция и магния в питьевых и сточных водах и обозначить значимость кальция ...
... 100 м2. В процессе газообмена токсиканты поступают в кровь. Твердые взвеси в виде частиц различных размеров оседают в различных участках дыхательных путей. 2.4 Влияние загрязнения воды на здоровье человека Вода – это вещество, обеспечивающее существование живых организмов на Земле. Вода входит в состав клеток любого животного и растения. Недостаточное количество воды в организме человека ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... определение NH+4 без предварительной отгонки аммиака. В частности, было показано, что определение без предварительной отгонки вполне применимо при анализе сточных вод, содержащих наряду с аммиаком ряд органических соединений, в состав которых входит азот (меламин, дицианамид, карбамид, циануровая кислота). Мешают сильно сероводород и сульфиды. Их можно удалить, подкислив пробу до pH=3 и ...
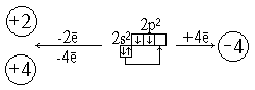
0 комментариев