Навигация
Методи дослідження біологічного окиснення
1.4. Методи дослідження біологічного окиснення
Для дослідження процесів пероксидного окиснення ліпідів в біологічних системах використовують вільнорадикальні інтермедіати ПОЛ (головним чином алкильні та алкилперекисні вільні радикали), продукти першого єтапу ланцюга окиснення ліпідів – їх гідропероксиди; проміжні, чи вторинні сполуки, які утворюються в результаті розпаду гідропероксидів, та кінцеві продукти ПОЛ [27]:
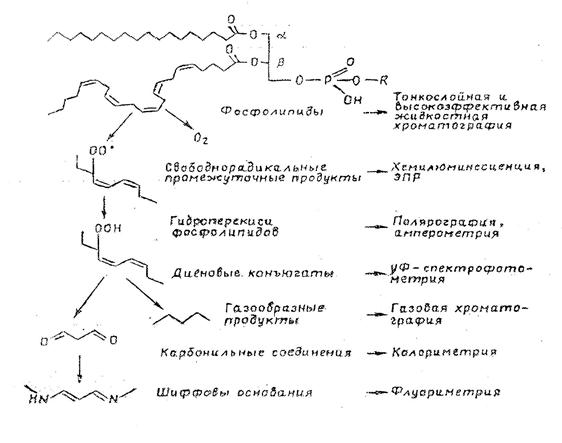
Труднощі аналізу продуктів ПОЛ визначаються наступними причинами:
1 – в кожний момент часу вміст дієнових коньюгатів та ліпідних пероксидів є стаціонарна концентрація сполук, результат двох одночасно протікаючих процесів: утворення та розпаду, тобто підвищення вмісту ліпідних пероксидів може бути як результат збільшення швидкості їх утворення, так і навпаки – зменьшення швидкості розпаду;
2 – в добуванні біологічного матеріалу та готуванні його для аналізу стаціонарна концентрація пероксидів повинна залишатися постійною. Для запобігання накопичення пероксидів використовують антиоксиданти: токоферол, ЕДТА, а також проводять усі процедури виділення в безкисневих умовах.
Оскільки первинними молекулярними продуктами ПОЛ є гідропероксиди та діалкилпероксиди, то в основі більшості існуючих методів дослідження процесів окиснення полягає визначення вмісту гідропероксидів ліпідів реакцією відновлення їми різних барвників або іонів І- (йодометрія) [2]. В основі різноманітних модифікацій іодометричного метода лежить визначення вільного іоду, який утворюється в результаті стехіометричного відновлення пероксидних груп йодид-іоном. Недоліком цього методу є те, що крім ліпідних пероксидів в окиснювальній системі можуть утворюватись пероксиди інших класів.
Пероксиди ліпідів є достатньо нестійкими речовинами, які легко підлягають гомолітичному розпаду. Тому результати кількісного аналізу гідропероксидів відображають лише стаціонарні концентрації цих продуктів в ліпідних системах [27]. Більш стійкими є вторинні продукти ПОЛ. Особливий інтерес при цьому представляють спектральні методи (УФ-спектрофотометрія), які широко використовують при вивченні нестійких проміжних продуктів. Застосування спектрофотометричного методу обмежено тим, що в короткохвильовій області спектру суттєво поглинання ізольованих подвійних зв’язків, тобто його можна розглядати як приблизний напівкількісний.
Подальше перетворення утворених продуктів призводить до утворення малонового діальдегіду [2,27], які визначають за кольоровою реакцією з тіобарбітуровою кислотою. ТБК-тест дуже зручний для дослідженя швидкості ПОЛ в ізольованих системах. В роботі [36] проводили оцінку АОА плазми крові та фармакологічних препаратів за накопиченням ТБК-активних продуктів з використанням як модельної системи дисперсії жовточних ліпопротеїнів. В цей час найбільш чутливим методом виявлення вільнорадикальних інтермедіатів є метод, що оснований на вимірюванні інтенсивності хемілюмінесценції електронно-збуджених продуктів, які утворюються за реакцією рекомбінації ліпідних радикалів. Проте хемілюмінесцентний (ХЛ) метод дозволяє виявляти не самі радикали, а ті молекулярні продукти їх рекомбінації, що виявляються у збудженому стані, тобто ХЛ є непрямим методом регістрації ліпідних радикалів.
ХЛ свідчить про швидкість рекомбінації алкілпероксидних радикалів у зразку. Ця особливість метода може бути використана для дослідження процесів ПОЛ, які швидко розвиваються. Другою важливою перевагою цього метода є його висока чутливість (10-10М) [27].
Недолік ХЛ метода полягає у неможливості контролювати фізико-хімічні властивості ліпідів, що призводить до зниження відтворюваності результатів ХЛ досліджень.
В якості модельної системи часто використовують дисперсію жовточних ліпопротеїнів (ЖЛП). Її готують різними способами: екстракцією хлороформно-метанольною сумішшю [2]; шляхом суспензування ЯЖ в фосфатному буфері [37] або в дистильованій воді [37]. В роботах при окисненні ЖЛП використовують буфери – трис-HCl [2], фосфатний в присутності солей NaCl [38] чи KCl [39], які забеспечують фізіологічне рН = 7,4. Концентрація заліза змінюється в інтервалі 10-4 - 2•10-2 М.
Для дослідження кінетики окиснення вуглеводнів крім ХЛ широко використовують газоволюмометричний метод. Відомості про використання газометричного метода в літературі є лише для таких модельних систем як метилолеат [40], олеїнова кислота, етилбензол, але не дисперсія ЖЛП. Оскільки ліпосоми ЯЖ є найближчим аналогом біомембран, дослідження можливості їх використання в якості субстрата окиснення на газоволюмометричній установці є актуальним.
2. Експериментальна частина
2.1.1 Газоволюмометричний метод
Одним із простих і розповсюджених методів вивчення кінетики рідиннофазних реакцій окиснення органічних речовин є метод вимірювання кількості поглиненого кисню. Газоволюмометричний метод дозволяє вимірювати швидкість окиснення з великим ступенем точності при малих глибинах перетворення, коли впливом продуктів окиснення на кінетику реакції можна знехтувати.
Існують різні варіанти газоволюмометричних установок, загальний принцип їхньої дії полягає у вимірюванні швидкості поглинання кисню при постійному тиску. Визначення кінетичних параметрів процесу інгібованого окиснення: період індукції, константу швидкості реакції з пероксильними радикалами, коефіцієнт інгібування і ряд інших кінетичних характеристик проводили на установці для автоматичної реєстрації і запису поглинання кисню "Кулон-1" з фотоелектронним датчиком заводу інституту хімічної фізики РАН (рис.2.1).
Установка складається з реакційної судини (1), зануреної в термостатовану ячейку (2), термостатованої газової бюретки (3), електролітичної ячейки з платиновими електродами (електроліт - насичений розчин щавлевої кислоти) (4), регулятора тиску (5), заповненого ундеканом, і манометра (6), фотоелектроннного датчика (8), підсилювача датчика (9), стабілізатора струму (10). Перед початком досліду бюретка, регулятор тиску і реакційна судина з речовиною, що окиснюється, заповнюються до атмосферного тиску киснем. Для проведення окиснення реакційна судина нагрівається до певної температури за допомогою термостата, при безперервному перемішуванні, після двоххвилинного прогріву з'єднується з бюреткою і регулятором тиску. Фотоелектронний датчик через стабілізатор струму з'єднаний з електролітичною ячейкою. Під час реакції кисень з бюретки надходить у реакційну судину, при цьому тиск у системі падає, і в зв'язку з цим включається електролітична ячейка. Газ, що виділився з ячейки, підвищує тиск у термостатованому об'ємі і піднімає рівень ундекану в бюретці, у результаті чого тиск у системі вирівнюється. Швидкість просування меніска ундекана в бюретці пропорційна швидкості реакції.
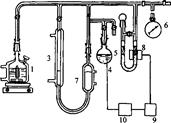
Рисунок 2.1 -Схема газоволюмометричної установки: 1 - реакційна судина, 2- термостат, 3 - газова бюретка, 4 - електролітична ячейка, 5 - регулятор тиску, 6 - манометр, 7 - термостатований об'єм, 8 - фотоелектронний датчик, 9 - підсилювач датчика, 10 - стабілізатор струму.
Сила струму на електролізері складала 0.2 А. Установка дозволяє вимірювати швидкість поглинання кисню - від 10-7-10-8 моль-л-1∙с-1 і більше. Об'єм реакційної суміші дорівнює 5 мл, частота перемішування - 8-100 с-1. Вимірювання проводили в кінетичній області при тиску кисню 1 атм. і температурі 310К.
0 комментариев