Навигация
СОДЕРЖАНИЕ
1. Введение.. 2
1.1. Свойства дибензальацетона. 2
1.2. Применение дибензальацетона. 2
1.3. Методика синтеза. 2
2. Литературный обзор. 4
2.1. Способы получения. 4
2.2. Химические свойства. 7
Список литературы... 16
1. Введение 1.1. Свойства дибензальацетона
Дибензальацетон - бесцветное или светло-желтое кристаллическое вещество в виде пластинок; по запаху напоминает кумарин; растворим в спирте, эфире, хлороформе, бензоле. Температура плавления 112°С; молекулярная масса 234.
1.2. Применение дибензальацетонаПрименяется в парфюмерии в незначительных количествах, главным образом для духов. Является промежуточным продуктом для получения коричной кислоты. Используется в органическом синтезе. Бензальацетон производился в СССР с 1929 года. Количественное определение бензальацетона ведется по способу Мессенгера, описанному для количественного определения ацетона.
1.3. Методика синтезаРеактивы и оборудование:
Бензальдегид 7,8 г (7,5 мл)
Ацетон 2,22г (2,8 мл)
Этанол (95%) 60 мл
Гидроксид натрия 7,5 г
Этилацетат 25мл
Стакан (емкость 250мл)
Мешалка
Колба коническая (емкость 50 мл)
Водяная баня
Термометр
В стакан снабженный мешалкой и термометром, наливают охлажденный до комнатной температуры раствор 7,5 г гидроксида натрия в смеси 75 мл воды с 60 мл спирта, помещают в водяную баню. При температуре 20…25°С и при перемешивании прибавляют к раствору половину приготовленной заранее смеси 7,5 мл бензальдегида и 2,8 мл ацетона. Через 2-3 минуты начинается помутнение и образуется хлопьевидный осадок. В ходе процесса нельзя дать разогреваться смеси, так как при температуре выше 30°С идет побочная реакция, снижающая выход дибензальацетона. Через 15 минут приливают оставшуюся смесь бензальдегида и ацетона. Содержимое перемешивают еще 30 минут. Выпавший кашеобразный осадок отсасывают на воронке Бюхнера, промывают на фильтре дистилярованной водой. Сушат между листами фильтрованной бумаги. Выход 7-8 г.
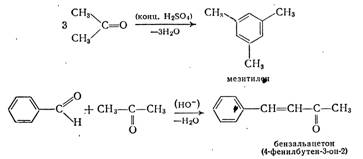
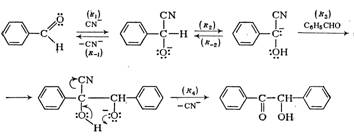
2. Литературный обзор 2.1. Способы получения
Получение альдегидов и кетонов
Поскольку как альдегиды, так и кетоны содержат карбонильную группу, то многие методы их получения сходны. Наряду с этим существует ряд особых способов, пригодных для синтеза только альдегидов или только кетонов [4].
1. Окисление или дегидрирование первичных или вторичных спиртов.
Важное значение имеет метод окисления по Оппенауэру (1937 г). Он представляет собой процесс, обратный реакции восстановления по Мейервейну - Пондорфу - Верлею, и применяется в основном для получения кетонов из вторичных спиртов. Последние вводят в реакцию с ацетоном в присутствии изопропилата или трет-бутилата алюминия.
Вначале образуется алкоголят алюминия вторичного спирта, дающий комплекс с ацетоном. Внутри последнего происходит перенос гидрид-иона от алкоксидного остатка на карбонильную группу.
Первичные спирты окисляются в альдегиды в том случае, если вместо ацетона в качестве акцептора гидрид-иона используют 1,4-бензохинон (п-хинон). В условиях реакции Оппенауэра двойные связи С=С не затрагиваются, что позволяет получать непредельные альдегиды и кетоны.
2. Оксосинтез (гидроформилирование, Ройлен, 1938 г).
При температурах от 30 до 200 °С и давлении 100-400 кгс/см2 (1*1О7 до 4*107 Па) в присутствии дикобальтоктакарбонила олефины присоединяют водород и монооксид углерода с образованием альдегидов. Обычно получается смесь изомеров.
В определенных условиях могут получаться также и кетоны.
3. Восстановление по Розенмунду (1918 г).
Получение альдегидов прямым восстановлением карбоновых кислот затруднительно, так как обычно процесс не останавливается на стадии образования альдегида и идет дальше. По Розенмунду альдегиды получают гидрированием ацихлоридов над палладием, нанесенным на сульфат бария. В целом ряде случаев катализатор дезактивируют добавками хинолина с серой или тиомочевиной для предотвращения восстановления двойной связи С=О.
4. Взаимодействие сложных эфиров с реактивом Гриньяра.
Реакция эфиров муравьиной кислоты с алкил - или арилмагнийгалогенидами дает альдегиды.
Следует избегать избытка реактива Гриньяра; в противном случае образуются вторичные спирты. Поэтому на практике раствор магнийор-ганического соединения прибавляют по каплям к эфиру муравьиной кислоты. Для этих же целей можно использовать и ортоэфиры муравьиной кислоты; в таком случае получаются ацетали, которые далее гидролизуются до альдегидов.
Из эфиров других кислот, в частности и ортоэфиров, получаются кетоны, в последнем случае промежуточно образуются кетали.
Синильная кислота или нитрилы при взаимодействии с реактивом Гриньяра также дают альдегиды или соответственно кетоны.
5. Ацилирование по Фриделю - Крафтсу (1877 г)
При взаимодействии аренов с ацилгалогенидами в присутствии кислот Льюиса, таких как хлорид алюминия, получают кетоны.
Ацилирование может быть и внутримолекулярным. В качестве примера приведем синтез инданона-1.
Вместо ацилгалогенидов используются также сами кислоты или их ангидриды. В противоположность алкилированию по Фриделю - Крафтсу, при котором берутся лишь каталитические количества катализатора, при проведении ацилирования по Фриделю - Крафтсу необходимо брать более чем стехиометрические количества катализатора. Это связано с тем, что как ацилирующий агент, так и продукт реакции образуют с катализатором комплекс в соотношении 1: 1.
Ацилирование аренов по Фриделю - Крафтсу относится к SЕ-реакциям. В зависимости от условий реагентом является либо комплекс состава 1: 1, либо ацил-катион.
В аналогичных условиях ацилируются циклоалканы и олефины. В последнем случае наряду с продуктами ацилировакия получаются также продукты присоединения.
Родственными ацилированию по Фриделю - Крафтсу являются следующие реакции, при которых бензоидный атом водорода замещается на альдегидную группу (формилирование).
Похожие работы
онная форма, а во втором енольная форма. Енолят-анионы могут реагировать с алкилгалогенидами по механизму SN2 (2) или с альдегидами и кетонами (3) енолят-анион кетон тетраэдральный промежуточный продукт присоединения к карбонильной группе Таутомерия Итак, подвижный атом водорода, хотя и очень медленно может переходить к кислороду с образованием, так называемой, енольной формы: ...
... вытяжку соединяют с органическим слоем из смеси, объединенный органический раствор в делительной воронке промывают 5 мл воды и отделяют водный слой. Сначала отгоняют бензол на водяной бане, потом бензальацетон в вакууме. Причем первые несколько миллилитров дистиллята, имеющего зеленоватый оттенок, отделяют. Собирают фракцию с температурой кипения 148—160°С (25 мм рт. ст.), имеющую светло-желтый ...
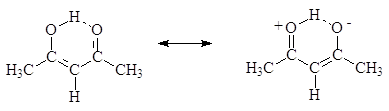
0 комментариев