Навигация
2. Альдольная реакция
Взаимодействие альдегидов или кетонов (карбонильная компонента) самих с собой или с другими альдегидами и кетонами, выступающими в качестве С-Н-кислотной компоненты (метиленовой компоненты) с образованием (β-оксикарбонильных соединений, называют альдольной реакцией. Кислоты и основания катализируют эту реакцию. Например, в присутствии гидроксидов щелочных или щелочноземельных, металлов из ацетальдегида образуется ацетальдоль ("аль" от альдегида и "ол" от спирта) 3-оксибутаналь.
Какая из стадий реакции (первая или вторая) будет определять скорость всего превращения, зависит от кинетической кислотности метиленовой компоненты и от электрофильности карбонильной компоненты. В случае альдолыюй реакции с ацетальдегидом наиболее медленной является первая стадия, в случае ацетона из-за меньшей реакционной способности его карбонильной группы - вторая стадия.
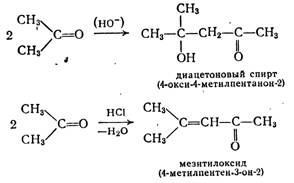
При повышенных температурах часто протекает дегидратация, приводящая к α,β-непредельным соединениям. Так, из ацетальдоля получают кротоновый альдегид.
При кислотном катализе альдольная реакция протекает через енольную форму, причем отщепление воды наблюдается почти всегда.
Примером альдолыюй реакции между различными альдегидами является образование пентаэритрита из ацетальдегида и формальдегида в присутствии гидроксида кальция. При этом в заключение протекает перекрестная реакция Канниццаро между образовавшимся альдегидом и молекулой формальдегида.
Аналогично альдегидам реагируют и кетоны, например:
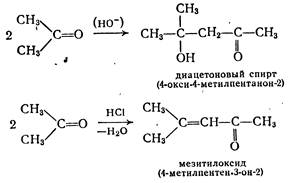
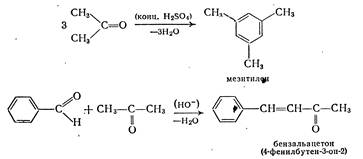
Как и в случае реакции бензальдегида с ацетоном, кетоны при реакции с альдегидами всегда играют роль метиленовой компоненты. В последнее время предпочитают использовать азометины альдегидов, поскольку для альдегидов, содержащих в α-положении атом водорода, предпочтительной является самоконденсация.
По схеме альдольной реакции протекают реакции и других С-Н-кислотных соединений с карбонильными соединениями. К ним относятся конденсация Кневенагеля, реакция Перкина и синтезы оксиранов (глицидный синтез) по Дарзану
3. Бензоиновая конденсация
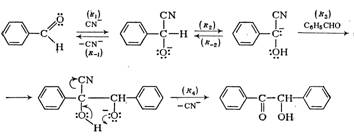
При действии водно-спиртовых растворов цианида калия арилальдегиды димеризуются в α-оксикетоны. Из бензальдегида образуется бензоин.
Считается доказанным следующий механизм этой реакции:
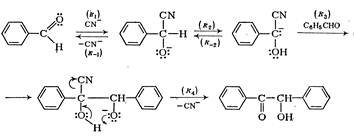
Как и в альдольной реакции, карбанион присоединяется к альдегиду.
Алифатические альдегиды дают в этих условиях не ацилоины, а альдоли, образования ацилоинов из этих соединений можно добиться, используя ферменты определенных видов дрожжей.
4. Реакция Канниццаро (1853 г)
Альдегиды, не содержащие в α-положении к карбонильной группе атома водорода, т.е. преимущественно ароматические альдегиды, в присутствии гидроксидов щелочных или щелочноземельных металлов диспропорционируют до спирта и кислоты.
В случае альдегидов, имеющих α-атом водорода, гораздо быстрее протекает альдольная реакция. Формально атом водорода одной молекулы альдегида в виде гидрид-иона переносится к связи С=О другой молекулы. Начинается этот процесс с присоединения гидроксил-иона. Затем с участием атома металла образуется комплекс, внутри которого и происходит гидридный перенос.
Если в реакции принимают участие два различных альдегида, то говорят о перекрестной реакции Канниццаро. В таком случае формальдегид всегда играет роль донора гидрид-иона.
Реакции конденсации.
Реакция конденсации - реакция образования больших Молекул из молекул с меньшей молекулярной массой, протекающая с отщеплением (или перемещением) атомов или атомных групп
Конденсации реакции, исторически закрепившееся в органической химии название большой группы реакций образования сложных соединений из двух или нескольких более простых. Конденсации реакции, различающиеся как по природе реагентов, так и по существу химических превращений, включают многие внутримолекулярные и межмолекулярные процессы образования новых углерод-углеродных (С - С) связей. Большинство таких реакций сопровождается выделением какой-либо простой неорганической или органической молекулы Х - Y (например, воды, водорода спирта, галогеноводорода, галогена):
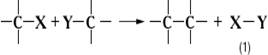
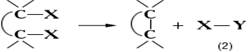
К этому типу Конденсации реакции относятся, например, кротоновая конденсация, Вюрца реакция, Клайзена конденсация, Кнёвенагеля реакция, Перкина реакция, Фриделя-Крафтса реакция и многие др. В отличие от указанных выше, такие Конденсации реакции, как бензоиновая конденсация, альдольная конденсация, диеновый синтез и др., происходят без выделения простой молекулы. Кроме того, Конденсации реакции в органической химии называют все реакции образования гетероциклических соединений; в этих процессах могут возникать новые связи: углерод - углерод, углерод - гетероатом, гетероатом - гетероатом. Обычно к Конденсации реакции не относят этерификацию, переэтерификацию, алкилирование и ацилирование по кислороду или по азоту и др. Однако реакции образования полимеров по этим схемам называют поликонденсацией.
Кротоновая конденсация.
Кротоновая конденсация, взаимодействие между двумя молекулами альдегида или кетона с отщеплением воды. Например, Кротоновая конденсация ацетальдегида приводит к кретоновому альдегиду (II):
CH3CHO+CH3CHO ® CH3CH(OH) ![]() CHO ® CH3-CH=CH-
CHO ® CH3-CH=CH-![]() На первой стадии Кротоновая конденсация происходит так называемая альдольная конденсация, приводящая (в случае альдегида) к альдолю (I); на второй - дегидратация продукта альдольной конденсации. Кротоновая конденсация происходит под действием сильных кислот (например, концентрированной серной кислоты) или оснований (KOH, NaOH, KCN или др.), чаще при нагревании. Альдегиды и кетоны реагируют только по a-метиленовой группе и могут вступать в Кротоновая конденсация с др. соединениями, содержащими активную СН2-группу, например с нитросоединениями:
На первой стадии Кротоновая конденсация происходит так называемая альдольная конденсация, приводящая (в случае альдегида) к альдолю (I); на второй - дегидратация продукта альдольной конденсации. Кротоновая конденсация происходит под действием сильных кислот (например, концентрированной серной кислоты) или оснований (KOH, NaOH, KCN или др.), чаще при нагревании. Альдегиды и кетоны реагируют только по a-метиленовой группе и могут вступать в Кротоновая конденсация с др. соединениями, содержащими активную СН2-группу, например с нитросоединениями:
CH3CHO+CH3CH2NO2 ® CH3CH=C (CH3) NO2 + H2O.
Кротоновая конденсация находит применение в органическом синтезе
Вюрца реакция
Вюрца реакция, метод синтеза насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или иодиды):
2RBr + 2Na ® R - R + 2NaBr.
B. p. открыта Ш.А. Вюрцем. (1855). P. Фиттиг распространил Вюрца реакция на область жирно-ароматических углеводородов (реакция Вюрца - Фиттига):
C6H5Br + 2Na + ВrC4H9 ® С6Н5 - С4Н9+ 2NaВr.
Клайзена конденсация
Клайзена конденсация, сложно эфирная конденсация, способ получения b-кето (или b-альдегидо) эфиров взаимодействием одинаковых или разных сложных эфиров в присутствии щелочных агентов. Типичный пример Клайзена конденсация - получение ацетоуксусного эфира из этилацетата в присутствии алкоголятов натрия, металлического натрия, гидрида или амида натрия CH3COOC2H5 + HCH2COOC2H5 ® CH3COCH2COOC2H5 + C2H5OH.
При использовании эфиров муравьиной кислоты образуются производные альдегидокислот:
HCOOC2H5 + C6H5CH2COOC2H5 ® C6H5CH (COOC2H5) CHO + C2H5OH.
Клайзена конденсация применяется также для получения др. b-карбонильных соединений.
Так, реакция сложных эфиров с нитрилами приводит к b-кетонитрилам, например:
CH3COOC2H5 + C6H5CH2CN ® CH3COCH (C6H5) CN+C2H5OH.
С кетонами образуются b-дикетоны (например, ацетилацетон):
CH3COOC2H5 + СН3СОСНз ® CH3COCH2COCH3 + C2H5OH.
Клайзена конденсация широко применяют в промышленности для получения разнообразных органических соединений, например ацетоуксусного эфира, ацетилацетона и их гомологов. Реакцию подробно исследовал (1887) немецкий химик Л. Клайзен.
Кневенагеля реакция
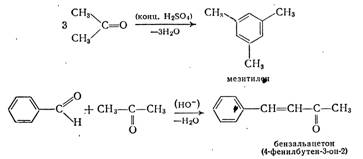
Кневенагеля реакция, конденсация альдегидов или кетонов с соединениями, содержащими активную метиленовую группу, в присутствии оснований с образованием производных этилена. Например, при конденсации бензойного альдегида (1) с диэтиловым эфиром малоновой кислоты (II) в присутствии пиперидина получается производное коричной кислоты (III).
Кневенагеля реакция широко применяется в лабораторном органическом синтезе, а также в химико-фармацевтической и парфюмерной промышленности. Реакция открыта немецким химиком Э. Кневенагелем (Е. Knoevenagel) в 1896.
Перкина реакция
Перкина реакция, метод синтеза b-арилакриловых кислот (коричной кислоты, её производных и аналогов) взаимодействием ароматических альдегидов с ангидридами карбоновых кислот в присутствии катализаторов основного характера (щелочных солей карбоновых кислот, карбонатов щелочных аминов).
Реакция открыта У. Перкином (старшим) в 1868; широко применяется в органической химии. Промышленное значение имеет синтез кумарина из салицилового альдегида и уксусного ангидрида.
Фриделя - Крафтса реакция
Фриделя - Крафтса реакция, способ алкилирования и ацилирования ароматических соединений в присутствии катализаторов кислотного характера, например AlCl3, BF3, ZnCl2, FeCI3, минеральных кислот, окислов, катионообменных смол. Алкилирующими агентами служат алкилгалогениды, олефины, спирты, сложные эфиры; ацилирующими - карбоновые кислоты, их галогенангидриды и ангидриды.
Ф. - К. р. - типичное электрофильное замещение в ароматическом ядре; роль катализатора сводится к генерации атакующей частицы - алкил - или ацилкатиона. Ниже рассмотрены примеры взаимодействия бензола с этилхлоридом и хлорангидридом уксусной кислоты:
C2H5CI + AlCl3 ® C2H5+ + [AICl4] -, C2H5 - + C6H6 ® C6H5C2H5 + H+;
CH3COCl + AlCl3 ® CH3CO+ + [AlCl4] -, CH3CO+ + C6H6 ® CH3COC6H6 + Н+;
[AlCl4] - + Н+ ® HCl + AlCl3.
Алкилированием по Ф. - К. р. в промышленности получают высокооктановые топлива, антиокислители, поверхностно-активные и душистые вещества, этилбензол (исходное вещество в производстве стирола) и др. важные продукты (см., например, Кумол, Тимол). Ацилирование по Ф. - К. р. - основной метод синтеза ароматических и жирно-ароматических кетонов, многие из которых являются промежуточными продуктами в производстве фармацевтических препаратов, разнообразных красителей (например, Михлера кетон).Ф. - К. р. открыта Ш. Фриделем и Дж. Крафтсом (1877-78).
Список литературы
1. Нейланд О.Я. Органическая химия, М.: Высшая школа, 1990, 751с.
2. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
3. Физер Л., Физер М. Реагенты для органического синтеза. Том 2.М., Мир, 1970, 390.
4. Гауптман, Ю. Грефе, Х. Ремане Органическая химия, Москва, "Химия", 1979, 832
5. Кнунянц И.Л. Большая Российская энциклопедия, М.: 2003, 972с.
6. Юрьев Ю.К. Практические работы по органической химии. Выпуск 1 и 2. Изд.3-е.М., Изд-во МГУ, 1964.
7. Юрьев Ю.К., Левина Р.Я., Шабаров Ю.С., Практические работы по органической химии. Выпуск 4.М. Из-во МГУ, 1969.
8. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.: Химия, 1994. - 848 с.
9. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
10. Моррисон Р., Бойд. Органическая химия. - М.: Мир, 1974. - 1132 с.
11. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
12. Робертс Дж., Кассерио М. Основы органической химии: В 2 т. - 2-е изд. - М.: Мир, 1978. - Т.1 - 842 с; Т.2 - 888 с.
13. В.Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
14. Птицина О.А., Куплетская Н.В., Тимофеева В.К. и др. Лабораторные работы по органическому синтезу. М.: Просвещение, 1979, 256с
Похожие работы
онная форма, а во втором енольная форма. Енолят-анионы могут реагировать с алкилгалогенидами по механизму SN2 (2) или с альдегидами и кетонами (3) енолят-анион кетон тетраэдральный промежуточный продукт присоединения к карбонильной группе Таутомерия Итак, подвижный атом водорода, хотя и очень медленно может переходить к кислороду с образованием, так называемой, енольной формы: ...
... вытяжку соединяют с органическим слоем из смеси, объединенный органический раствор в делительной воронке промывают 5 мл воды и отделяют водный слой. Сначала отгоняют бензол на водяной бане, потом бензальацетон в вакууме. Причем первые несколько миллилитров дистиллята, имеющего зеленоватый оттенок, отделяют. Собирают фракцию с температурой кипения 148—160°С (25 мм рт. ст.), имеющую светло-желтый ...
0 комментариев