Навигация
Дисперсная система
2. Теплоты нейтрализации NaOH и NH4OH соляной кислотой соответственно равны – 55,9 кДж/моль и – 51,34 кДж/моль. Рассчитать теплоту диссоциации NH4OH.
![]() (1)
(1)
Сокращенное ионное уравнение: ![]() (2)
(2)
![]() (3)
(3)
Ионное уравнение: ![]() (4)
(4)
![]() (5)
(5)
Отнимаем уравнение 2 от уравнения 4 и получаем:
![]() (6)
(6)
![]() (7)
(7)
Ответ: 4,56 кДж.
17. При температуре 298 К реакция заканчивается через 2,5 ч. Рассчитать, при какой температуре она закончится через 20 мин., если температурный коэффициент реакции равен 3.
Решение.
 Ответ: 297 К
Ответ: 297 К
22. Рассчитать максимальное количество фаз, которые могут сосуществовать в различных системах, состоящих только из молекул Н2О. Понятие тройной точки на диаграмме состояния воды.
В соответствии с правилом фаз Гиббса для равновесной гетерогенной системы число фаз плюс число степеней свободы равно числу компонентов плюс два:
Ф + С = К + 2.
число фаз Ф= К+2-С
Для воды: Ф=2+2-1=3
Понятие тройной точки на диаграмме состояния воды:
В тройной точке на диаграмме состояния воды находится равновесное состояние всех трех фаз. Если в других точках параметры системы можно изменять, то в точке равновесия фаз этого делать нельзя, так число степеней свободы в этой точке равно нулю.
42. Удельная и эквивалентная электропроводность раствора, их взаимосвязь и зависимость от степени и константы диссоциации электролита.
Электропроводность (способность проводить ток под действием постоянного электрического поля) растворов электролитов обусловлена переносом вещества (направленным движением ионов) и его химическими превращениями. В этом случае раствор называется проводником второго рода. Электропроводность такого раствора зависит прежде всего от природы электролита (от подвижности ионов), его концентрации в растворе, вязкости и температуры самого раствора и др. В проводниках первого рода (к ним относятся преимущественно металлы) переноса вещества не происходит.
Удельная электропроводность – величина, обратная удельному сопротивлению:
![]()
где cудельная электрическая проводимость, Ом – 1.см – 1;
ρ – удельное электрическое сопротивление, Ом · см.
Эквивалентная электропроводность – величина электропроводности, отнесенная к одному моль – эквиваленту электролита:
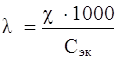 ,
,
где λ – эквивалентная электропроводимость, Ом – 1 · см2 · моль– 1;
Сэк – молярная концентрация эквивалентов раствора электролита, моль/л.
Эквивалентная электропроводность зависит от подвижности анионов и катионов и возрастает с увеличением разбавления, достигая предельного значения в бесконечно разбавленном растворе. В этом случае
= o– + o+,
где ![]() – эквивалентная электропроводность в бесконечно разбавленном растворе, Ом – 1 см2
моль– 1; о+ ио– – предельные подвижности ионов (эквивалентные электроподвижности катиона и аниона при бесконечном разбавлении), Ом – 1 · см2.
– эквивалентная электропроводность в бесконечно разбавленном растворе, Ом – 1 см2
моль– 1; о+ ио– – предельные подвижности ионов (эквивалентные электроподвижности катиона и аниона при бесконечном разбавлении), Ом – 1 · см2.
Уравнение представляет собой эмпирический закон Кольрауша: эквивалентная электропроводность при бесконечном разбавлении равна сумме предельных электроподвижностей ионов.
Эквивалентная электропроводность зависит также от степени диссоциации и константы диссоциации электролита, которые связаны уравнениями:
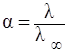
где α – степень диссоциации электролита,
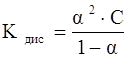 ,
,
где Кдис – константа диссоциации электролита;
С – молярная концентрация раствора, моль/л.
Похожие работы
... , чтобы подчеркнуть, что дисперсной средой является жидкость. Если дисперсной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость – органозолями. Дисперсные системы могут быть свободнодисперсными и связнодисперсными в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, ...
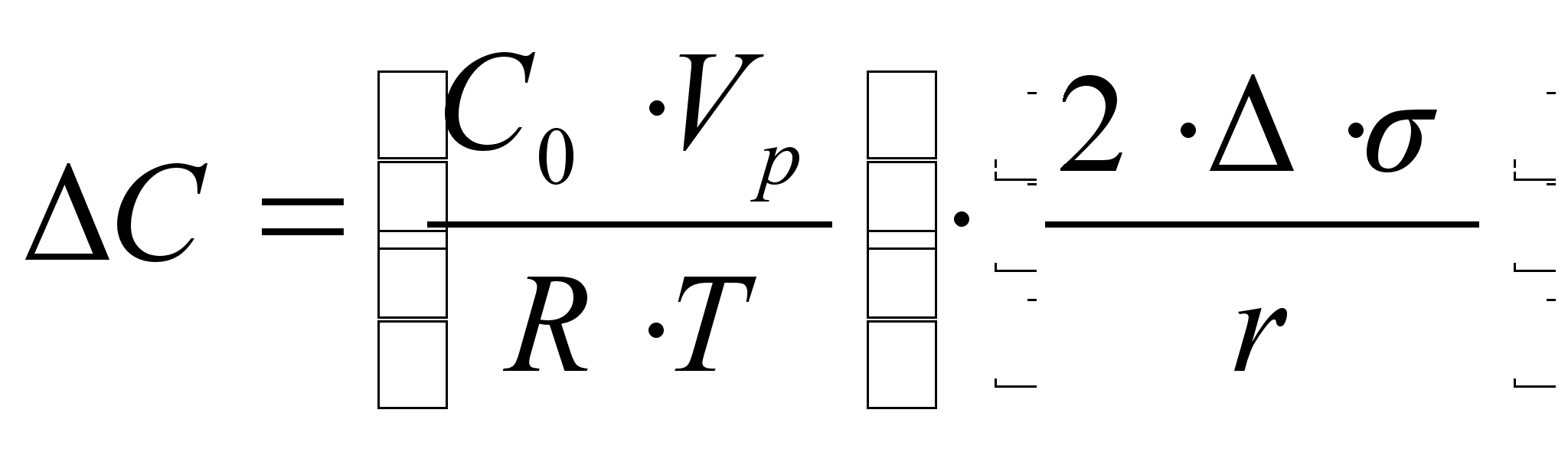
... , а -потенциал уменьшается, постепенно приближаясь к нулю. При разбавлении системы, наоборот, диффузный слой расширяется и -потенциал возрастает. II.Электрокинетический потенциал Протекание электрокинетических явлений в дисперсных системах возможно при наличии на границе раздела фаз двойного электрического слоя, имеющего диффузное строение. При относительном смещении фаз происходит разрыв ...
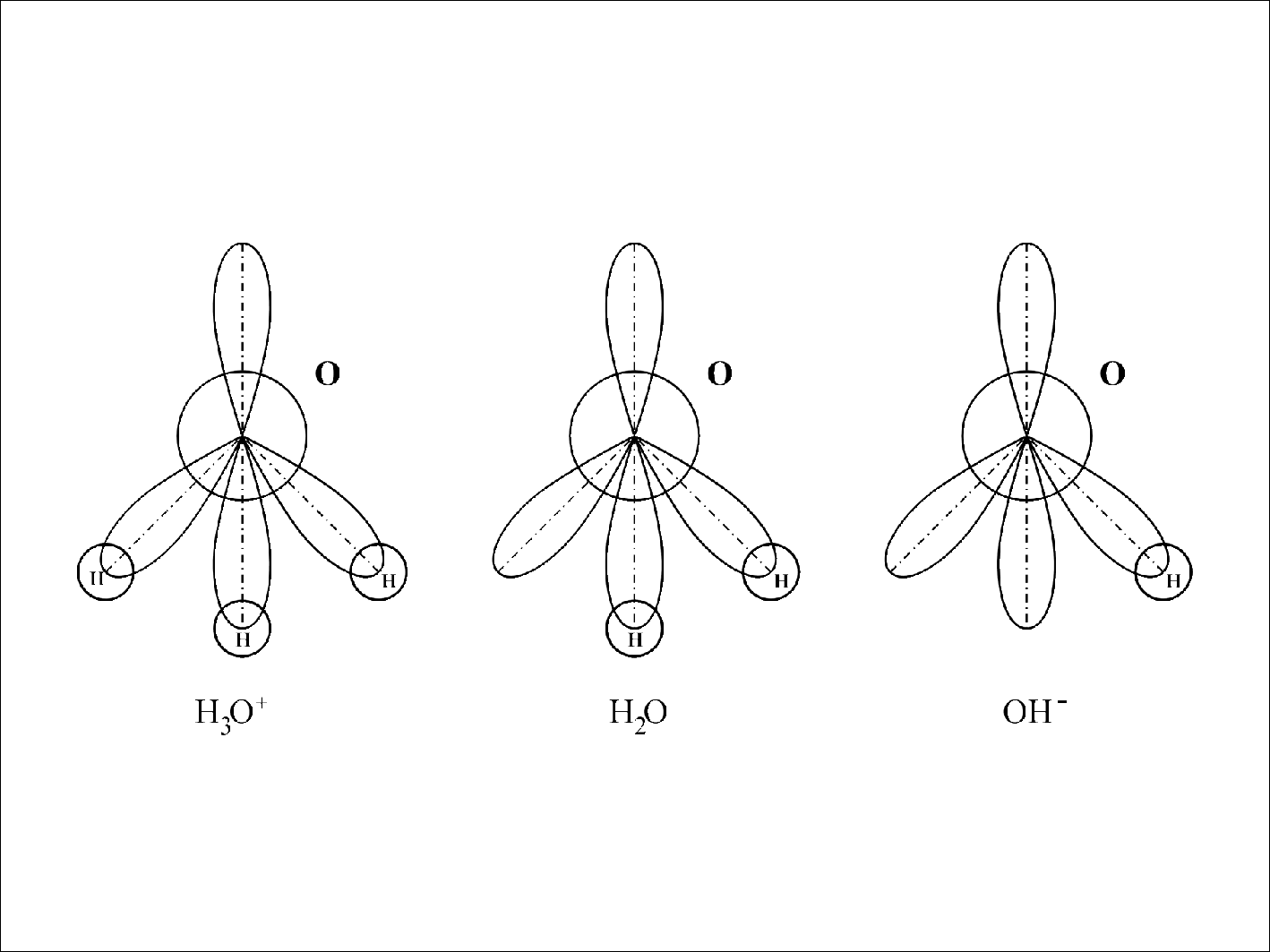
... на поверхность. Величины адсорбции ионов Н3О+ и OH- обусловлены особенностям химического состава, кристаллической структуры и состояния поверхности частиц дисперсной фазы. Свойства межфазных границ «вода – дисперсная фаза» зависят также от поверхностного потенциала воды. Известно, что в нейтральной среде поверхность воды имеет отрицательный потенциал -450 мВ, несмотря на то, что концентрация ионов ...
... и многое другое, без чего немыслима сама жизнь. Все человеческое тело – это мир частиц, находящихся в постоянном движении строго по определенным правилам, подчиняющимся физиологии человека. Коллоидные системы организмов обладают рядом биологических свойств, характеризующих то или иное коллоидное состояние: 2.2 Коллоидная система клеток. С точки зрения коллоидно-химической физиологии ...
0 комментариев