Навигация
Для фотоизомеризации соединения А предложен следующий механизм процесса
21. Для фотоизомеризации соединения А предложен следующий механизм процесса
k1
А+hν → А*
А* → А + hν'
k3
А* + А <=>А2
k-3
Найдите выражение для квантового выхода продукта А2. Зависит ли квантовый выход от интенсивности поглощенного света?
k1k3[А] - k-3k2[А]I-1
Ответ: γ= —————————
k2+ k3[А]
22. Для определения числа поглощенных квантов энергии соединением НХ(г) в актинометре используют следующую реакцию
HN3 + Н20 + hv → N2 + NH2OH.
Концентрация азота в растворе равна 43,1 ·10-5 М до облучения и 51,2 • 10-5 М после 30 мин пропускания света.
A. Рассчитайте число квантов энергии, поглощенных в 1 с со единением НХ(Г), зная, что объем актинометра равен 1 л.
Б. Оцените квантовый выход процесса, если известно, что при поглощении количества квантов, найденных в п. А, разлагается 0,158·10-3 моль НХ.
B. Согласуется ли полученное значение квантового выхода с величиной, рассчитанной для следующего механизма реакции
НX + hv→Н· + X
Н· + НХ→Н2 + Х
Х + Х→Х2.
Ответ: А.0,45·10-7 Эйнштейн·с-1 . Б. γ=1,95. В. γ = 2
Глава 3. Кинетика гетерогенных реакций
3.1 Примеры
3.1.1. Образец сплава металла А и В длиной 0,5 см и образец металла В длиной 0,5 см спаяны друг с другом. Определите время, за которое в результате диффузии А из сплава в чистый слиток В на расстоянии от спая 0,01 и 0,2 см установится относительная концентрация А (сА/с0), равная 0,2, и D=const=2·10-9 см2/с.
Решение: Для определения времени диффузии используем уравнение Фика . Вначале вычисляем t для х=0,01 см, предварительно определив Z по уравнению
с/с0 = ½(1-erfZ); 0,2=1/2(erfZ); erfZ=0,6~Z
Затем вычисляем время по уравнению
x x 0,01
Z = ————; √t= ——— = —————; t=9,6 ч.
2√Dt Z2√D 0,6·2√2·10-9
Проверяем надежность полученных результатов и применимость уравнения Фика. Для этого подставляем найденные величины в уравнение
0,5≥5,6√2·10-9·9,6·3600≥0,046
Условия применимости уравнения выполняются, так как l(xmax)>5,6√Dt.
Повторяем расчет и вычисляем t для х = 0,2 см:
0,2
Z=06 = —————— ; t=3875 ч.
2√2·10-9
Проверяем применимость уравнения для х = 0,2 см:
0,5 ≥ 5,6 √2-10-9·3875·3600 ≥0,93.
Условие применимости уравнения не выполняется: l (хта%) <с 5,6√Dt. Последний результат не надежен.
3.1.2. Рассчитайте время, за которое ширина диффузионной размы той зоны между сплавом АВ и металлом В станет равной 0,1см и D= const = 2-Ю-9 см2/ с.
Решение, Ширина диффузионной размытой полосы δ при диффузии в бесконечно протяженном теле (расстояние между фронтами диффузии) равна 2L или
δ = 2L = 2·5,б√Dt; 2,56√2.10-9t =0,1; t=11 ч.
3.1.3. На дно цилиндрического сосуда, залитого водой, помещен слой сахара. Сахар, растворяясь, диффундирует в объем раствора. Над сахаром раствор насыщен и концентрация его с0 постоянна. Высота столба жидкости 20 см. Вычислите, на каком растоянии х от границы раздела сахар—раствор относительная концентрация с/с0 станет рав ной 0,8 через 16 сут; D=0,25 см2/сут. Учтите, что для данных условий (t, D), согласно уравнению , l = 11,2 см при 298 К.
Решение. Поскольку происходит нестационарная диффузия в полубесконечном пространстве, то для расчета используем уравнения :
0,8 = (1— erfZ); erf Z=0,2; Z = 0,2;
0,2 = х/2 √0,25·16; x = 0,8см.
1-е уравнение применимо для данных условий, так как l > х (11,2 > 0,8).
3.1.4. На дно цилиндрического сосуда, залитого водой, помещен слой сахара. Сахар, растворяясь, диффундирует в объем раствора. Над сахаром раствор насыщен и концентрация его с0 постоянна. Высота столба жидкости 20 см и D = 0,25 см2/сут. Рассчитайте количество са хара, которое перейдет в раствор с 1 см2 поверхности за 16 сут, если с0 = 2,565 моль/л.
Решение. Число молей сахара, растворившегося за 16 сут, рассчитываем по уравнению :
2cs D 2·2,565 0,25
J = —— √— = ———— √—— = 2,61·10-4
√π t 1000 16
моль/(сут·м2)
∆n = Jt =2,61·10-4·16 = 5,776·10-3 моль·cм2
mсахара =5,776·10-3·342,3 = 1,977 г/см2
3.1.5. Рассчитайте радиус молекулы белка, если его коэффициент диффузии в растворе сахара D= 6,39·10-7 см2/с, Т = 298 К. Считайте, что молекулы белка имеют сферическую форму.
Решение. Радиус молекулы белка рассчитываем по формуле
RT
r= ————
DNA
где n= 1,227·10-3 Па·с [М];
(8,314Дж/(моль·К))(298К)
r= ————————————————— =
(6,39·10-11м2/с)(6,02·1023)6·3,14(1,227·10-3Па·с)
= 2,79·10-9м.
3.1.6. Таблетка бензойной кислоты с площадью поверхности S= 2 см2 помещена в раствор бензойной кислоты. Объем раствора 20 л, концентрация 0,003 моль/л. Раствор размешивали, в результате чего за 5 мин растворилось 0,001 моль C6H5COOH. Можно принять, что практически концентрация раствора при этом не изменилась. Концентрация кислоты в насыщенном растворе cs = 0,024 моль/л (298 К). Коэффициент диффузии бензойной кислоты D ='0,75 см2/сут. Вычислите константу скорости растворения k, скорость диффузии β, толщину приповерхностного слоя δ.
Решение. На границе приповерхностного слоя и поверхности таблетки концентрация постоянна и равна с8. Концентрация в массе раствора в течение рассматриваемого времени тоже постоянна, поэтому поток вещества через приповерхностный слой можно считать стационарным и
dc ∆c cs-c
——— = —— = ———
dx ∆x δ
Для стационарного потока уравнение принимает вид
dn ∆n DS
—— = —— = —— (cs-c)
dt t δ
Константы скорости рассчитываем по следующему уравнению, для чего находим. DS/δ:
DS ∆n 0,001·60·24
——— = ———— = —————— = 13714 см3/сут
δ t(cs-c) 5(0,024-0,003)
Подставляем числа для нахождения k и β
13714 D 13714
k= ——— = 0,6857 сут-1; β = —— = ——— 6857 см/сут
20·103 δ 2
DS 0,75·2
δ= ———— = ———— = 1,09·10-4 см
13714 13714
3.1.7 Концентрация кислоты в насыщенном растворе cs = 0.024 моль/л (298 К). Коэффициент диффузии С6Н5СООН D=0,75 см2/сут. Концентрация раствора в ходе растворения изменялась. Таблетка бензойной кислоты с площадью поверхности S=2 см2 помещена в раствор бензойной кислоты.
| . |
Объем раствора 20 л, концентрация 0,003 моль/л. Раствор размешивали, в результате чего за 5 мин растворилось 0,001 моль С6Н5СООН. Определите время, за которое концентрация раствора станет равной 0,012 моль/л.
Решение. Поскольку концентрация раствора в рассматриваемом отрезке меняется, меняется и градиент концентраций в приповерхностном слое, т. е. процесс диффузии нестационарен. Используем уравнение. Так как
2,3 cs-c1
t1 =0; c1=0,003, то k = —— lg———
t2 cs-c2
Подставляем числа и решаем относительно t;
2,3 0,024-0,003
t2 = —— lg————— = 0,815 сут, или 19,55 ч.
0,6857 0,024-0,012
3.1.8. Металлический цинк площадью 20 см2 при 298 К растворяли в 700 см3 серной кислоты по уравнению
Zn + H2S04= ZnS04+ Н2
Вычислите скорость диффузии β и соотношение толщины диффузионных слоев (δ1/δ2) в опытах 1 и 3, используя следующие данные: Скорость перемешивания 400 об/мин.
Опыт ……… 1 2
τ, ч………………0 0,5 1
сH2SO4, г-экв/л……0,153 0,118 0,090
Скорость перемешивания 216 об/мин
Опыт…………….. 3
τ, ч………………... 0 0,5
сH2SO4, г-экв/л…… 0,080 0,069
Решение: Определяем константу скорости растворения. При t=0
2,3 ct=0
k= ——— lg———
t2 ct
Определяем скорость диффузии β для опыта 1:
2,3 0,153
k1= —— lg——— = 0,519 ч-1
0,5 0,118
Vk 700·0,519
β= —— = ———— 18,27 см/ч
S 20
Для опыта 3:
2,3 0,080
k3 = —— lg——— 0,296 ч-1
0,5 0,069
700·0,296
β3= ———— = 10,32 см/ч
20
По полученным значениям β рассчитаем толщину диффузионного слоя δ
D D δ1 10,32
δ1 = —— и δ3 = ——; —— = ——— = 0,56
β1 β3 δ3 18,27
Толщина диффузионного слоя при изменении числа оборотов уменьшилась почти в двое.
3.1.9. Над углем пропускают воздух при Р = const. В результате протекает реакция С + О2 = С02. Эффективную константу k*
определили при различных температурах. Результаты измерений и вычислений:
T, K…777 873 973 1073 1173 1273 1373 1673 (1/T)·103..1,290 1,145 1,026 0,930 0,85 0,785 0,728 0,636
k* …0,073 0,447 2,15 6,81 13,72 19,49 24,40 26,90
lg k*.-1,137 -0,35 0,332 0,832 1,137 1,29 1,369 1,429
Составьте уравнение типа
lgk = A/T+const.
Решение. Сопоставив уравнение lgk = AIT + const с уравнением, получим
Е —25,47·103
А =- — = —————— = 1 33- Ю3.
2,3 R 2,3·8,31
Для вычисления const подставляем в исследуемое уравнение значения lg k и 1/Т, относящиеся к кинетической области протекания реакции для 973 К:
0,332=—1,33· 103/973+ const,
откуда const = 0,244. После подстановки чисел получим
lg k = 0,244 — 5573/T.
3.1.10. При исследовании кинетики реакции бромирования серебра Ag + VaBra = AgBr получены следующие данные (500 К, Рвг,= .— 170 мм рт. ст.):
t,c……………….. 1000 2000 3000 4000 6000
(∆m/S)·102, г/см2.. 1 1,34 1,61 1,84 2,24
(∆m/S)2·104, г/см4.. 1 1,8 2,6 3,4 5_
Какие выводы о типе реакции можно сделать на основании результатов опыта? Вычислите константу скорости реакции.
Решение. Поскольку на металлическом серебре в ходе реакции образуется бромид серебра, можно предположить, что скорость реакции лимитируется скоростью диффузии Ag или Br через слой AgBr. Для проверки предположения строим графики зависимостей Am/S == ƒ(t)(1) и (∆m/S)2. = ƒ(t) (2). Прямая в координатах (∆m/S)2 — t подтверждает предположение о том, что реакция протекает в диффузионной области. Константу скорости k* находим из графика как тангенс угла наклона прямой:
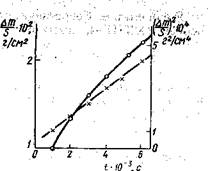 |
tgα = k = 8,0·10-8 г2/(см4с).
0 комментариев