Навигация
7. ВИСУТ
(лат. Bismuthum). Висмут известен с 15 века, но его долго принимали за разновидность олова, свинца или сурьмы. В 1529 немецкий ученый в области горного дела и металлургии Г. Агрикола дал первые сведения о металлическом висмуте, его добыче и переработке. Химическую индивидуальность висмута первым установил в 1739 И. Потт. Введен в химическую номенклатуру в 1819 году шведским химиком Й. Берцелиусом. В периодической системе висмут — последний стабильный (не радиоактивный) элемент. По некоторым данным, 209Bi слабо радиоактивен, но его период полураспада столь велик (около 1017 лет), что этот нуклид можно считать стабильным. Содержание висмута в земной коре очень мало и составляет всего 9·10-7% (71-е место среди всех элементов). В природе иногда встречается в свободном виде. Висмут — редкий рассеянный элемент, его собственные минералы очень редки. Температура плавления 271,4°C (висмут — один из самых легкоплавких металлов), температура кипения 1564°C, плотность 9,80 кг/дм3. При плавлении висмут уменьшается в объеме (как лед), т. е. твердый висмут легче жидкого. При высоких давлениях существуют другие модификации металлического висмута. Висмут хрупок, легко растирается в порошок. Висмут — самый сильный диамагнетик среди металлов. В сухом воздухе висмут не окисляется, во влажной атмосфере постепенно покрывается пленкой оксидов. При нагревании выше 1000°С сгорает с образованием основного оксида Bi2O3. Источником висмута служат свинцовые, оловянные и другие руды, где он содержится как примесь. При промышленном получении висмута сначала из свинцовых и медных руд (содержание висмута в которых обычно составляет десятые и даже сотые доли процента) готовят концентрат. Концентраты перерабатывают гидрометаллургическим путем, иногда их подвергают металлотермической обработке (с использованием в качестве восстановителей кальция или магния). На заключительной стадии очистки висмута применяют экстракцию, различные химические и электрохимические методы. В России первые килограммы металлического висмута получил в 1918 К. А. Ненадкевич, разработавший технологию его выплавки. Основное применение висмута — его использование в качестве компонента легкоплавких сплавов. Висмут входит, например, в известный сплав Вуда, температура плавления которого ниже температуры кипения воды, во многие другие сплавы, используемые, например, при изготовлении легкоплавких предохранителей. Сплавы висмута и марганца характеризуются ферромагнитными свойствами и поэтому идут на изготовление мощных постоянных магнитов. Соединения висмута, особенно Bi2O3, применяют в стекловарении и керамике, в фармацевтической промышленности, в качестве катализаторов и др.
8.ГЕЛИЙ
(лат. Helium). Открытие гелия началось с 1868 года, когда при наблюдении солнечного затмения астрономы француз П.Ж. Жансен и англичанин Д.Н. Локьер независимо друг от друга обнаружили в спектре солнечной короны желтую линию (она получила название D3-линии), которую нельзя было приписать ни одному из известных в то время элементов. В 1871 Локьер объяснил ее происхождение присутствием на Солнце нового элемента. В 1895 году англичанин У. Рамзай выделил из природной радиоактивной руды клевеита газ, в спектре которого присутствовала та же D3-линия. Новому элементу Локьер дал имя, отражающее историю его открытия (греч. Helios—солнце). Поскольку Локьер полагал, что обнаруженный элемент- металл, он использовал в латинском названии элемента окончание «lim» , которое обычно употребляем в названии металлов. Таким образом, гелий задолго до своего открытия на Земле получил имя, которое окончанием отличает его от названий остальных инертных газов. В атмосферном воздухе содержание гелия очень мало и составляет около 5,27·10-4% по объему. В земной коре его 0,8·10-6%, в морской воде — 4·10-10 %. Источником гелия служат нефти и гелионосные природные газы, в которых содержание гелия достигает 2-3%, а в редких случаях и 8-10% по объему. Зато в космосе гелий- второй по распространенности элемент (после водорода): на его долю приходится 28% космической массы. В настоящее время гелий выделяют из природных гелионосных газов, пользуясь методом глубокого охлаждения (гелий снимается труднее всех остальных газов). Месторождения таких газов имеются в России, США, Канаде и ЮАР. Гелий содержится также в некоторых минералах (монаците, торианите и других), при этом из 1 кг минерала при нагревании можно выделить до 10 л гелия. Гелий — легкий негорючий газ, плотность газообразного гелия при нормальных условиях 0,178 кг/м3 (меньше только у газа водорода). Температура кипения гелия (при нормальном давлении) около 4,2К (или –268,93°C, это - самая низкая температура кипения). При нормальном давлении жидкий гелий не удается превратить в твердое вещество даже при температурах, близких к абсолютному нулю (0К). При давлении около 3,76 МПа температура плавления гелия 2,0К. Наименьшее давление, при котором наблюдается переход жидкого гелия в твердое состояние --- 2,5МПа (25 ат), температура плавления гелия при этом около 1,1 К (–272,1°C). В 100 мл воды при 20°C растворяется 0,86 мл гелия, в органических растворителях его растворимость еще меньше. Гелий используют для создания инертной и защитной атмосферы при сварке, резке и плавке металлов, при перекачивании ракетного топлива, для заполнения дирижаблей и аэростатов, как компонент среды гелиевых лазеров. Жидкий гелий, самая холодная жидкость на Земле,- уникальный хладагент в экспериментальной физике, позволяющий использовать сверхнизкие температуры в научных исследованиях (например, при изучении электрической сверхпроводимости). Благодаря тому, что гелий очень плохо растворим в крови, его используют как составную часть искусственного воздуха, подаваемого для дыхания водолазам. Замена азота на гелий предотвращает кессонную болезнь (при вдыхании обычного воздуха азот под повышенным давлением растворяется в крови, а затем выделяется из нее в виде пузырьков, закупоривающих мелкие сосуды).
9.БРОМ
К открытию брома привели исследования французского химика А. Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Эту жидкость, полученную также из морской воды, он назвал муридом (от лат. Muria - соляной раствор, рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом. Открытие брома сделало молодого и мало кому известного ученого знаменитым. После появления статьи Балара оказалось, что склянки с аналогичным веществом ждали исследования у немецких химиков К. Левига и Ю. Либиха. Бром - довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37·10-4% (примерно 50-е место). Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений. Собственные минералы брома - бромаргирит (бромид серебра AgBr) и эмболит (хлорид и бромид серебра) - чрезвычайно редки. Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода (65·10–4%), более богато бромом Мертвое море. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено в нашей стране в Кулундинской степи (Алтай). При обычных условиях бром - тяжелая (плотность 3,1055 г/см3) красно-бурая густая жидкость с резким запахом. Бром относится к числу простых веществ, жидких при обычных условиях. Температура плавления брома –7,25°C, температура кипения +59,2°C. В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800°C и быстро возрастает при дальнейшем росте температуры. Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20°C). В бромной воде протекает реакция с образованием бромоводородной кислоты. Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе. При работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях - спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная- от 35 г. Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде.
Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании.
Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло.
Для нейтрализации пролитого брома поверхность с ним надо немедленно покрыть кашицей из влажной соды Na2CO3.
Похожие работы
... Гадолина - первого исследователя минерала иттербита. Элемент, содержащийся в гадолиниевой земле (Gadolinia), получил название гадолиний (Gadolinium); в чистом виде он получен в 1896 г. Тербий, Terbium, Тb (65) История открытия этого элемента довольно запутана. Она начинается с черного минерала, найденного в 1788 г. близ деревни Иттерби в Швеции и получившего название гадолинита. В 1797 г. ...
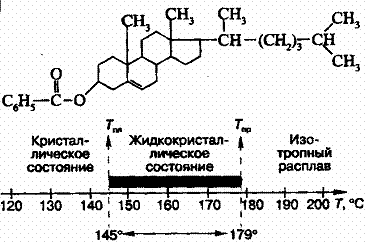
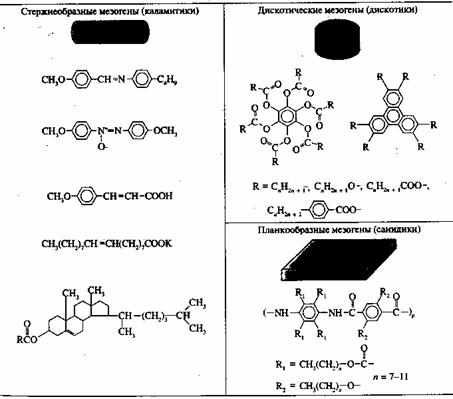
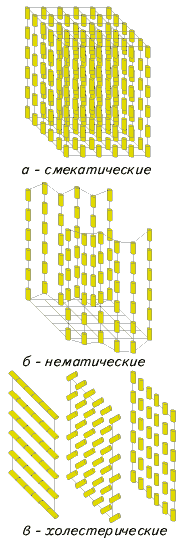
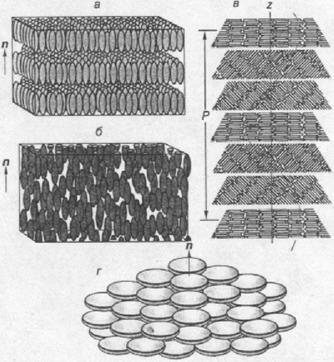
... кристаллов Сейчас известно уже около сотни тысяч органических веществ, которые могут находиться в ЖК-состоянии, и число таких соединений непрерывно растет. Если первые десятилетия после открытия жидких кристаллов основными представителями этих соединений являлись только вещества, состоящие из асимметрических молекул стержнеобразной формы, — так называемые каламитики (от греч. "каламис" — тростник ...
... », хорошо передававшими форму, пропорции, цвет и объем изображаемых объектов. Самые яркие образцы такого первобытного искусства были обнаружены в пещерах Южной Франции и Северной Испании. Они в первую очередь и вошли в Список Всемирного наследия. Истории человечества известен ряд последовательно сменяющих друг друга общественно экономических формаций: первобытнообщинная, рабовладельческая, ...
... художники. Они имели вид каменных плошек, изготовленных в технике пикетажа. В плошки наливали жир и клали фитиль. Они были обнаружены в Костенках, Мезине и Межирилах. Открытия памятников пещерного искусства. Впервые наскальная живопись была открыта лишь в конце XIX века. В 1868 году в Испании, в провинции Саятандер, близ Сантильяна-дель-Мар, охотник за козами обнаружил пещеру, вход в которую ...


0 комментариев