Навигация
Схема химических превращений
3.3 Схема химических превращений
Используемые для описания химических превращений в трубчатой печи и шахтном реакторе уравнения (1) – (3) являются итоговыми уравнениями реакций, которые фактически отражают баланс химических элементов до и после превращений. Детальный же механизм процесса может быть очень сложным. Например, реакцию метана с водяным паром на поверхности никелевого катализатора можно представить следующей совокупностью стадий:
1. СН4 + Z ![]() ZCН2 + Н2 ,
ZCН2 + Н2 ,
2. ZCН2 + Н2О ![]() ZCНOH + Н2 ,
ZCНOH + Н2 ,
3. ZCНOH ![]() ZCO + Н2 ,
ZCO + Н2 ,
4. ZCO ![]() Z + CO ,
Z + CO ,
5. Z + Н2О ![]() ZO + Н2 (равновесная стадия),
ZO + Н2 (равновесная стадия),
6. ZО + CО ![]() Z + СО2 (равновесная стадия).
Z + СО2 (равновесная стадия).
Здесь Z – активный центр на поверхности катализатора.
Для описания процесса конверсии метана итоговыми уравнениями, связывающими исходные вещества СН4 и Н2О и продукты Н2, СО, и СО2 , достаточно написать 2 линейно независимых уравнения реакций, например, уравнения (1) и (2). Любое другое уравнение, связывающее эти вещества, можно будет получить из первых двух. Уравнение (2) описывает конверсию СО в аппаратах 5 и 6.
3.4 Физико-химические основы процесса конверсии метана [3]
Конверсия природною газа может быть осуществлена либо термическим разложением метана
СН4 à С+2Н2 – 18,1 ккал (1)
либо каталитическим окислением метана водяным паром, кислородом и двуокисью углерода:
СН4 + 0,5О2 à CO + 2H2 + 8,5 ккал (2)
СН4 + H2O « CO + 3H2 – 49,3 ккал (3)
СН4 + CO2 « 2CO + 2H2 – 59,1 ккал (4)
СО + H2O « CO2 + H2 + 9,8 ккал (5)
Выбор окислителей и их возможные сочетания определяются назначением процесса и технологической схемой дальнейшей переработки полученного газа.
Реакции (1) — (2) практически необратимы. Реакции (3) — (5) являются обратимыми, т. е. в зависимости от условий, в которых они осуществляются, могут проходить как слева направо, так и справа налево.
Вследствие обратимости реакции прямой процесс невозможно осуществить до конца. В самом деле, в обратимых реакциях, например в реакции (3), оба процесса—прямой (взаимодействие метана с водяным паром) и обратный (взаимодействие окиси углерода с водородом) — протекают одновременно. При достаточно высоких температурах и концентрациях метана в газовой смеси скорость прямой реакции гораздо больше, чем скорость обратного процесса. Постепенно скорости прямого и обратного процессов выравниваются и наступает химическое равновесие, при котором в смеси присутствуют как исходные вещества, так и продукты реакции.
Равновесный состав газа для обычно применяемых в промышленности исходных газовых смесей и интервале температур 827—1027°С приведен в табл.1).
С изменением температуры, давления и состава исходной смеси равновесный состав газа также изменяется. При повышении температуры увеличиваются скорости обеих реакций (прямой и обратной), но увеличиваются они в разной степени. В случае реакций, протекающих с поглощением тепла (эндотермических реакций), например реакции (3), скорость прямой реакции возрастает гораздо больше, чем скорость обратной реакции. В результате этого равновесие сдвигается вправо, т. е. в сторону уменьшения содержания метана в конвертированном газе. В случае же реакций, протекающих с выделением тепла (экзотермических реакций), например реакции (5), равновесие сдвигается влево, т. е. степень конверсии окиси углерода снижается.
Таблица 1. Равновесный состав газа в процессе конверсии метана для обычно применяемых в промышленности исходных газовых смесей при абсолютном давлении 1 ат
| Температура °С | Состав сухой газовой смеси при равновесии, объемн. % | ||||
| CO2 | СО | H2 | СН4 | N2 | |
| Исходная смесь СН4 : H2O = 1 : 2 | |||||
| 827 927 | 4,62 3,78 | 19,20 20,27 | 76,08 75,94 | 0,10 0,01 | --- --- |
| Исходная смесь СН4 : H2O : O2 = 1 : 1 : 0,6 | |||||
| 827 927 | 9,44 8,06 | 22,91 24,98 | 67,61 67,16 | 0,045 0,0056 | --- --- |
| Исходная смесь СН4 : H2O : O2 : N2 = 1 : 1 : 0,6 : 0,9 | |||||
| 827 927 | 7,30 6,22 | 17,74 19,13 | 52,35 51,84 | 0,04 0,004 | 22,57 22,81 |
| Исходная смесь СН4 : H2O : СO2 : О2 = 1 : 0,7 : 0,3 : 0,6 | |||||
| 827 927 | 11,95 10,41 | 28,94 31,18 | 59,06 58,40 | 0,05 0,005 | --- --- |
| Исходная смесь СН4 : H2O : СO2 = 1 : 1,3 : 0,7 | |||||
| 827 927 1027 | 7,67 6,50 5,63 | 31,59 33,25 34,48 | 60,63 60,24 59,89 | 0,11 0,013 0,002 | --- --- |
Изменение давления влияет на равновесный состав газа только тогда, когда в результате реакции изменяется объем газа (при постоянном давлении), т. е. когда общее число молей (объемов) исходных веществ отличается от числа молей (объемов) продуктов реакции. Равновесный состав газа для реакций, протекающий без изменения объема, например, реакции (5), не зависит от давления.
Реакция (3) протекает с увеличением объема: из двух объемов исходной смеси получается четыре объема конвертированного газа, поэтому при повышении давления равновесие смещается влево, т. е. степень конверсии метана снижается. Например, для исходной смеси состава СН4 : H2O = 1 : 2 при 827°С и давлениях 10, 20 и 40 атм содержание метана в конвертированном газе составляет соответственно 5, 10 и 16% (рис. 5).
Для того чтобы остаточное содержание метана в конвертированном газе не увеличивалось при повышении давления, необходимо одновременно повысить температуру. Так, например, чтобы получить при указанном составе исходной смеси газ с остаточным содержанием метана 0.5% при абсолютном давлении 10 атм, нужно повысить температуру до 960°С, а при 20 атм — до 1060°С. Несмотря на это, проведение процесса конверсии при умеренном давлении (20 — 30 атм) экономически целесообразно, так как в данном случае уменьшается расход энергии на сжатие конвертированного газа, а также снижаются капитальные затраты на сооружение конверсионной установки.
При увеличении концентрации реагирующих веществ происходит также увеличение концентрации образующихся веществ. Для рассматриваемой реакции (3) повышение содержания водяных паров в исходной смеси приведет к смещению равновесия вправо, т. е. к увеличению содержания СО и водорода и уменьшению содержания метана в конвертированном газе. Увеличение количества добавляемого водяного пара особенно важно, когда конверсия метана осуществляется при повышенном давлении. Например, применяя исходную смесь СН4 : H2O = 1 : 4 при давлении 10 атм, можно получить конвертированный газ, содержащий 0,5% метана, при 850°С, т. е. на 110°С ниже, чем при составе исходной смеси 1 : 2.
Скорость реакции взаимодействия метана с водяным паром, т. е. количество метана, прореагировавшего в единицу времени, в отсутствие катализатора очень мала. Так, при нагревании смеси метана с водяным паром до 700°С и соотношении
СН4: H2O = 1 : 2 в течение 3 ч только 3% метана превращается в водород.
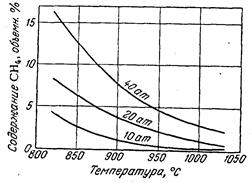
Рис.5. Зависимость остаточного содержания метана в конвертированном газе от температуры.
Для получения газа, содержащего 0,5% метана, требуется повысить температуру до 1400°С. В производственных условиях конверсия метана должна протекать в течение долей секунды, что достигается путем применения катализаторов.
Похожие работы
... этот идет достаточно медленно, еще далеко не все вопросы решены. Ожидают, что … вот-вот будет. Еще двадцать пять лет назад можно было видеть "Рафик" на топливных элементах. Впрочем, истории водорода как топлива тоже не один десяток лет. "Водородное будущее" автотранспорта эксперты связывают, прежде всего, с топливными элементами. Их притягательность признают все. Никаких движущихся частей, ...
... , то требуются дополнительные операции (например, извлечение жидкими или твердыми сорбентами). Рис.1. Катионитовый фильтр: 1 – катионит; 2 – песок Трудно провести границу между адсорбционными и каталитическими методами газоочистки, так как такие традиционные адсорбенты, как активированный уголь, цеолиты, служат активными катализаторами для многих химических реакций. Очистку газов на ...
... радикал (изопропил); (СН3)3С— - третичный одновалентный радикал (mpem-бутил). 1.2. Номенклатура и изомерия Номенклатура. Для названия предельных углеводородов применяют в основном систематическую и рациональную номенклатуры. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с ...
... продукта, то установку снабжают блоком PSA (Pressure-Swing-Adsorption) (см. рис. 16). В таблице 6 представлены некоторые характеристик процессов конверсии метана. Таблица 6 Сравнительные технико-экономические показатели процессов получения синтез-газа. Показатели Паровая конверсия углеводородного газа Двухступенчатая конверсия в системе конвертеров "Тандем" Паро- ...
0 комментариев