Навигация
11. Явление катализа
Одно из наиболее сильных средств воздействия на скорость химических реакций — использование катализаторов.
Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Влияние катализаторов на скорость реакции называется катализом. Когда взаимодействующие вещества и катализатор находятся в одном агрегатном состоянии, говорят о гомогенном катализе. При гетерогенном катализе реагирующие вещества и катализатор находятся в различных агрегатных состояниях: обычно катализатор — в твердом, а реагирующие вещества — в жидком или газообразном (пример: в случае окисления SO2 в SO3 в присутствии платины или оксида ванадия (V) происходит гетерогенный катализ).
12. Обратимые реакции
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении.
Например, если смешать пары иода с водородом при температуре 200°С, то произойдет реакция:
![]()
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:
![]()
Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях. называются обратимыми.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:
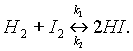
Реакцию, протекающую слева направо называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
13. Химическое равновесие
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реация в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
13.1 Константа равновесия, степень превращения
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции, которую в общем виде можно записать как
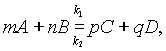
согласно закону действующих масс, скорости прямой реакции v1 и обратной v2 соответственно запишутся следующим образом:
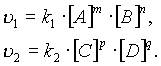
В момент достижения состояния химического равновесия скорости прямой и обратной реакций равны:
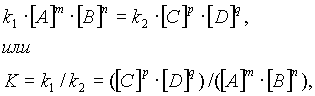
где К — константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций.
В правой части первого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии, — равновесные концентрации.
Второе уравнение представляет собой математическое выражение закона действующих масс при химическом равновесии.
Этот закон является одним из наиболее важных в химии. Исходя из кинетического уравнения любой химической реакции, можно сразу же записать отношение, связывающее равновесные концентрации реагирующих веществ и продуктов реакции. Если определить константу К экспериментально, измеряя равновесные концентрации всех веществ при данной температуре, то полученное значение можно использовать в расчетах для других случаев равновесия при той же температуре.
Численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик, так как при этом
![]()
Понятно, что при К << 1 выход реакции мал.
Похожие работы
... датчика и осциллографа. Экспериментальные кривые зависимости времени τ горения частиц от давления p, соответствуют теоретической зависимости. Представляют интерес экспериментальные исследования процесса горения отдельной угольной частицы, движущейся в потоке газа. Такого рода опыты проводили Н. И. Сыромятников и 3.И.Леонтьева. После воспламенения частицы наблюдалось замедление скорости ее ...
... реагирующего вещества. 4. Провести практическую часть исследования согласно выбранным методикам. 5. Проанализировать полученный результат и сформировать выводы. Объект исследования: скорость химической реакции. Предмет исследования: влияние катализаторов, температуры, концентрации вещества, площади соприкосновения, природы реагирующего вещества и давления. Методы исследования ...
... подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы. 3.2 «Триумфальное шествие органического синтеза» Возникновение структурной теории позволило химикам впервые обрести ...
... . Термодинамические функции ΔG, ΔS, ΔH для электрохимических реакций рассчитывают по уравнениям: ΔG = - nEF, (2.20) , (2.21) , (2.22) , (2.23) , (2.24) где n – число электронов, участвующих в реакции; F – число Фарадея, Кл; E – ЭДС, В. 2.2 Задачи с решениями электролит проводимость потенциал кинетика 1. Гальванический элемент состоит из металлического цинка, ...
0 комментариев