Навигация
Химические свойства воды
1.3 Химические свойства воды
Вода – простейшее устойчивое химическое соединение водорода и кислорода (окись водорода - Н2O), одно из самых распространённых соединений в природе, играющее исключительно важную роль в процессах, происходящих на Земле.
Известно 3 изотопа водорода (1Н – протий; 2Н, или Д, - дейтерий; 3Н, или Т, - тритий) и 6 изотопов кислорода (14О, 15О, 16О, 17О, 18О, 19О), так что существует большое количество изотопных разновидностей молекул воды. Молекула воды представляет собой равнобедренный треугольник с ядрами О и Н в вершинах.
Химически чистая вода состоит почти исключительно из молекул Н2O. Незначительная доля молекул (при 25ºС – примерно одна на 5·109) диссоциирует по схеме Н2O ↔ Н+ + ОН-. Протон Н+ в водной среде существовать в свободном состоянии не может и, взаимодействуя с молекулами воды, образует комплексы Н5 О2+. Хотя степень диссоциации в воде ничтожна, она играет большую роль в химических процессах, происходящих в различных системах, в том числе и биологических. В частности, она является причиной гидролиза солей слабых кислот и оснований и некоторых других реакций, протекающих в воде.
Вода взаимодействует со многими элементами и веществами. Так, при реакции воды с наиболее активными металлами выделяется водород и образуется соответствующая гидроокись. При реакции со многими окислами образуются кислоты или основания. Вода гидролизует гидриды и карбиды щелочных и щелочноземельных металлов и другие вещества.
Глава 2. Жёсткость воды и методы её устранения
2.1 Определение жёсткости воды
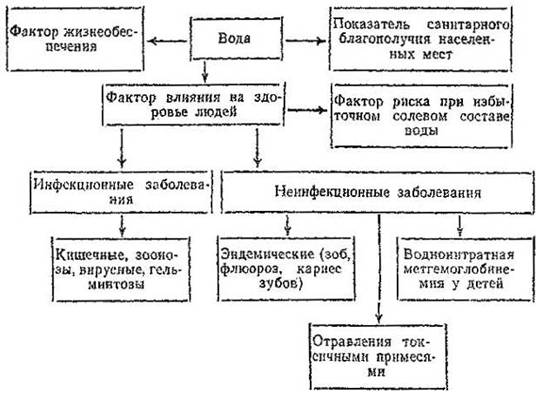
Природная вода обязательно содержит растворённые соли и газы (кислород, азот и др.). Присутствие в воде ионов Mg2+ и Са2+ и некоторых других, способных образовывать твёрдые осадки при взаимодействии с анионами жизненных органических кислот, входящих в состав различных мыл (например, со стеарат-ионом С17Н35СОО2-), обуславливает так называемую жёсткость воды.
Во всех просмотренных нами научных источниках, понятие жёсткости воды обычно связано с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жёсткость. Они взаимодействуют с анионами, образуя соединения (соли жёсткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают.
В данной таблице приведены основные катионы металлов, вызывающие жёсткость, и главные анионы, с которыми они ассоциируются:
| Катионы | Анионы |
| Кальций (Са2+) | Гидрокарбонат (HCO3-) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl-) |
| Железо (Fe2+) | Нитрат (NO3-) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жёсткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трёхвалентное железо (Fe3+) также влияют на жёсткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, "вклад" в жёсткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Чем выше концентрация указанных двухзарядовых катионов Mg2+ и Са2+ в воде, тем вода жёстче. Наличие в воде этих катионов приводит к тому, что при использовании, например при стирке, обычного мыла (но не синтетического моющего средства) часть его расходуется на образование с этими катионами нерастворимых в воде соединений так называемых жирных кислот (мыло представляет собой смесь натриевых и калиевых солей этих кислот):
2С17 Н35 СОО- + Са2+ = (С17Н 35СОО)2Са↓
2С17Н 35 СОО- + Мg2+ = (С17Н 35СОО)2Mg↓
и пена образуется лишь после полного осаждения ионов.
Мыла – это натриевые (иногда калиевые) соли органических кислот, и их состав можно условно выразить формулой NaR или KR, где R – кислотный остаток. Анионы R образуют с катионами кальция и магния нерастворимые соли CaR2 и MgR2 . На образование этих нерастворимых солей и расходуется бесполезно мыло. Таким образом, при помощи мыльного раствора мы можем оценить общую жёсткость воды, общее содержание в ней ионов кальция и магния.
Ионы кальция (Ca2+) и магния (Mg2+), а также других щёлочноземельных металлов, обуславливающих жёсткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворённого диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий. В маломинерализованных водах больше всего ионов кальция. С увеличением степени минерализации содержание ионов кальция быстро падает и редко превышает 1 г/л. Содержание же ионов магния в минерализованных водах может достигать нескольких граммов, а в солёных водах нескольких десятков граммов.
В целом, жёсткость поверхностных вод, как правило, меньше жёсткости вод подземных. Жёсткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой.
Жёсткость - это особые свойства воды, во многом определяющие её потребительские качества и потому имеющие важное хозяйственное значение.
Для тушения пожаров, полива огорода, уборки улиц и тротуаров жёсткость воды не имеет принципиального значения. Но в ряде случаев жёсткость воды может создать проблемы. При принятии ванны, мытье посуды, стирке, мытье машины жёсткая вода гораздо менее эффективна, чем мягкая. Это обуславливается некоторыми фактами:
· При использовании мягкой воды расходуется в 2 раза меньше моющих средств;
· Жёсткая вода, взаимодействуя с мылом, образует “мыльные шлаки”, которые не смываются водой и оставляют малосимпатичные разводы на посуде и поверхности сантехники;
· Во многих промышленных процессах соли жёсткости могут вступить в химическую реакцию, образовав нежелательные промежуточные продукты.
Жёсткая вода образует накипь на стенках нагревательных котлов, батареях, чем существенно ухудшает их теплотехнические характеристики. Накипь является причиной 90% отказов водонагревательного оборудования. Поэтому к воде, подвергаемой нагреву в котлах, бойлерах и т.п. предъявляются на порядок более высокие требования по жесткости. Тонкий слой накипи на греющей поверхности вовсе не безобиден, так как продолжительность нагревания через слой накипи, обладающей малой теплопроводностью, постепенно возрастает, дно прогорает все быстрее и быстрее – ведь металл охлаждается с каждым разом все медленнее и медленнее, долго находится в прогретом состоянии. В конце концов, может случиться так, что дно сосуда не выдержит и начнёт протекать. Этот факт очень опасен в промышленности, где существуют паровые котлы.
Жёсткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, она ухудшает ещё и моющие свойства мыла. Катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают плёнки и осадки, в итоге снижая качество стирки и повышая расход моющего средства. А при стирке тканей жёсткой водой образующиеся нерастворимые соединения осаждаются на поверхности нитей и постепенно разрушают волокна.
Различают временную и постоянную жёсткость воды. Обусловлено это различие типом анионов, которые присутствуют в растворе в качестве противовеса кальцию и магнию.
Временная жёсткость воды обусловлена наличием в воде гидрокарбонатов, например, гидрокарбоната кальция Ca(HCO3)2 и магния Mg(HCO3)2.
При кипячении воды гидрокарбонаты разлагаются с образованием осадка среднего или основного карбоната:
Ca(HCO3)2 = СаСО3 ↓+ СО2↑+ Н2О,
Mg(HCO3)2 = Мg2 (ОН) 2 СО3↓ + 3СО2↑ + Н2О,
и жёсткость воды снижается. Поэтому гидрокарбонатную жёсткость называют временной.
Остальная часть жёсткости, сохранившаяся после кипячения воды, называется постоянной жёсткостью (или некарбонатная). Она обусловлена присутствием в ней сульфатов, хлоридов и других растворимых соединений кальция и магния, которые хорошо растворимы и так просто не удаляются.
Также различают и общую жёсткость воды. Она определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жёсткости.
Жёсткость воды измеряется в миллиграммах эквивалент на литр (м-экв/л). Обычно, жёсткой вода считается с жёсткостью 1 м-эвк/л и более.
Классификация воды по жёсткости
| Единицы измерения жёсткости воды | Миллиграмм на литр, мг/л | Миллиграмм эквивалент на литр, м-экв/л |
| Мягкая | <17,1 мг/л | <0,35 мг-экв/л |
| Средней жёсткости | 60-120 мг/л | 1,2-2,4 мг-экв/л |
| Жёсткая | 120-0180 мг/л | 2,4-3,6 мг-экв/л |
| Очень жёсткая | >180 мг/л | >3,6 мг-экв/л |
Особенно большой жёсткостью отличается вода морей и океанов. Так, например, кальциевая жёсткость воды в Чёрном море составляет 12 мг-экв/л, магниевая – 53,5 мг-экв/л, а общая – 65,5 мг-экв/л. В океанах же средняя кальциевая жёсткость равняется 22,5 мг-экв/л, магниевая – 108 мг-экв/л, а общая – 130,5 мг-экв/л.
Похожие работы
... питьевая Хрустальный колодёц-люкс 1,5л 80 000,000 Вода питьевая Хрустальный колодец-плюс 1,5л 300 000,000 Итог 2 059 500,000 Ассортимент питьевой воды, выпускаемый предприятием ОАО "Алиса" представлен 15 наименованиями, из них 13 составляют ароматизированные безалкогольные напитки и 2 наименования питьевой воды. Сроки хранения воды: - сладкая: 5-6 месяцев; - минеральная питьевая ...
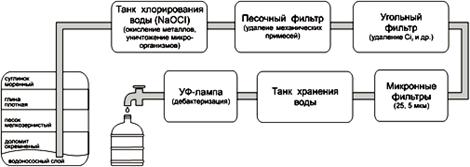
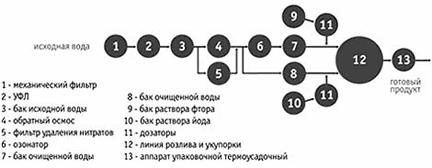
... на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия. С последствием жесткости воды - накипью, с точки зрения химии можно бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой более сильной. Последняя и занимает место угольной, которая, будучи неустойчивой, ...
... плавления ккалг-атом 2,1 2,2 1,8 Теплота испарения ккалг-атом 36 33 36 Удельная теплоемкость, Дж(кг.К) 624 737 191,93 136 Сжижаемость Па-1.10-11 5,92 8,36 Химические свойства щелочноземельных металлов и их соединений. Свежая поверхность Э быстро темнеет вследствие образования оксидной пленки. Пленка эта относительно плотна - с течением времени весь ...
... водорода. Именно так может диссоциировать и ион NH4: NH4+ NH3+H+ Реакция же -2e Mg0 + 2HCl=Mg+2Cl2+H02 2H++Mg Mg2++ H02 При нагревании магния в атмосфере галогенов происходит воспламенение и образование галоидных солей. -2e Mg + Cl20 Mg+2+Cl2- Причина воспламенения - очень большое тепловыделение, как и в ...


0 комментариев