Навигация
Реакции с участием нуклеофильного центра
1.2. Реакции с участием нуклеофильного центра
Высокая электроотрицательность атома кислорода (3,5 по шкале Полинга), являющегося основным центром, позволяет рассматривать спирты как слабые n-основания Бренстеда и жесткие основания по Пирсону. Неудивительно, что спирты способны образовывать соли оксония только с сильными протонными кислотами и жесткими кислотами по Пирсону (фторид бора, хлорид цинка и др.).
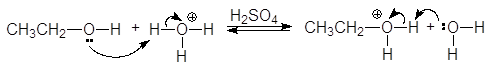 (30)
(30)
гидроний этилоксоний
Таким образом, спирты обладают слабыми кислотными и слабыми основными свойствами, т.е. являются амфипротонными соединениями.
При достаточно высокой температуре и в отсутствие хорошего нуклеофила протонированные спирты способны к реакции Е1, т.е. к реакции дегидратации.
Будучи жесткими основаниями, вследствие низкой поляризуемости и высокой электроотрицательности, атома кислорода спирты являются слабыми нуклеофилами. Кислоты Бренстеда протонируют атом кислорода гидроксигруппы.
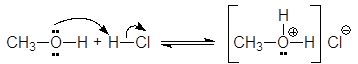 (31)
(31)
метилгидроксоний хлорид
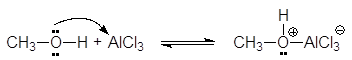
Кислоты Люиса образуют со спиртами доноро-акцепторные комплексы, в которых атом кислорода является донором неподеленной электронной пары.
 (32)
(32)
В общем, спирты являются сравнительно слабыми основаниями: значения pKa их сопряженных кислот ROH2+ составляют около -2. Разветвление алкильной группы в молекуле спирта увеличивает его основность.
К реакциям, протекающим с участием нуклеофильного центра, можно отнести реакции О-ацилирования и О-алкилирования спиртов.
А. О-Ацилирование
Спирты реагируют с карбоновыми кислотами с образованием сложных эфиров (эстеров) по реакции конденсации получившей название этерификация.
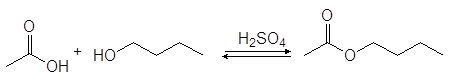 (33)
(33)
уксусная кислота 1-бутанол бутилацетат
Реакция этерификации катализируется кислотами. Без добавления кислоты равновесие достигается очень медленно, но если же смесь спирта и кислоты нагревать в присутствии небольшого количества концентрированной серной кислоты или хлороводорода равновесие устанавливается достаточно быстро.
В качестве ацилирующих реагентов могут использоваться как неорганические, так и органические кислоты, и их функциональные производные. С неорганически-ми кислотами без осложнений реагируют только первичные спирты, в результате чего образуются сложные эфиры (кислые или средние):
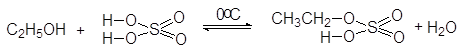 (34)
(34)
этилгидросульфат
Эта реакция имеет промышленное значение, т.к. с ее помощью из высших спиртов получают синтетические моющие средства:
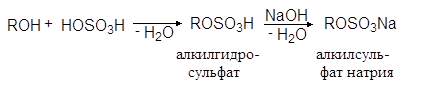 (35)
(35)
При использовании избытка спирта можно получать диалкилсульфаты. Так при нагревании метанола с олеумом получают диметилсульфат.
 (36)
(36)
Диметилсульфат - это нервный яд, он хорошо адсорбируется кожей. Его используют для получения метилиодида.
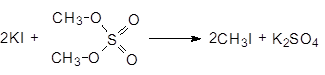 (37)
(37)
Вторичные и третичные спирты при нагревании с серной кислотой подвергаются дегидратации.
При действии на спирты азотной кислоты образуются нитраты. Тринитрат глицерина, неправильно называемый тринитроглицерином, является взрывчатым веществом, однако он очень чувствителен к удару, поэтому его применяют в виде динамита, представляющего собой опилки, пропитанные тринитроглицерином. Взрывчатыми веществами являются нитраты и других полиолов.
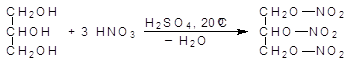 (38)
(38)
глицерин тринитрат глицерина
Спирты реагируют с фосфорной кислотой, давая алкилфосфаты:
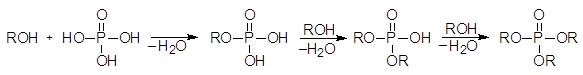 (39)
(39)
Фосфат фосфат
При нагревании фосфорной кислоты она превращается в ангидриды, называемые дифосфорной и трифосфорной кислотой. Ди- и трифосфорная кислоты также реагируют со спиртами давая эфиры. Эфиры фосфорной кислоты играют очень важную роль в биохимических реакциях. Особенно большое значение имеют эфиры трифосфорной кислоты. В воде они способны медленно гидролизоваться с выделением тепла. В организме эти реакции катализируются энзимами.
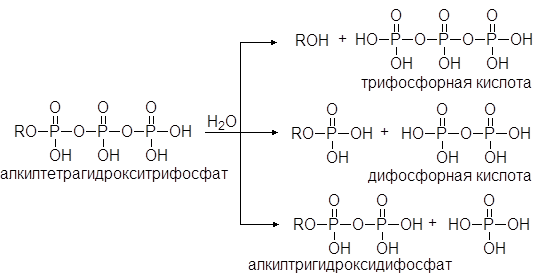 (40)
(40)
Б. О-Алкилирование
В качестве алкилирующих агентов используются галогенопроизводные, диалкилсульфаты и алкилсульфонаты. Для увеличения нуклеофильности спиртов их превращают в алкоксиды щелочных металлов.
![]() (41)
(41)
этоксид натрия пропилбромид пропилэтиловый эфир
Активность спиртов как нуклеофильных реагентов может быть увеличена, если использовать в качестве среды полярные апротонные растворители, например диметилсульфоксид. Растворители этого типа в меньшей степени сольватируют спирты, т.к. не образуют с ними водородных связей. Отсутствие сольватации повышает нуклеофильность спиртового атома кислорода. В этом случае можно использовать спирт и щелочь вместо алкоголята:
 (42)
(42)
бутилпропиловый эфир
Эта реакция, называемая синтезом Вильямсона, протекает по механизму SN2.
Использование в синтезе Вильямсона вторичных и третичных галогеноалканов приводит к получению простых эфиров с более низким выходом, поскольку нуклеофильное замещение сопровождается конкурентной реакцией дегидрогалогенирования с образованием алкенов. Также ограничено применение в синтезе Вильямсона алкоголятов вторичных и третичных спиртов, основность которых сопоставима с их нуклеофильностью, что способствует конкурентному протеканию реакции дегидрогалогенирования. Синтетические возможности реакции Вильямсона расширяются при использовании диалкилсульфатов и алкилсульфонатов вместо галогеноалканов. Этот вариант применется главным образом для метилирования и этилирования спиртов:
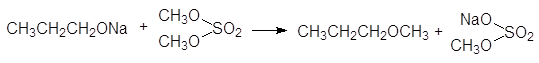 (43)
(43)
пропоксид натрия диметилсульфат метилпропиловый эфир
Похожие работы
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... взаимодействуют с концентрированным раствором дисульфита натрия с образованием кристаллических веществ, обычно называемых дисульфитными производными альдегидов и кетонов. Дисульфитные производные плохо рстворимы и используются для отделения альдегидов и кетонов. Присоединение происходит в результате нуклеофильной атаки дисульфит-иона по карбонильному атому углерода с последующим присоединением ...
... (2,2,5,5-тетраметил-3-имидазолин-3-оксид-4-ил)фенилметанолу и 2,2,5,5-тетраметил-4-триэтилгермил-3-имидазолин-3-оксиду. Подобраны условия, позволяющие провести литиирование 5,5-диметилпирролин-1-оксида и последующую реакцию с электрофильными реагентами селективно по альдонитронной группе на фоне активной метиленовой группы. Реакция литиированного производного альдонитрона 1,2,2,5,5-пентаметил ...
... в реакциях окисления. Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами. Реакции окисления и восстановления Реакции окисления. По отношению к различным окислителям свойства альдегидов и кетонов сильно различаются. Большинство окислителей, включая воздух, легко окисляют альдегиды до кислот. Особенно легко ...
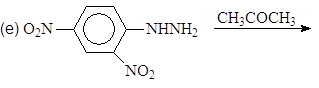


0 комментариев