Навигация
3. Расщепление аминов
Один из наиболее старых методов расщепления аминов заключается в нагревании сухой галоидоводородной соли алкиламина. В строго определенных условиях, зависящих главным образом от характера исследуемого вещества, удается отщепить одну или несколько алкильных групп и тем самым превратить третичный амин последовательно во вторичный, затем в первичный амин и, наконец, в аммиак. Например, при нагревании солянокислого триметиламина при 285° образуется смесь солянокислого диметиламина и свободного триметиламина с выделением хлористого метила. При более высокой температуре продукт реакции может содержать метиламин или хлористый аммоний. В случае высших алифатических аминов этот способ не получил применения. Более широкое применение он имеет для расщепления алкилариламинов; при нагревании метиланилина в слабом токе хлористого водорода образуются солянокислый анилин и хлористый метил. Аналогично ведет себя трибензиламин. При сухой перегонке солянокислого диметиланилина получаются хлористый метил, солянокислый анилин и метиланилин. Бромистоводородные соли моноалкилпроизводных анилина, от этиланилина до изоамиланилина, при нагревании в пределах от 250 до 300° разлагаются с отщеплением алкильной группы в виде смеси олефина и бромистого алкила. В этих условиях образование р-замещенных аминоалкилбензолов, вследствие перемещения алкильной группы в ядро, происходит лишь в незначительной степени. Если реакцию вести в закрытом сосуде, чтобы воспрепятствовать улетучиванию продуктов реакции, выход р-аминоалкилбензола увеличивается за счет уменьшения количества получающихся летучих продуктов. Эта перегруппировка впервые наблюдалась Гофманом.
Алкиланилины, содержащие у азота третичные алкильные группы, сравнительно легко их отщепляют; уже при нагревании таких алкиланилинов с водными минеральными кислотами до 110—140° в течение нескольких часов третичные алкильные группы отщепляются в очень значительной степени.
Интересно, что разложение солей аминов, в частности фосфорнокислых солей, может применяться для получения олефинов и, в особенности, диенов. По этому способу из у-амино-а-фенилбутана получается смесь фенилбутенов, из диаминометилпентана образуется метилпентадиен, а 1,3-диаминоцикло-гексан превращается при этом в 1,3-циклогексадиен. Этот способ может также быть использован для получения пентадиенов.
Другой тип расщепления наблюдается при действии тетранитрометана на третичные амины, причем образуются соответственные нитрозамины.
![]()
Диалкилариламины лучше всего реагируют с тетранитрометаном в присутствии пиридина, а алифатические амины — в уксусной кислоте. Общие условия расщепления диалкилариламинов по этому способу заключаются. Другой, менее общий способ расщепления аминов, основан на действии хлорноватистой кислоты или хлора на водный раствор алифатического третичного амина или циклического амина, например тропидина.
По мнению Мейзенхеймера реакция протекает следующим образом:
![]()
Для отщепления одной алкильной группы от третичных аминов обычно пользуются реакцией с бромистым цианом. Реакция эта протекает по уравнению
![]()
У третичных аминов, являющихся производными пиперидина, тетрагидрохинолина или дигидроизоиндола, может происходить либо нормальное образование цианамидов, либо размыкание цикла.
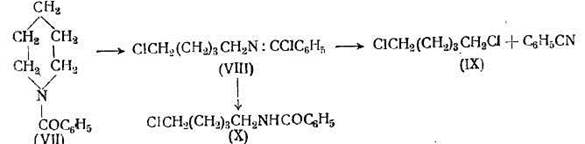
Более удовлетворительный способ размыкания цикла некоторых циклических аминов заключается в нагревании соответственных бензоильных производных с пятихлористым фосфором. Например, бензоилпиперидин (VII) гладко превращается в этих условиях в соединение (VIII), которое при гидролизе дает бензоиламино-ξ-хлорпентан (X) и дихлорпентан (IX)
4. Окисление аминов
При окислении первичных ароматических аминов образуются в зависимости от условий различные продукты.
При окислении первичных ароматических аминов кислотой Каро аминогруппа превращается в нитрозогруппу. У аминов жирного ряда процесс протекает более сложно, так как первоначально образующиеся продукты окисляются еще легче, чем исходные амины. При действии кислоты Каро на этиламин образуются наряду с основным продуктом реакции — уксусной кислотой — небольшие количества нитроэтана, ацетгидроксамовой кислоты, ацетоксима и ацетонитрила. Более удовлетворительные результаты получаются, если аминогруппа присоединена к третичному атому углерода. Например, из третичного бутиламина и третичного амиламина последовательно образуются соответственные алкилгидроксиламины и алкилнитрозосоединения. Ароматические амины гладко окисляются в соответственные нитрозосоединения
![]()
Эта реакция является довольно важной, так как представляет удобный способ получения нитрозопроизводных ароматических соединений. При дальнейшем окислении полученного таким образом нитрозосоединения образуется нитросоединение, причем этот способ введения нитрогруппы в ароматическое ядро применяется на практике в тех случаях, когда обычный метод нитрования оказывается непригодным.
При применении других окислителей реакция может быть направлена в сторону образования иных продуктов. Так, из анилина можно при определенных условиях получить азобензол и азоксибензол, фенилхинондиимин C6H5N:С6H4:NH, эмеральдин, черный анилин и р-бензохинон. При окислении в мягких условиях, а именно при действии перекиси свинца в уксуснокислой среде на эфирный раствор анилина образуются азобензол и фенилхинондиимин. Имеющиеся к настоящему времени опытные данные приводят к выводу, что образование сложных продуктов окисления анилина — эмеральдина и черного анилина — связано с полимеризацией фенилхинондиимина или его взаимодействием с непрореагировавшим анилином. По-видимому, получению р-бензохинона при окислении анилина хромовой кислотой в водном растворе предшествует образование черного анилина. Действительно, при окислении черного анилина двухромовокислой солью в разбавленной серной кислоте образуется р-бензохинон с выходом около 85% от теоретического; при применении в качестве окислителя перекиси свинца и серной кислоты выход р-бензохинона достигает 95%.
Этот способ пригоден также для получения гомологов р-бензохинона. Например, из о- или т-толуидина образуется р-толухинон, из р-ксилидина — р-ксилохинон. При окислении некоторых аминов, содержащих метильную группу в р-положении к аминогруппе, эта метальная группа отщепляется и образуются р-хиноны; из мезидина образуется 2,6-диметил-р-бензохинон, из псевдокумидина получается р-ксилохинон.
Методы синтеза дифениламина Синтез на основе анилина и анилиновой соли
93 г анилина и 93г солянокислого анилина (анилиновой соли) нагревают в течение 20 час. при 230° в эмалированном автоклаве с эмалированной гильзой для термометра. Давление поднимается до 6 атм. Если не имеется эмалированной гильзы для термометра, то можно просто нагревать при указанном давлении, следя за температурой масляной бани. Она примерно и а 25° выше, чем действительная температура внутри автоклава. .. Через два часа осторожно спускают через вентиль воду, так как даже следы ее вредно сказываются на течении реакции. Продувание повторяют три раза в течение часа, при этом выделяются также немного анилина и аммиак. Нагревать более 20 час не имеет смысла, так как при этом выход может только уменьшиться. После охлаждения содержимое автоклава переносят в фарфоровую чашку и прибавляют 1 л воды. Затем нагревают до 800С, подкисляют 30%-иой соляной кислотой до кислой реакции на конго и оставляют опять охлаждаться на ночь. Неочищенный дифениламин выделяется в виде твердой лепешки, которую можно легко отделить от маточного раствора, так как дифениламин не образует соли с разбавленной соляной кислотой. Отфильтрованный дифениламин расплавляют еще раз с некоторым количеством воды, экстрагируют небольшим количеством соляной кислоты и промывают разбавленным раствором соды.
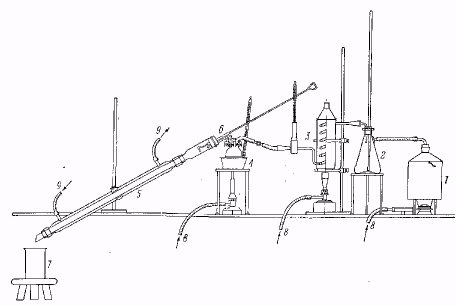
Лабораторная установка для перегонки с перегретым водяным паром.
1 – парообразователь, 2 – водоотделитель, 3 – пароперегреватель, 4 – перегонный сосуд в масляной бане, 5 – холодильник с широкой трубкой. 6 – приспособление для проталкивания твердого вещества, застрявшего в холодильнике, 7 – приемник для дистиллята, 8 – газовая горелка, 9 – водяное охлаждение.
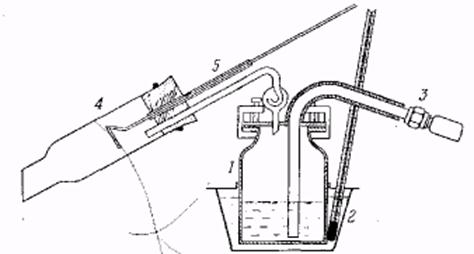
Лабораторный сосуд для перегонки с перегретым водяным паром. 1 – медный куб, 2 – масляная баня с термометром, 3 – соединение спароперегревателем, 4 – холодильник, 5 – приспособ для проталкивания.
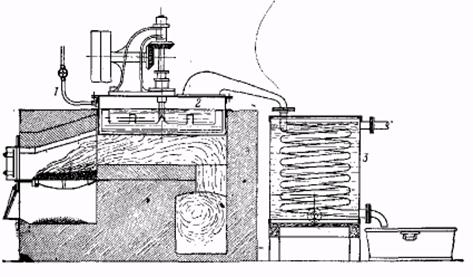
Производственная установка для перегонки с перегретым водяным паром а-нафтиламина, дифениламина и т. д. 1 – ввод перегретого водяного пара, 2 – перегонный сосуд с медленно вращающейся мешалкой, 3 – змеевиковый холодильник.
Полученный таким образом дифениламин очень загрязнен. Поэтому его следует перегнать с перегретым водяным паром. Для этого собирают аппаратуру, как показано на рисунках; перегонный сосуд берут емкостью примерно 500 мл. Масляную баню нагревают до 250° и затем приводят в действие перегреватель на обычной печи Флетчера. Пар должен быть тщательно высушен и перегрет до 300°. При хорошей перегонке легко удается с одной частью поды отогнать 0,5 части основания. Дифениламин получают в виде почти бесцветной жидкости, застывающей в бледно-желтую лепешку. После сливания поды получают около 100 г совершенно чистого дифениламина с т. пл. 51°.
Из кислого маточного раствора можно регенерировать около 35 г анилина.
Технические примечания. Должны быть эмалированы ни только нижняя часть, но и крышка автоклава. Следы железа или меди снижают выход дифениламина на 30—35% и вызывают осмоление. Экстракцию соляной кислотой проводят в деревянных чанах; перегонку с перегретым водяным паром осуществляют в приборе, изображением на рис. Для перегревания водяного пара применяют новые аппараты, например так называемый пароперегреватель Гейцмана и др. С одной частью воды можно перегонять при 2300 до одной части дифениламина.
Метод взаимодействия нитробензола с бромистым фенилмагнием
Действие нитробензола на бромистый фенилмагний. К бромистому фенилмагнию, полученному из 78,5 г бромбензола (0,5 моля) и 12 г магния, по каплям прибавлено 15,4 г нитробензола, разбавленного восьмикратным объемом абсолютного эфира. При этом реакционная смесь часто встряхивалась и охлаждалась. Через 15 мин. после прибавления всего нитробензола продукт реакции осторожно разложен льдом и к смеси прилита соляная кислота до сильно кислой реакции. Фенол из эфирного раствора многократно извлечен 10%-ным КОН; при добавлении к щелочному раствору хлористого натрия и соляной кислоты выделено 7,4 г фенола (выход 63%). Из эфирного раствора после отгонки эфира и перегонки в вакууме выделено 9,6 г дифенила (выход 50%) и 13,3 г дифениламина (выход 63%).
При взаимодействии тринитробензола с RMgBr (где R = алкил) после разложения водной уксусной кислотой выделен 1,3,5-триалкил-2,4,6-тринитроциклогексан.
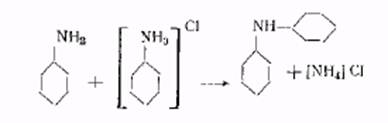
Синтез из дихлорбензолаПолучение р-фенилендиамина из р-дихлорбензола. 1,00 частей дихлорбензола, 750 частей аммиака и 20 частей медного купороса нагревают в автоклаве около 20 час при 170-180° и, под конец, при 200°. Избыточный аммиак отгоняют и р-фенилендиамин изолируют в форме хлоргидрата или сульфата или в виде свободного основания.
При действии водного аммиака на хлорбензол в присутствии медных соединений при высокой температуре и давлении получаются анилин, фенол и дифениламин. При оптимальных условиях (1 моль хлорбензола + 5 молей NH3 в виде 30—34%-ного водного раствора 0,2 моля Сu2О при 70 от и 200—230° и при 80%-ном наполнении автоклава) реакция заканчивается в 2—3 часа. Выход составляет 89—90% анилина. 4,5% фенола и I—2% дифениламина. Выход анилина увеличивается с увеличением концентрации и общего количества аммиака, понижением температуры и увеличением степени наполнения автоклава.
Синтез из хлорбензола и анилинаКарпухин получил дифениламин по уравнению
![]()
Получение дифениламина из анилина и хлорбензола. 9 частей анилина, 18 частей хлорбензола и 14 частей натронной извести нагревают при 280° в течение 5 часов в запаянных стеклянных трубках в автоклаве, наполненном ксилолом (чтобы трубки не испытывали сильного давления, так как упругость паров хлорбензола и ксилола почти одинакова). Выход дифениламина 10,2%.
При увеличении температуры и времени нагревания выход повышается, но одновременно увеличивается потеря анилина от разложения.
При охлаждении массу разбавляют водой и нейтрализуют соляной кислотой до слабокислой реакции (проба на конго), при этом анилин переходит в раствор, а дифениламин выделяется в виде масла. На другой день затвердевший дифениламин отфильтровывают, промывают и сушат. Сырой дифениламин очищают перегонкой е перегретым паром.
Второй способ очистки: дифениламин перегоняют с двукратным количеством нефтяного погопа, кипящего при 250—315°, причем он увлекается парами нефтяных погопов и частично в них растворяется. Затем пропускают хлористый водород и получают хлористоводородную соль дифениламина в виде белых кристаллов, которые отфильтровывают и промывают легким бензином. Анилин, не вошедший в реакцию, может быть регенерирован из раствора его солянокислой соли.
Синтез из хлорбензола и анилинаГораздо большее практическое значение имеет замена гидроксила аминогруппой в ароматическом ряду, чем в алифатическом. Для фенолов с этой целью также прибегают к двойному соединению хлористого цинка и аммиака. Тем не менее опыты превращения фенола в анилин со спиртовым или воднымаммиаком приводят к чрезвычайно незначительным выходам. С двойным соединением хлористого цинка и аммиака получают уже при 300° значительное количество анилина и дифениламина, а при 350° около 70% (веса фенола) обоих оснований. Особенно подходящей является температура 3300. Главная реакция полностью протекает за 20 час.
Присутствие хлористого аммония и большого, избытка двойного соединения хлористого цинка и аммиака весьма влияет на выход.
Чем меньше ZnCl2•2NH3 и NH4Cl употребляется, тем больше образуется дифениламина вместо анилина, особенно если нагревание происходит долго и при более высокой температуре. Так как дифениламин при нагревании с двойным соединением хлористого цинка и аммиака в присутствии хлористого аммония образует анилин, то надо считать механизм образования последнего ясным.
Аналогично действию хлористого аммония и двойного соединения хлористого цинка с аммиаком реагируют соответствующие соединения брома.
Получение анилина из фенола при помощи хлорциикаммиака и хлористого аммония. 10 г фенола, 40г ZnCl2•2NH3 и 4 г NH4C1 нагревают под давлением в трубке в течение 20 часов при 330°. Содержимое трубки растворяют при нагреваний в соляной кислоте до образования двух слоев. Фенол и дифениламин экстрагируют эфиром, из солянокислого раствора анилин осаждают аммиаком и извлекают эфиром. Эфирный раствор фенола и дифениламина обрабатывают щелочью для освобождения от фенола. Таким образом, получают, считая на взятый фенол, около 44% анилина, 38% дифениламина и 6% свободного фенола.
Список литературы
1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
2. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
3. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
4. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.:Химия, 1994.- 848 с.
5. Губен И. Методы органической химии. Том 4, выпуск 1, книга первая, М.-Л., Госхимиздат, 1949, 894с.
6. Фирц-Давид Г.Э. Производство органических красок. М.-Л., Госхимтехиздат, 1933, 633с.
7. Фирц-Давид Г.Э., Бланже Л. Основные процессы синтеза красителей. М., ИЛ, 1957, 584с.
8. Хиккинботтом В. Реакция органических соединений. М., ГОНТИ, 1939, 556с.
9. Иоффе С.Т., Несмеянов А.Н. Методы элементоорганической химии (магний, бериллий, кальций, стронций, барий). М., Изд-во АН СССР, 1963, 788с.
Похожие работы
... 5.Нитрование Ариламинов сопровождается сильным осмолением, вплоть до самовозгорания. Ацилирование аминогруппы снижает реакционную способность кольца и защищает от окисления. 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ Реакция синтеза бензальанилина относится к виду «присоединение-отщепление N-нуклеофилов»[1,6]. Механизм этой реакции можно показать в 5 стадиях: Стадия 1: Медленное присоединение нуклеофила к ...
... N-метилакридиния), и осадок (5-окси-N-метилакридан) окисляют хромовым ангидридом. Акридон сульфируется и нитруется в положения 3 и 3,7, а при бромировании дает 2,3-дибромпроизводное. Мною апробирован метод получения акридона из фенилантраниловой кислоты. Выбранная реакция принадлежит к реакциям замыкания цикла. ОБЗОР ЛИТЕРАТУРЫ Реакции замыкания цикла. Типы реакций. Реакции замыкания ...
... . Получаемый ПВХ отличается высокой полидисперсностыо и широким молекулярно-массовым распределением. Достоинства полимеризации в массе: высокая чистота полимера, его повышенные электроизоляционные свойства, прозрачность изделий. Производство поливинилхлорида в суспензии Большая часть ПВХ производится суспензионным методом, обеспечивающим высокое качество полимера (со сравнительно узким ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...


0 комментариев