Навигация
Создание безотходной технологии в производстве кальцинированной соды
Міністерство освіти та науки України
Національний технічний університет
“Харківський політехнічний інститут”
Кафедра Хімічної технології неорганічних речовин, каталізу та екології
Контрольна робота
З курсу Сировина галузі, основи безвідходного виробництва
На тему “Створення безвідходної технології
у виробництві кальцинованої соди”
Студентки 4 курсу
Групи НЗ–16
Харків
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА Na2CO3
2. РЕСУРСО-СЫРЬЕВАЯ БАЗА
3. ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА Na2CO3
4. ОСНОВНОЙ АППАРАТ
5. ТЕХНИКО–ЭКОНОМИЧЕСКИЕ ПОКАЗАТЕЛИ
СУЩЕСТВУЮЩЕЙ ТЕХНОЛОГИИ
6. ОТХОДЫ В ПРОИЗВОДСТВЕ СОДЫ И МЕТОДЫ ИХ ПЕРЕРАБОТКИ
6.1 ПЕРЕРАБОТКА ЖИДКИХ ОТХОДОВ
6.2 ПЕРЕРАБОТКА ТВЕРДЫХ ОТХОДОВ
7. РАСЧЕТНАЯ ЧАСТЬ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
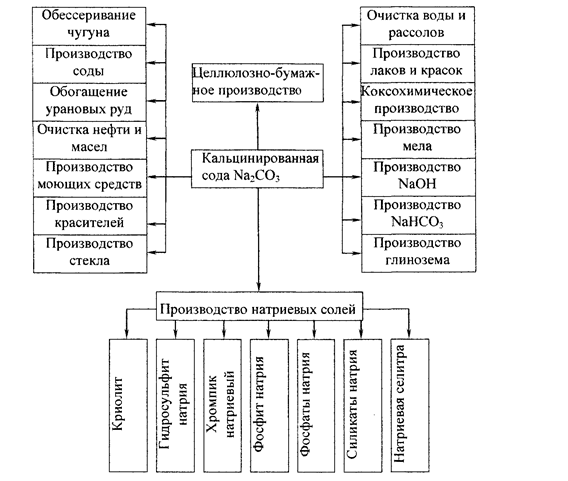 В настоящее время трудно себе представить какую-нибудь отрасль какой-либо страны, где бы не применялась сода или продукты из неё. Крупнейшими потребителями соды являются такие отрасли, как химическая, металлургическая, пищевая и другие. Важнейшие из областей применения соды показаны на рис. 1 [1, 2].
В настоящее время трудно себе представить какую-нибудь отрасль какой-либо страны, где бы не применялась сода или продукты из неё. Крупнейшими потребителями соды являются такие отрасли, как химическая, металлургическая, пищевая и другие. Важнейшие из областей применения соды показаны на рис. 1 [1, 2].
Рис. 1 – Отрасли применения кальцинированной соды.
В химической промышленности сода применяется для получения NaOH химическими методами, NaHCO3, соединений хрома, сульфитов и фторидов, фосфатов, NaNO2 и NaNO3, для очистки рассолов, а также используется для производства различных видов стекол.
Большое количество карбоната натрия используется в цветной металлургии: для производства глинозема, при переработке свинцово-цинковых, кобальт-никелевых, вольфрамомолибденовых руд.
Черная металлургия применяет Na2CO3 для удаления серы и фосфора из чугуна и извлечения ряда химических продуктов из смол в коксохимическом производстве.
В машиностроении содопродукты необходимы для пассивирования и обезвреживания деталей машин и инструмента. Кроме того, применяется сода и в литейном производстве.
Значительное количество соды используется в целлюлозно-бумажной промышленности для производства различных продуктов.
Медицинская промышленность использует соду в производстве различных медикаментов. Следует указать на применение соды в изготовлении электровакуумного стекла в электронной промышленности.
Большое значение имеет использование соды для очистки различных сточных вод, очистки воды питающей паровые котлы.
В легкой промышленности кальцинированная сода используется для беления и крашения тканей, получения искусственного щелка, нитроцеллюлозы.
Большое значение имеет применение соды для производства мыла и моющих средств, без которых современная жизнь кажется невозможной [1–3].
Уровень потребления кальцинированной соды на душу населения в странах СНГ составляет 15–20 кг/человека. Мировая потребность в Na2CO3 по состоянию на 1995 год составила 35 млн т/год. Потребление соды в 2000 году составило около 39–41 млн т [2].
Приведенные данные указывает на то, что сода является востребованным крупнотоннажным продуктом основной химии.
1. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА Na2CO3
Требования к выпускаемой кальцинированной соде (легкой) в соответствии с данными ГОСТ 5100–85 [4] приведены в таблице 1.1:
Таблица 1.1 – Показатели качества кальцинированной соды
| Наименование показателя | Норма для марки и сорта | |||||
| Марка А ОКП 21 3111 0200 | Марка Б ОКП 21 3111 0100 | |||||
| Высший сорт ОКП 21 3111 0220 | Первый сорт ОКП 21 3111 0230 | Второй сорт ОКП 21 3111 0240 | Высший сорт ОКП 21 3111 0120 | Первый сорт ОКП 21 3111 0130 | Второй сорт ОКП 21 3111 0140 | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1. Внешний вид | Гранулы белого цвета | Порошок белого цвета | ||||
| 2. Массовая доля углекислого натрия (Na2CO3), %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| 3. Массовая доля углекислого натрия (Na2CO3) в пересчете на непрокаленный продукт, %, не менее | 98,7 | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 |
| 4. Массовая доля потери при прокаливании (при 270–300) ºС, %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| 5. Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| 6. Массовая доля железа в пересчете на Fe2О3, %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| 7. Массовая доля веществ, нерастворимых в воде, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| 8. Массовая доля сульфатов в пересчете на Na4SO4, %, не более | 0,04 | 0,05 | не нормируется | 0,04 | 0,05 | не нормируется |
| 9. Насыпная плотность, г/см3, не менее | 1,1 | 0,9 | 0,9 | не нормируется | ||
| 10. Магнитные включения размером более 0,25 мм | отсутствуют | не нормируется | не нормируется | |||
Кальцинированную соду упаковывают в четырехслойные бумажные мешки; соду, поставляемую для производства электровакуумного стекла – в пятислойные бумажные или пятислойные ламинированные мешки. Транспортируют соду насыпью в специальных контейнерах грузоотправителя, содо–, саже- и цементовозах, а упакованную в мешки – в крытых железнодорожных вагонах, контейнерах, судах.
Сода гигроскопична, при хранении на воздухе поглощает диоксид углерода и слеживается.
В настоящее время в мире производство кальцинированной соды базируется на четырех основных способах: аммиачном, из природной соды, комплексной переработкой нефелинов, карбонизацией гидроксида натрия [1, 2].
Карбонизация гидроксида натрия как промышленный способ получения кальцинированной соды получила некоторое распространение в конце 60-х–начале 70-х годов. В настоящее время во всем мире действует лишь несколько небольших установок по получению соды с использованием этого способа, и доля его в мировом производстве кальцинированной соды составляет около 1 % [2].
Процесс переработки нефелинов с получением глинозема, кальцинированной соды, поташа и цемента на основе апатит-нефелиновых месторождений, а также нефелиновых руд – третий по значимости из промышленных способов получения соды [1–3, 5–7].
Вторым по значимости способом, по которому получают соду, является получение соды из природного содосодержащего сырья. Особенно этот способ получил распространение за рубежом, в США, после того, как там были открыты залежи троны (Na2CO3–NaHCO3–2H2O). С 1977 года в США для производства соды используют также рапу озера Сиэрлз (Калифорния).
Недавно в США были открыты новые богатейшие залежи природной соды - нахколита (NaHCO3) и даусонита (NaАl(ОН)2СО3). Источники природной соды, но несравненно меньше чем в США имеют и другие страны: Бельгия, Бразилия, Индия, Китай, Турция, Канада, ЮАР. В 1990–1993 годах долю соды, получаемой из природного содосодержащего сырья в мировой практике можно оценить в 32,1 % [2].
Аммиачный способ получения соды продолжает оставаться основным и на сегодняшний день. По состоянию на 1993 год его доля в производстве карбоната натрия составила около 65 %.
Следует упомянуть о разновидности аммиачного способа, который основан на замене аммиака органическими соединениями – алифатическими аминами. Однако этот способ на сегодняшний день не получил достаточного широкого распространения [7] и на Украине не применяется.
Украина имеет лишь незначительные запасы нефелиновых руд, и не обладает природными запасами, содержащими соду. Поэтому на сегодняшний день единственным способом, по которому производят соду на Украине, является аммиачный способ. Рассмотрим аммиачный способ более подробно.
В общем виде для любых химико-технологических систем химизм основных стадий аммиачно-содового процесса можно представить в виде следующих уравнений [1–3, 5–6]:
![]() (1.1)
(1.1)
CaO + H2O = Ca(OH)2(1.2)
![]() (1.3)
(1.3)
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 +2H2O(1.4)
2NaHCO3 = Na2CO3 + H2O + CO2(1.5)
На содовых заводах гидрокарбонат аммония получают из аммиака и углекислого газа, растворяя их в водных растворах NaCl (уравнение 1.3). Это уравнение характеризует только конечный результат взаимодействия хлорида натрия и гидрокарбоната аммония. В действительности процесс карбонизации протекает гораздо сложнее.
Так как диоксид углерода плохо растворяется в воде в отсутствие аммиака, то на первой стадии сначала раствор хлорида натрия насыщают аммиаком, а потом аммонизированный рассол насыщают диоксидом углерода. Процесс насыщения раствора хлорида натрия аммиаком и диоксидом углерода проводят при сравнительно низких температурах, что обеспечивает протекание реакции слева на право.
На первом стадии карбонизации большая часть диоксида углерода связывается в карбомат аммония:
![]() ,
,
который затем гидролизуется
![]()
с образованием пересыщенного по НСО3– раствора. Затем из пересыщенного раствора кристаллизуется гидрокарбонат натрия, образующийся по реакции:
![]()
Кристаллизация гидрокарбоната натрия подчиняется общим закономерностям и зависит, прежде всего, от температуры, пересыщения и скорости перемешивания раствора. Необходимо отметить, приведенная схема только условно отображает процесс.
Процесс насыщения аммонизированного рассола диоксидом углерода является экзотермическим. Поэтому выделяющееся тепло необходимо отвести, чтобы обеспечить требуемые степени карбонизации раствора и утилизации натрия.
Наиболее простое кинетическое уравнение процесса карбонизации имеет вид:
![]()
где ![]() – количество диоксида углерода, поглощенного в единицу времени единицей поверхности раствора, моль/м3;
– количество диоксида углерода, поглощенного в единицу времени единицей поверхности раствора, моль/м3;
![]() – концентрация активного компонента (не связанного в хлорид и углеаммонийные соли аммиака), н.д.;
– концентрация активного компонента (не связанного в хлорид и углеаммонийные соли аммиака), н.д.;
![]() – константа, включающая константу Генри и частичный коэффициент абсорбции для жидкостной пленки;
– константа, включающая константу Генри и частичный коэффициент абсорбции для жидкостной пленки;
![]() – давление диоксида углерода над метастабильным раствором, кПа;
– давление диоксида углерода над метастабильным раствором, кПа;
![]() – парциальное давление CO2 в карбонизующем газе, кПа.
– парциальное давление CO2 в карбонизующем газе, кПа.
Следует отметить, что температурный режим влияет на процесс образования кристаллов NaHCO3. Для получения крупных кристаллов правильной формы, которые не забивают поверхность вакуум-фильтров и малорастворимые в процессе фильтрации, необходимо поддерживать температуру 60–72 °С в зоне образования и в начальных период роста кристаллов. В процессе дальнейшего роста кристаллов температура уже не оказывает существенного влияния на рост кристаллов. При нормальном росте кристаллов образуются кристаллы типа "бочка", при ухудшении процесса кристаллизации образуются длинные кристаллы склонные к образованию сростков в виде снопов – кристаллы "друза". Такие кристаллы забивают вакуум-фильтры и способствуют тому, что в осадке гидрокарбонат натрия содержится больше воды, чем в кристаллах типа "бочка".
На основе горизонтальной проекции изотермической диаграммы растворимости для 15 °С в системе NaCl–NH4Cl–NH4HCO3–NaHCO3, изученной П.П. Федотьевым (см. рис. 1.1), можно определить оптимальные условия для проведения процесса карбонизации [6]. Они находятся вблизи точки Р1 и линии P1–IV.
Выпавший осадок гидрокарбоната натрия отфильтровывают, и далее его подвергают прокаливанию с получением соды (уравнение 1.5). Температура разложения гидрокарбоната натрия составляет 160–180 °С. Эта операция протекает в отделении кальцинации. Выделяющийся диоксид углерода используется в процессе карбонизации.
I–Р2 – растворы, насыщенные NaHCO3 и NaCl; P2–P1 – растворы, насыщенные NaHCO3 и NaCl; P1–IV – растворы, насыщенные NaHCO3 и NH4HCO3;
P1 – раствор, насыщенный NaHCO3, NH4HCO3 и NH4Cl; Р2 – раствор, насыщенный NaCl, NH4C1 и NaHCO3.
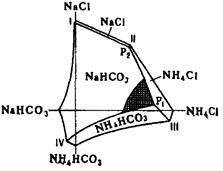
Рис. 1.1 – Диаграмма системы NaCl–NH4Cl–NH4HCO3–NaHCO3
Аммиак обычно регенерируют из хлорида аммония и возвращают в производство. С этой целью раствор, содержащий хлорид аммония подвергают обработке известковым молоком (уравнение 1.4). Образующийся аммиак отгоняют из раствора и направляют на абсорбцию.
Для получения известкового молока необходим оксид кальция, который получают путем обжига карбонатного сырья (мела или известняка) в известково-обжигательных печах при температуре 1100–1200 °С (уравнение 1.1). Образующийся диоксид углерода используют в отделении карбонизации, а СаО используют для получения известкового раствора (уравнение 1.2).
Поступающий сырой рассол (водный раствор хлорида натрия) подвергают предварительной очистке от примесей солей кальция и магния с помощью Na2CO3 и Са(ОН)2. В процессе очистки образуются плохо растворимые Mg(OH); и СаСО3, выпадающие в осадок:
MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2 (1.6)
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl (1.7)
Осадки Mg(OH)2 и СаСО3 удаляют, а очищенный рассол направляют дальше в производство.
2. РЕСУРСО-СЫРЬЕВАЯ БАЗА
Основным сырьем для получения кальцинированной соды на Украине является хлорид натрия, карбонатсодержащее сырьё и аммиак.
В технологии карбоната натрия используют не твердый хлорид натрия, а его водные растворы, содержащие 305–310 г/л соли. Различают естественные и искусственные рассолы.
Искусственные рассолы получают путем подземного выщелачивания соли водой. В настоящее время рассол получают наиболее совершенным способом, так называемым методом гидровруба. На Украине в качестве источников хлорида натрия при подземном выщелачивании используют Артемовско-Славянское месторождение каменной соли.
Естественные рассолы обычно отличаются низким содержанием хлорида натрия, поэтому их приходится донасыщать путем дополнительного растворения твердой поваренной каменной соли. Производство соды на ОАО "Крымский содовый завод" базируется на использовании местного сырья Крыма – рассолов озера Сиваш, площадь которого составляет 2500 км".
Примерный соляной и ионный состав рассолов, применяемых на заводах Украины, приведен в таблице 1.2 [5]:
Таблица 1.2 – Состав рассолов различных месторождений
| Состав | Завод | |||||||
| Лисичанский | Славянский | Крымский | ||||||
| сырой (летний) | засульфаченый (зимний) | |||||||
| 1 | 2 | 3 | 4 | 5 | ||||
| Ионный состав, н.д. | ||||||||
| Са2+ | 1,67 | 0,4 | 0,74 | 0,74 | ||||
| Mg2+ | 0,33 | 0,2 | 4,87 | 5,43 | ||||
| SO42– | 1,62 | 1,5 | 2,67 | 7,20 | ||||
| Cl– | 106,00 | 105,5 | 106,20 | 103,00 | ||||
| Na+ | 105,62 | 106,4 | 103,26 | 104,03 | ||||
| Солевой состав (условный), н.д. | ||||||||
| NaCl | 104,20 | 105,04 | 102,6 | 99,09 | ||||
| CaSO4 | 0,06 | 0,06 | 0,06 | 0,06 | ||||
| CaCl2 | 1,61 | 0,34 | 0,68 | 0,68 | ||||
| MgSO4 | 0,13 | 0,08 | 1,95 | 2,20 | ||||
| MgCl2 | 0,20 | 0,12 | 2,92 | 3,23 | ||||
| Na2SO4 | 1,43 | 1,36 | 0,66 | 4,94 | ||||
Концентрация растворов дана в так называемых нормальных делениях. Одно нормальное деление соответствует содержанию 1/20 эквивалентов вещества в 1 л раствора.
Для получения диоксида углерода и извести на содовых заводах используют СаСО3 двух модификаций: мел или известняк, причем наиболее предпочтительнее известняк.
Состав карбонатного сырья приведен в таблице 1.3 [2, 3]:
Таблица 1.3 – Химический состав карбонатного сырья используемого в содовом производстве
| Компоненты сырья, % масс. | Известняк | Мел |
| СаСО3 | 92–96 | 83–86 |
| MgCO3 | 2,0–2,1 | 0,6–1,0 |
| SiO2 и нерастворимый осадок | 0,5–3,5 | 1,2–2,0 |
| CaSO4 | 0,3–0,5 | 0,1–0,3 |
| Fe2О3+А12О3 | 0,3–0,6 | 0,2–0,4 |
| Влага | до 0,5 | 12–15 |
Карбонатное сырьё к месту производства кальцинированной соды, как правило, транспортируют в крытых вагонах железнодорожным транспортом.
Аммиак в производстве кальцинированной соды совершает замкнутый цикл. При этом потери его в технологии неизбежны, поэтому эти потери компенсируются введением в схему аммиачной воды, поступающей с заводов по производству аммиака, а так же коксохимических заводов. Каменноугольная аммиачная вода является более предпочтительной, так как в ней содержатся компоненты препятствующие коррозии аппаратуры.
Химический состав каменноугольной аммиачной воды приведен в таблице 1.4 [2]:
Таблица 1.4 – Химический состав каменноугольной аммиачной воды
| Компоненты сырья | 1–й сорт | 2–й сорт | 3–й сорт |
| Аммиак, % не менее | 19,9 | 18,3 | 18,0 |
| Диоксид углерода, г/л, не более | 70 | 80 | 100 |
| Сероводород, г/л, не более | 30 | 40 | 50 |
Применяется так же синтетическая аммиачная вода – аммиак водный, содержащий до 25 % масс. NH3 (для 1–го сорта) и 22 % масс. NH3 (для 2–го сорта). Аммиачную воду, как правило, транспортируют так же как и карбонатное сырье, железнодорожным транспортом.
Гидросульфид натрия (NaHS) – применяется для предотвращения коррозии чугунной и стальной аппаратуры в среде, содержащей хлориды натрия, аммония и углеаммонийных солей. Расход NaHS составляет 5–10 кг/т соды [2, 3].
3. ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА Na2CO3
Производство кальцинированной соды по аммиачному способу включает восемь основных отделений [1]:
получение карбонатного сырья, подготовка и его транспортировка; переработка карбонатного сырья с получением диоксида углерода с последующей его подготовкой и извести с получением известковой суспензии;
подготовка и очистка сырого рассола;
абсорбция: отмывка в промывателях газов, выделяющихся на других стадиях, от аммиака, двухстадийное насыщение раствора хлорида натрия аммиаком и частично диоксидом углерода, поступающего со стадии дистилляции, охлаждение аммонизированного рассола;
карбонизация: отмывка от аммиака газа, покидающего стадию карбонизации, предварительная карбонизация с выделением гидрокарбоната натрия в осадительных колоннах, комприрование диоксида углерода, проступающего со стадии переработки карбонатного сырья и кальцинации;
фильтрация: отделение гидрокарбонат натрия на фильтрах;
кальцинация: обезвоживание и разложение гидрокарбоната натрия и очистка диоксида углерода;
регенерация аммиака (дистилляция): разложение содержащихся в фильтровой жидкости карбонатов и гидрокарбонатов аммония в конденсаторе и теплообменнике дистилляции, с получением диоксида углерода, аммиака и хлорида кальция.
Описанные стадии можно показать в виде принципиальной схемы производства кальцинированной соды, которая и изображена на рис. 3.1.
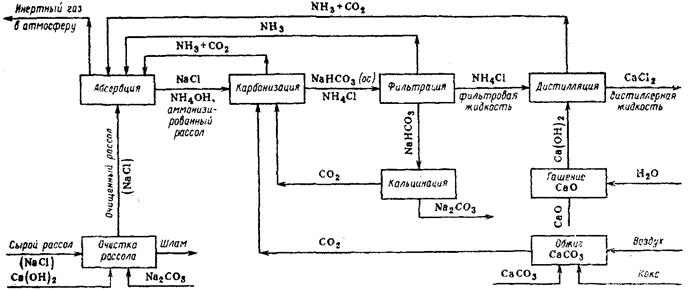
Рис. 3.1. – Принципиальная схема производства кальцинированной соды аммиачным способом
На основании ряда научных работ была разработана принципиальная схема малоотходного совместного производства соды, хлоридов аммония, кальция и кальциевых продуктов (рис. 3.2).
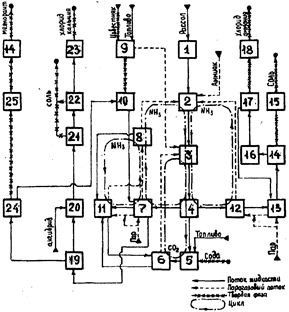
Рис. 3.2 – Принципиальная схема производства Na2CO3, NH4Cl и кальциевых продуктов [2, 3]
Раствор хлорида натрия (рассол) подают в отделение очистки рассола I, куда подают известковую суспензию и кальцинированную соду. В отделении рассолоочистки происходит удаление кальциевых и магниевых примесей в виде нерастворимых соединений (раздел 1 уравнение 1.6–1.7). Очищенный рассол направляется в отделение абсорбции П. Здесь он насыщается аммиаком и частично диоксидом углерода, поступающим из отделений дистилляции, карбонизации и после вакуум-фильтров.
Рассол охлаждается в отделении карбонизации III, а затем насыщается диоксидом углерода, нагнетаемым компрессорами из известковых и содовых печей. В отделении карбонизации образуется гидрокарбоната натрия, выпадающий в осадок, и хлорид аммония, остающийся в растворе.
После карбонизации суспензия направляется в отделение фильтрации IV, где происходит отделение кристаллов гидрокарбоната натрия.
Сырой гидрокарбонат натрия поступает далее на кальцинацию V в содовые печи, где он разлагается с образованием кальцинированной соды, диоксида углерода и паров воды. Кальцинированная сода направляется на склад.
Газ кальцинации после охлаждения и промывки (отделение VI) компримируется и вновь подается на карбонизацию.
Маточная (фильтровая) жидкость после отделения гидрокарбоната натрия направляется на дистилляцию (отделение VII), где из неё отгоняют диоксид углерода, а затем аммиак. Отгонку ведут острым паром, причем для разложения хлорида аммония жидкость смешивают с известковой водой.
Образующийся парогазовый поток после охлаждения (VIII) поступает на абсорбцию (II), замыкая аммиачный цикл производства соды.
Известковую суспензию, подаваемую на дистилляцию, получают гашением извести (X), поступающей из обжигательных печей (IX). Диоксид углерода, образующийся при обжиге карбонатного сырья подают на карбонизацию.
Суспензию после дистилляции (VII) сбрасывают в специальные накопители – "белые моря" (традиционный способ производства соды) – либо используют для получения хлорида кальция (безотходный комплекс).
Существует дополнительный аммиачный цикл, по которому потоки слабых жидкостей и аммиачных конденсатов, образующихся при охлаждении газов кальцинации (VI) и дистилляции (VIII), направляют на малую дистилляция – отделение XI. Здесь аммиак и диоксид углерода десорбируются паром и соединяются с общим парогазовым потоком, направляемым на абсорбцию в отделение II. Жидкость после малой дистилляции вновь используется для промывки и охлаждения газа кальцинации и так же поступает на промывку гидрокарбоната натрия на вакуум-фильтрах IV и гашение извести X.
В таблице 3.1 приведена характеристика энергоносителей и воды применяемых в технологии производства кальцинированной соды [2].
Таблица 3.1 – Характеристика энергетических ресурсов
| Виды энергии | Характеристика | Источник |
| Пар | Р*, МПа, 3,6; 1,5; 1,2; t °C, 400, 300, 280 | Котельная |
| Вода оборотная | Напор 0,4 МПа, t *<26 °С | Система оборотного водоснабжения |
| Электроэнергия | Система электроснабжения | |
| Природный газ | Малосернистый (теплота сгорания* =36 МДж/м3) | Система газоснабжения |
| Мазут (резервное топливо) | Малосернистый (теплота сгорания* =39 МДж/м3) | Привозной |
* Регламентируемые показатели
4. ОСНОВНОЙ АППАРАТ
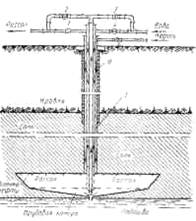
Процесс карбонизации (насыщения аммонизированного рассола диоксидом углерода), в результате которого образуется гидрокарбонат натрия, является основным процессом содового производства. На рис. 4.1 изображена упрощенная схема отделения карбонизации [1–3, 5].
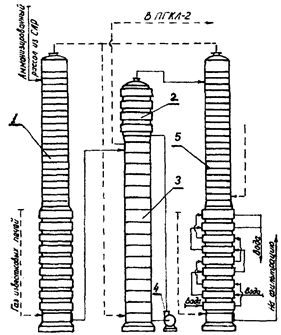
Рис. 4.1 – схема отделения карбонизации: 1 – колонна предварительной карбонизации; 2 – теплообменник; 3 – первый промыватель газа колонн; 4 – насос; 5 – осадительная карбонизационная колонна; САР – сборник аммонизированного рассола; ПГКЛ–2 – второй промыватель газа карбонизационной колонны.
Отделение карбонизации (рис. 4.1) комплектуется сериями колонн, при этом производительность каждой серии равна производительности абсорбционной колонны. В состав серии входят осадительные карбоколонны 5, первый промыватель газа колонн 3 и теплообменник 2. Периодически каждую из осадительных колонн ставят на промывку, тогда она выполняет функцию колонны предварительной карбонизации 1. Карбонизационные колонны работают сериями, чтобы обеспечить непрерывность потока подаваемого в отделение фильтрации. Наибольшее распространение получили серии, состоящие из четырех карбонизационных колон, из которых три работают как осадительные, а одна – как колонна предварительной карбонизации.
Как было указано в разделе 2 в осадительных карбонизационных колоннах протекают два параллельных процесс: абсорбция диоксида углерода и кристаллизация гидрокарбоната натрия, причем на последних стадиях эти процессы требуют отвода тепла реакции. Исходя из этого, карбоколонна имеет две зоны: абсорбционную и холодильную. Схема карбонизационной колоны приведен на рис. 4.2.
Карбонизационная колонна представляет собой цилиндрическую пустотелую ёмкость диаметром до 3 м и высотой до 28 м, состоящую из ряда царг (бочек). Сверху в колонну поступает раствор из первого промывателя газа колонн, а в царгу–базу 1 и абсорбционную царгу 3, расположенную над холодильной зоной, подаётся газ. При работе колонна заполнена раствором до определенного постоянного уровня. Поэтому объем поступающего в колонну раствора соответствует объему отбираемой из колонны суспензии.
Для обеспечения более полного поглощения диоксида углерода газ и жидкость движутся в колонне противотоком. Для улучшения процесса теплообмена и массопередачи между царгами устанавливают пассетные контактные элементы – тарелки 5.
Для осуществления нормального технологического процесса суспензию гидрокарбоната натрия постепенно охлаждают при её движении к выходу из аппарата.
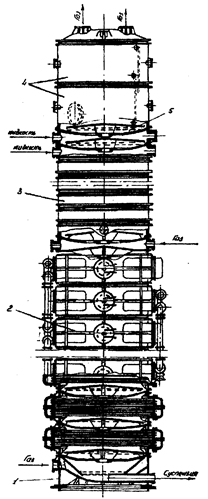
Рисунок 4.2 – Карбонизационная осадительная колонна: 1 – царга-база; 2 – холодильная царга; 3 – абсорбционная царга; 4 – сепарационные царги; 5 – пасетная барботажная тарелка.
Для этого в нижней части колонны устанавливают холодильные царги 2, между которыми расположены пассетные контактные элементы. Пассетные тарелки и царги изготавливают из чугуна марки СЧ 18–36, а холодильные трубки – из нержавеющей стали 12Х18Н10Т.
В последнее время кроме представленной конструкции разработана и другая – колонна с перекрестно-точными контактными элементами и переливом (дырчатые переливные тарелки), которые устанавливаются в абсорбционной части колонны (рис. 4.3).
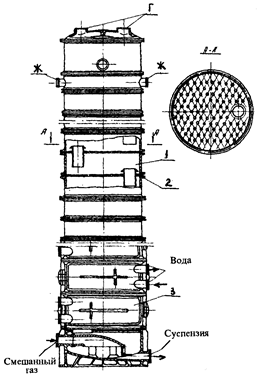
Рис. 4.3 – Карбонизационная колонна с перекрестно-точными тарелками: 1 – абсорбционная царга; 2 – перекрестно-точная тарелка; 3 – холодильная царга.
Такая карбонизационная колонна представляет собой цилиндрическую пустотелую емкость, в которой размещены абсорбционные и холодильные элементы. Абсорбционная (верхняя) зона колонны имеет 17 царг с перекрестно-точными контактными элементами. Холодильная зона имеет 8 холодильных царг, оснащенными трубками в которые вводится вода. Все царги, тарелки и другие узлы и детали карбонизационной колонны выполнены из серого чугуна марки СЧ 18-36. В абсорбционной части колонны устанавливают перекрестно-точные дырчатые контактные элементы с двойным переливом. Холодильная часть карбонизационной колонны может быть выполнена в двух вариантах. В типовом исполнении, между холодильными царгами устанавливаются пассетные противоточные тарелки.
При использовании второго варианта конструкции между холодильными царгами устанавливают переливные контактные элементы [1–3, 5–6].
В таблице 4.1 приведена сравнительная характеристика карбонизационных колонн [1, 2].
Таблица 4.1 – Сравнительная характеристика карбонизационных колонн применяемых в производстве кальцинированной соды
| Параметры | Тарелки | ||
| Пассетные | Перекрестно-точные | ||
| 1-й тип | 2-й тип | ||
| Диаметр, м | 3/2,8 | 2,68 | 3/2,8 |
| Высота, м | 28 | 26,1 | 28 |
| Число холодильных царг | 8 | 10 | 8 |
| Число абсорбционных тарелок | 19 | 12 | 12 |
| Поверхность теплопередачи, м2 | 1344 | 1000 | 1344 |
| Производительность, т соды в сутки | 230 | 220 | 260–280 |
| Степень утилизации натрия, % | 72–74 | 72–74 | 72–74 |
| Влажность NaHCO3, % | 16–18 | 16–18 | 16–18 |
| Относительная стоимость колонны, % | 100 | 75 | 95 |
Из приведенной таблицы видно, что колонны с перекрестно-точными тарелками, не только имеют более низкую стоимость, чем колонны с пассетными тарелками, но и по некоторым параметрам превосходят их.
Похожие работы
... в воде и рассоле. При этом плотность раствора понижается, а объем его увеличивается. Растворимость аммиака увеличивается с понижением температуры и повышением давления. 2.Топливо. В производстве кальцинированной соды топливо применяют в известковых печах при получении извести и в содовых печах при кальцинации бикарбоната натрия. Основным видом топлива обжига известняка или мела следует ...
... материалов синтетической химии лежит технология переработки ТПО производства резины и резинотехнических изделий. Итак, к ТПО резины следует отнести собственно отходы производства резины и отходы резино-технических изделий в процессе производства. Предварительно остановимся на видах резины. В зависимости от содержания серы в резине ее называют мягкой (2-8% S); полутвердой (12-20% S); твердой или ...
... отходам производства. В докладе «О состоянии окружающей природной среды Российской Федерации в 1997 году» Государственного комитета Российской Федерации по охране окружающей среды отмечается, что на начало 1997 г. на предприятиях различных отраслей промышленности накоплено 1431,7 млн. т токсичных отходов. За 1997 г. на промышленных предприятиях РФ образовалось 89,4 млн т токсичных отходов, из ...
... на предприятиях сырья, а также особенностями технологических процессов, высоким диапазоном использования в народном хозяйстве, АПК и в быту его готовой продукции и полуфабрикатов. Химический комплекс Украины играет исключительно важную роль в развитии производительных сил, обеспечении жизненных потребностей населения. На химических и электрохимических процессах основана выплавка чугуна и стали, ...
0 комментариев