Навигация
Получение безводного сульфата кальция
2.1.3 Получение безводного сульфата кальция
Безводный сульфат кальция получают нагреванием при 225±5˚С двух- или полуводного CaSO4. Температура, при которой высушивают сульфат кальция, имеет большое значение для препарата, который пригоден для быстрого поглощения паров воды (если CaSO4 будет использован в качестве осушителя). Никоем случае нельзя допускать нагревание выше указанной температуры.
Перед высушиванием CaSO4 2H2O или CaSO4 0,5H2O измельчают и просеивают через сито (имеющее ячейки 1-2 мм). Отсеянные зёрна (а не мелочь, прошедшую через сито) помещают в хлоркальциевые трубки, чаще U-образной формы, которые нагревают 2-3 часа при 225±5˚С с протягиванием через них воздуха, предварительно высушенного над Р2О5. Скорость протягивания воздуха ≈ 50 мл/мин. Использованный в качестве осушителя CaSO4 можно много раз регенерировать, он нейтрален, химически инертен и при насыщении водой не расплывается. [5]
2.2 Расчёт исходных веществ для синтеза
В работе был использован синтез из п. 2. 1. 1.
CaCl2∙2H2O + H2SO4 = CaSO4 2H2O + 2 HCl
Чтобы получить ≈ 6 г CaSO4 2H2O :
n(CaSO4 2H2O) = ![]() = 0,034 моль;
= 0,034 моль;
n(CaCl2∙2H2O) = 0,034 моль;
m(CaCl2∙2H2O) = 0,034 моль * 147 г/моль = 5 г;
mр-ра(CaCl2∙2H2O) = ![]() = 25 г;
= 25 г;
m(H2O) = V(H2O) = 20 мл;
n(H2SO4 ) = 0.034 моль;
m(H2SO4 ) = 0,034 моль * 98 г/моль = 3,3 г;
mр-ра(H2SO4 ) = ![]() = 16,5 г;
= 16,5 г;
Vр-ра(H2SO4) = 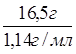 = 14,5 мл;
= 14,5 мл;
Так как кислоту нужно взять в избытке, то для реакции возьмём 20 мл 20% раствора H2SO4 .
Из кислоты, имеющейся в лаборатории (92% раствор с ρ = 1,83 г/мл) надо получить 20 мл 20% раствора H2SO4 (ρ = 1,14 г/мл):
mр-ра(20% H2SO4 ) = 1,14 г/мл * 20 мл = 22,8 г;
mв-ва(20% H2SO4 ) = ![]() = 4,56 г;
= 4,56 г;
mр-ра(92% H2SO4 ) = ![]() = 4,95 г;
= 4,95 г;
Vр-ра(92% H2SO4) = 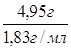 = 2,6 мл;
= 2,6 мл;
V(H2O) = 17,4 мл.
Таким образом, для синтеза возьмём 5 г CaCl2 , растворённого в 20 мл воды и 2,6 мл 92% раствора H2SO4 , растворённого в 17,4 мл воды.
H2SO4 ,
2.3 Оборудование, посуда и реактивы для синтеза
Для получения CaSO4 взяли:
5 г CaCl2 , растворённого в 20 мл воды,
20 мл 20% раствора H2SO4 .
Для проведения качественного анализа на ионы:
AgNO3 , BaCl2 , щавелевая кислота.
Для промывания:
этанол, дистиллированная вода.
Посуда, приборы, материалы:
мерный цилиндр,
пипетка,
химический стакан,
фарфоровая чашка,
воронка,
пробирки,
стеклянная палочка,
колба Бунзена,
воронка Бюхнера,
водоструйный насос,
плитка,
весы,
фильтровальная бумага.
2.4 Техника безопасности
· При работе с концентрированной серной кислотой следует быть осторожными; все работы с ней проводить под тягой;
· При разбавлении концентрированной серной кислоты следует наливать кислоту в воду;
· Так как при разбавлении серной кислоты происходит выделение тепла, не следует держать в руках сосуд, в котором готовится раствор;
· При проливе кислоты на пол надо засыпать её песком, затем мокрый песок удалить, и остатки кислоты смыть водой;
· При попадании кислоты на кожу следует промыть обожжённое место 2-3% раствором соды;
· При попадании реактивов в глаза нужно промыть их водой и обратиться к врачу;
· При работе со стеклянной посудой и приборами следует соблюдать осторожность.
Глава 3. Результаты эксперимента и их обсуждение
3.1 Выполнение эксперимента
Отвесили на электронных весах 5 г CaCl2 , растворили его в 20 мл воды, отфильтровали раствор. Отмерили пипеткой 2,6 мл 92% раствора H2SO4 и влили его в 17,4 мл воды, соблюдая при этом правила техники безопасности. Раствор CaCl2 осадили раствором H2SO4 , взятой в избытке. После отстаивания жидкость слили, а осадок продекантировали дистиллированной водой до слабой реакции на ион хлора, наличие которого проверяли раствором AgNO3. Затем осадок перенесли на воронку Бюхнера и промыли водой до исчезновения реакции на ион хлора (отсутствие белого осадка AgCl). Промыли осадок этанолом, отжали между двумя листами фильтровальной бумаги и высушили при комнатной температуре до постоянной массы. Взвесили полученное вещество:
mтеор = 6 г;
mпракт = 4,2 г;
η = ![]() ∙100% = 70%
∙100% = 70%
Потери продукта могли произойти в процессе промывания осадка, декантации. При переносе осадка из стакана на фильтр небольшая часть сульфата кальция могла остаться на стенках стакана, что повлияло на выход продукта.
3.2 Качественные реакции
Провели качественные реакции на наличие ионов Ca2+ и SO42-
На сульфат-ион:
Качественной реакцией на сульфат-ион является катион бария Ba2+. Хлорид бария с анионом SO42- образует белый осадок BaSO4 , не растворимый в кислотах.
CaSO4 + BaCl2 = CaCl2 + BaSO4 ↓
На катион кальция:
Качественной реакцией на Ca2+ является оксалат-ион. При взаимодействии соли кальция со щавелевой кислотой образуется белый кристаллический осадок CaC2O4 , растворимый в соляной, но не растворимый в уксусной кислоте.[9]
CaSO4 + H2C2O4 = H2SO4 + CaC2O4 ↓
Выводы
Таким образом, согласно поставленным задачам ознакомились с литературой по теме, собрали материал о сульфате кальция, его свойствах, нахождении в природе, применении, способах получения. Выбрали наиболее оптимальный способ и провели синтез CaSO4 в лабораторных условиях, подобрав необходимые реактивы, посуду и материалы. В итоге, выход продукта составил 70%.
Список литературы
1. Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов.- М.: Высшая школа, 1998. с. 525
2. Рабинович В.А., Хавин З.Я. Краткий химический справочник.- М.: Химия, 1977. с. 72
3. Лидин Р.А. и др. Химические свойства неорганических веществ.- М.: Химия, 1997. с. 63
4. Некрасов Б.В. Основы общей химии. Том 1.- М.: Издательство «Лань», 2003. с. 176
5. Воскресенский П.И. Техника лабораторных работ.- Л.: Химик, 1970. с. 577
6. Коржуков Н.Г. Общая и неорганическая химия.- М.: ИНФА-М, 2004, с. 310
7. Ключников Н.Г. Неорганический синтез.- М.: Просвещение, 1983. с. 149
8. Карякин Ю.В., Ангелов И. И. Чистые химические вещества. – М.: Химия, 1974. с. 151
9. Крешков А.П. Основы аналитической химии. Книга 2.- М.: Химия, 1965. с. 194, с. 394
Похожие работы
... , как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы. Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ 2.1 Тема «Кристаллогидраты» в стандарте школьного образования Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен ...
... , или бинарным, галогенидам ЭХn (n - чаще всего целое число от 1 у моногалогенидов до 7 у IF7, и ReF7, но может 6ыть и дробным, например 7/6 у Bi6Cl7) относят, в частности, соли галогеноводородных кислот и межгалогенные соединения (напр., галогенфториды). Существуют также смешанные галогениды, полигалогениды, гидрогалогениды, оксогалогениды, оксигалогениды, гидроксогалогениды, тиогалогениды и ...
сгорает в атмосфере CO и CO2. Естественно, что, обладая такими химическими свойствами, кальций не может находиться в природе в свободном состоянии. Зато соединения кальция - и природные и искусственные - приобрели первостепенное значение. О них (хотя бы самых важных) стоит рассказать подробнее. Кальций - углекислый Карбонат кальция СаCO3 - одно из самых распространенных на Земле соединений. ...
... переломов ослабленных костей / Тр. конгресса Человек и его здоровье. СПб, 1999 - с. 55. 44. Воложин А.И., Курдюмов С.Г., Орловский В.П., Баринов С.М. и др. Создание нового поколения биосовместимых материалов на основе фосфатов кальция для широкого применения в медицинской практике // Технологии живых систем. 2004. Т.1, №.1. С. 41-56. 45. Безруков В.М., Григорян А.С. Гидроксилапатит как ...
0 комментариев