Навигация
Методика изучения кристаллогидратов в школьном курсе химии
Федеральное Агентство по образованию РФ
Институт содержания и методов обучения
Автореферат
методика изучения Кристаллогидратов в школьном курсе химииМосква, 2007
Оглавление
Введение
Глава 1 Кристаллогидраты как объекты науки химии
1.1 История изучения кристаллогидратов
1.2 Терминология и понятия
1.3 Номенклатура кристаллогидратов
1.4 Классификация
1.5 Значение кристаллогидратов
Глава 2 Методика изучения кристаллогидратов в курсе химии средней школы
2.1 Тема «Кристаллогидраты» в стандарте школьного образования
2.2 Анализ содержания действующих программ по исследуемой теме
2.3 Анализ содержания темы «Кристаллогидраты» в школьных программах и учебниках
2.4 Реализация темы «кристаллогидраты» в контрольно-измерительных материалах (едином государственном экзамене
2.5 Возможности модернизации темы «Кристаллогидраты»
2.6 Методические рекомендации к изучению темы
Заключение
Библиография
Введение
К настоящему времени в литературе по теме кристаллогидраты накопилось большое количество фактов, отражающих состав, структуру и применение этого класса соединений. Рассмотренные факты имеют огромное значение и как мы покажем далее они не нашли достаточно полного отражения в содержании школьного химического образования.
Кристаллогидраты – это хранилища метана в недрах вечной мерзлоты и мирового океана в виде соединений включений – клатратов.
Кристаллогидраты имеют широкое применение в народном хозяйстве. Медный купорос применяют как протраву при крашении тканей для консервирования древесины, протравливания семян. В медицине разбавленный раствор медного купороса применяют как антисептическое и вяжущее средство, малые дозы медного купороса назначают иногда при анемии для усиления кроветворения.
Твердение минеральных вяжущих материалов в большинстве случаев обеспечивается гидратационными процессами, включающими в себя как чисто химические так и комплексные физико-химические процессы. В общем виде процессы сводятся к гидратации, росту кристаллов и сцеплению их между собой.
Кристаллогидраты образуются в растительных и животных организмах, которые чаще всего выпадают в виде осадков.
Изучив содержание программ и учебников, мы не были удовлетворены тем, как рассматривается тема кристаллогидраты в школе, поэтому в связи со значимостью данной темы возникает необходимостью модернизировать содержание школьного курса химии, поэтому мы выбрали эту тему в качестве выпускной работы.
Целью нашего исследования является оптимизация содержания темы «кристаллогидраты» в курсе химии средней школы в условиях модернизации общего образования.
Гипотеза исследования: разработанное и модернизированное содержание и методика изучения должна способствовать более глубокой актуализации знаний учащихся по данной теме, мобилизации активной мыслительной деятельности учащихся и развитию познавательного интереса к изучаемому предмету, развитию логических операций в условиях дефицита школьного времени.
Объект исследования: содержание школьного курса химии по теме «кристаллогидраты».
Предмет исследования: модернизация содержания темы «кристаллогидраты» и рациональная оптимизация ее изучения в курсе химии средней школы.
Для проверки гипотезы и достижения поставленной цели, были сформулированы следующие задачи:
1) изучить современные данные о структуре, свойствах и применении кристаллогидратов;
2) проанализировать самые распространенные программы и школьные учебники на предмет содержания в них исследуемой темы;
3) модернизировать содержание темы и оптимизировать структуру введения данного содержания в школьный курс;
Глава 1. КРИСТАЛЛОГИДРАТЫ КАК ОБЪЕКТЫ НАУКИ ХИМИИ
1.1 История изучения кристаллогидратов
1828 г. Ф. Рюдбергер доказал существование гидратов спирта.
1865 г. Предположение о существовании в водных растворах гидратов высказано и обосновано Д. И. Менделеевым. Он изучал взаимодействие спирта с водой и сделал вывод об образовании определенных соединений. Он считал, что растворение — не только физический, но и химический процесс, что вещества, растворяющиеся в воде, образуют с ней соединения
1880 г. Л. Пруст ввел понятие «гидраты» как особые соединения растворенного вещества с водой.
В 1889г. систематическое изучение кристаллогидратов началось с классических работ Б. Розебома над кристаллогидратами CaCl2 и Fe2Cl6 [8].
1.2 Терминология кристаллогидратов
При растворении веществ молекулы (или ионы) связываются с молекулами растворителя, образуя соединения, называемые солъватами (от латинского solvere – растворять); этот процесс называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а процесс их образования — гидратацией. В зависимости от природы растворенного вещества, сольваты могут образовываться различными путями. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения. Кроме того, может иметь место донорно-акцепторное взаимодействие. Ион растворенного вещества обычно выступают в качестве акцепторов, а молекулы растворителя — в качестве доноров электронных пар. Происходит гидратация и переход в раствор ионов. Гидратируются как катионы, так и анионы. Как правило, гидратированные катионы прочнее чем анионы, а гидратированные простые катионы — прочнее, чем сложные. Это связано с тем, что у простых катионов есть свободные валентные орбитали, которые могут частично акцептировать неподеленные электронные пары атомов кислорода, входящих в молекулы воды. При растворении веществ с молекулярной структурой сольваты образуются вследствие диполь-дипольного взаимодействия.
При попытке выделить исходное вещество из раствора удаляя воду, получить его часто не удается. Например, если мы растворим в воде бесцветный сульфат меди CuSO4, то получим раствор голубого цвета, который придают ему гидратированные ионы меди. После упаривания раствора (удаления воды) и охлаждения из него выделятся кристаллы синего цвета. Исходный сульфат меди можно получить из этого соединения, нагрев его до 250 °С[14]. При этом происходит реакция:
CuSO4· 5H2O = CuSO4 + 5H2O
Разные информационные источники дают нам следующую терминологию.
Гидраты – продукты присоединения воды (гидратации) к молекулам, атомам, ионам. Они могут быть твердые, жидкие и реже газообразные.
Твердые гидраты, имеют свое название – кристаллогидраты.
Кристаллогидраты – твердые вещества, продукты присоединения воды (гидратация) к атомам, молекулам или ионам.
Кристаллогидраты – кристаллы, включающие молекулы воды.
Кристаллогидраты — вещества, включающие в себя обособленные частицы H2O, в которых атомы кислорода связаны с двумя атомами водорода ковалентными связями, а частицы Н2О в целом связаны с другими атомами либо химическими, либо межмолекулярными связями.
Кристаллогидраты – это кристаллические вещества, содержащие в своем составе отдельные молекулы воды или их агломераты.
Кристаллизационная вода – вода, входящая в состав кристаллогидратов.
Кристаллогидраты — являются представителями обширных классов соединений, куда кроме них должны быть еще отнесены: кристаллоамиакаты, кристаллоалкоголяты, кристаллоэфираты и т. д. До сих пор кристаллогидраты не выделялись в особый класс соединений, а упоминались попутно при описании некоторых солей, потому что реакции их исследовались в водных растворах, когда принято игнорировать участвующую в превращении воду [2], [14], [38], [39].
Похожие работы
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
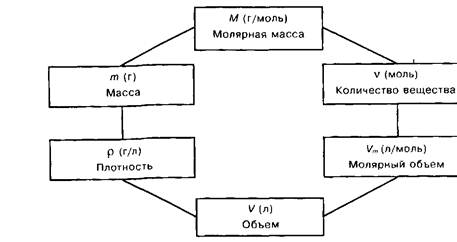
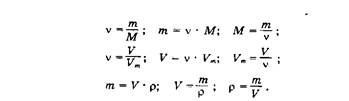






0 комментариев