Навигация
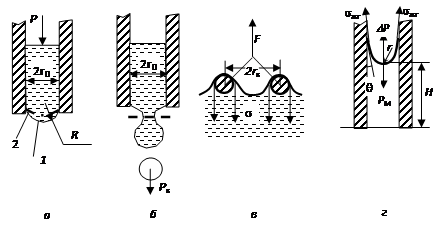
Метод максимального давления в пузырьке газа (метод Ребиндера) (рис. 2.1.2.1, а)
1. Метод максимального давления в пузырьке газа (метод Ребиндера) (рис. 2.1.2.1, а).
Основан на продавливании пузырька газа (воздуха) под воздействием внешнего давления р через калиброванный капилляр радиусом r0. С увеличением давления пузырек растет, а радиус кривизны его поверхности R превышает радиус капилляра (положение 1 рис. 2.1.2.1, а: R > r0). Дальнейшее увеличение объема пузырька будет происходить до тех пор, пока внутреннее давление достигнет своего максимального значения; радиус кривизны при этом будет минимальным, т.е. R = r0 (положение 2). В этот момент пузырек теряет устойчивость: при увеличении его объема он отрывается от капилляра. Если в момент отрыва пузырька измерить давление р, то поверхностное натяжение можно представить
![]() ;
; ![]() .
(1)
.
(1)
Чтобы не измерять радиус капилляра, можно определить р для жидкости, поверхностное натяжение которой известно (эталон, часто, вода). Отсюда
![]() .
(2)
.
(2)
Исключив в уравнениях (1) и (2) радиус капилляра, получим выражение для определения поверхностного натяжения
![]() или
или ![]()
где ![]() - поверхностное натяжение на границе «жидкость – газ»;
- поверхностное натяжение на границе «жидкость – газ»;
![]() - поверхностное натяжение жидкости, принятой за стандарт (чаще – вода);
- поверхностное натяжение жидкости, принятой за стандарт (чаще – вода);
![]() - перепад давления в пузырьке стандартной жидкости;
- перепад давления в пузырьке стандартной жидкости;
![]() - перепад давления в пузырьке исследуемой жидкости.
- перепад давления в пузырьке исследуемой жидкости.
2. Сталагмометрический метод (рис. 2.1.2.1, б).
Определяют вес капли, которая отрывается от капилляра под действием силы тяжести. Считают, что при отрыве вес капли Рк уравновешивается силой, равной произведению поверхностного натяжения и длины окружности капилляра радиусом r0:
![]() , (3)
, (3)
где k – поправочный коэффициент, учитывающий, что отрыв капель происходит по радиусу шейки капли, который меньше радиуса самой капли.
Определяют экспериментально вес капель и при помощи разработанных таблиц с учетом (3) находят s. Рекомендуется увеличивать время формирования капли до тех пор, пока число капель станет постоянным.
![]() ,
,
где r - плотность исследуемой жидкости;
n – число капель исследуемой жидкости;
sст, rст, nст – значения s, r и n для стандартной жидкости.
3. Метод отрыва кольца (рис. 2.1.2.1, в).
Измеряют силу F, которой противодействует поверхностное натяжение жидкости, смачивающей периметр поверхности кольца.
![]() ,
,
где k – поправочный коэффициент, учитывает, что поднимающийся при отрыве кольца столб жидкости не имеет формы правильного полого цилиндра.
Метод капиллярного поднятия (рис. 2.1.2.1, г).
В капилляре за счет смачивания образуется вогнутый мениск с радиусом кривизны r, поверхностное натяжение sжг вызывает капиллярное давление Dр. Оно уравновешивается весом Рн столба жидкости высотой Н:
![]() , (4)
, (4)
где q - краевой угол смачивания.
Капиллярное давление уравновешивается весом столба РН жидкости высотой Н, т.е. Dр = РН. С учетом (4) и веса столба жидкости можно записать:
![]() , (5)
, (5)
где r, r0 – плотность жидкости и газа (воздуха).
В связи с тем, что r >> r0, плотностью газа можно пренебречь, тогда высота подъема жидкости в капилляре определяется по формуле
![]() .
.
|
При полном смачивании, когда q = 0 и cosq = 1, имеем
![]() .
.
![]() - уравнение Жюрена,
- уравнение Жюрена,
где Dr – разность плотностей жидкости и газовой фазы;
g – ускорение свободного падения;
а – капиллярная постоянная.
Поверхностное натяжение индивидуальных веществ (жидкостей) монотонно убывает с возрастанием температуры.
![]() т=
т= ![]() 0 - a
0 - a![]() T,
T,
где ![]() т- поверхностное натяжение при данной температуре;
т- поверхностное натяжение при данной температуре;
![]() 0 - поверхностное натяжение при стандартной температуре;
0 - поверхностное натяжение при стандартной температуре;
DТ - разность температур;
а - температурный коэффициент; ![]() .
.
![]() Если вещество поверхностно активно, то с увеличением концентрации изотерма резко уменьшается (кривая 1 рис. 2.1.2.2).
Если вещество поверхностно активно, то с увеличением концентрации изотерма резко уменьшается (кривая 1 рис. 2.1.2.2).
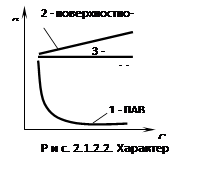
Это объясняется тем, что вначале вся поверхность раздела жидкой фазы свободна от поверхностно-активных веществ (ПАВ) и небольшое его количество, присутствующее в растворе, почти целиком уходит на поверхность. Затем следует криволинейный участок, отвечающий средней концентрации. В этих условиях значительная часть поверхности занята молекулами поверхностно-активных веществ (ПАВ), что снижает скорость повышения концентрации на границе раздела. Большим концентрациям на изотерме отвечает почти горизонтальный участок (кривая 3), показывающий, что поверхностное натяжение мало зависит от концентрации. При этих условиях на границе «жидкость – воздух» образуется сплошной монослой поверхностно-активного вещества (ПАВ), и увеличение его концентрации на границе невозможно в дальнейшем. При увеличении концентрации поверхностного инактивного вещества в растворе изотерма полого поднимается (кривая 2). Это объясняется тем, что поверхностные инактивные вещества благодаря высокому поверхностному натяжению и активности уходят в объем, а на границе раздела «жидкость – воздух» имеются лишь сравнительно небольшие концентрации вещества, попадающего туда за счет диффузии из объема раствора. При увеличении концентрации веществ, не влияющих на поверхностное натяжение, изотерма представляет собой прямую, параллельную оси концентрации. Следует отметить, что отнесение веществ к той или иной группе зависит от природы растворителя. Одно и тоже вещество для разных растворителей может быть и поверхностно-активным веществом (ПАВ), и не влиять на поверхностное натяжение.
Для малых и средних концентраций поверхностно-активных веществ (ПАВ) при описании зависимости ![]() = f(c) используется уравнение Шишковского:
= f(c) используется уравнение Шишковского:
![]() ,
,
где s0 – поверхностное натяжение растворителя (Н/м);
c – концентрация поверхностно-активного вещества (ПАВ);
А, b – константы, данные в справочнике.
Уравнение Гиббса-Гельмгольца для поверхностной энергии. Полная поверхностная энергия
Запишем известное из термодинамики выражение внутренней энергии для поверхности.
![]() Us=
Us= ![]() Gs+ T
Gs+ T![]() SS- уравнение полной поверхностной энергии.
SS- уравнение полной поверхностной энергии.
В этом уравнении qs= TDS - теплота образования единицы поверхности в обратимом процессе. Она равна количеству теплоты, которую необходимо подвести к системе, чтобы увеличить ее поверхность на единицу при T=const. Из уравнений фазы при постоянстве всех параметров, кроме температуры, имеем:
dGs= - SsdT,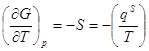 .
.
Подставляя эти значения в уравнение полной поверхностной энергии, получаем:
![]() - уравнение Гиббса - Гельмгольца для поверхности.
- уравнение Гиббса - Гельмгольца для поверхности.
Оно связывает полную поверхностную энергию с энергией Гиббса (поверхностное натяжение).
Для гетерогенной системы изменение внутренней энергии, исходя из I и II начал термодинамики:
dU =TdS – pdV +![]() dS +
dS +![]() idni +jdq,
idni +jdq,
где dU - изменение внутренней энергии;
dS - изменение энтропии;
dV - изменение объема;
Т – температура;
Р – давление;
![]() - поверхностное натяжение;
- поверхностное натяжение;
n - число молей компонента;
dq - изменение электрического заряда;
![]() - химический потенциал компонентов;
- химический потенциал компонентов;
![]() - электрический потенциал компонентов;
- электрический потенциал компонентов;
S - межфазная поверхность.
При S, V, n, q=const уравнение примет вид: dU =![]() dS
dS ![]()
![]() ,
,
т.е. ![]() - это изменение энтропии на единицу площади.
- это изменение энтропии на единицу площади.
Из уравнений видно ![]() , т.е. подтверждается, что при увеличении температуры поверхностное натяжение снижается. Если сопоставить изменение
, т.е. подтверждается, что при увеличении температуры поверхностное натяжение снижается. Если сопоставить изменение ![]() , qs,
, qs, ![]() Us от температуры, получим рис. 2.1.2.3. Из графика видно, что величина DUs для индивидуального вещества величина практически постоянная т.е. DUs не зависит от температуры. Для расчета зависимости
Us от температуры, получим рис. 2.1.2.3. Из графика видно, что величина DUs для индивидуального вещества величина практически постоянная т.е. DUs не зависит от температуры. Для расчета зависимости ![]() = f(T) используются эмпирические и полуэмпирические зависимости - метод парохор, формула Этвеша.
= f(T) используются эмпирические и полуэмпирические зависимости - метод парохор, формула Этвеша.
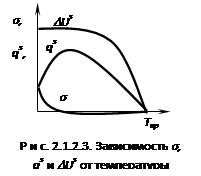
В случае твердых фаз процесс образования новой поверхности носит необратимый характер и ![]() (поверхностное натяжение) можно изменить только косвенным путем, например, путем расчета. Мерой количественного выражения свободной энергии является f или G. В соответствии со вторым законом термодинамики для самопроизвольных процессов,
(поверхностное натяжение) можно изменить только косвенным путем, например, путем расчета. Мерой количественного выражения свободной энергии является f или G. В соответствии со вторым законом термодинамики для самопроизвольных процессов,
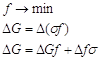
Возможны два варианта:
1.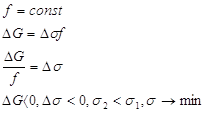 2.
2.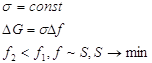
Отсюда следует, что в дисперсных системах в самопроизвольных процессах поверхность (а, следовательно, и поверхностное натяжение) уменьшается.
Похожие работы
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... инерциальных системах отсчета. Пространственно-временной континуум – неразрывная связь пространства и времени и их зависимость от системы отсчета. Тема 11. Основные концепции химии 1. Химия как наука, ее предмет и проблемы Важнейшим разделом современного естествознания является химия. Она играет большую роль в решении наиболее актуальных и перспективных проблем современного общества. К ...
... серьезных доказательств самозарождения жизни (даже в виде самой маленькой живой клеточки, способной создать себе подобные), а то, что они предъявляют – не более чем теории (гипотезы). Что ж, их труды идут на пользу теории научного креационизма! А теперь предоставлю информацию по иным противоречиям в биологии (и в других науках), с которыми сталкивается теория эволюции. ХОТЯ ЭТА ИНФОРМАЦИЯ НЕ ...





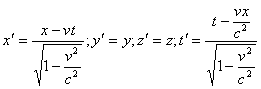
0 комментариев