Навигация
Билет №1
3.Частные реакции на катионы алюминия Al3+.
Al3+ - амфотерный ион можно определить группой реагентов КОН и NaOH в избытке.
![]()
![]() AlCl3 + 3NaOH = 3NaCl + Al(OH)3
AlCl3 + 3NaOH = 3NaCl + Al(OH)3
![]() Al3+ + 3Cl- + 3Na+ + 3OH- = 3Na+ +3Cl- + Al(OH)3
Al3+ + 3Cl- + 3Na+ + 3OH- = 3Na+ +3Cl- + Al(OH)3
![]() Al3+ + 3OH- = Al(OH)3
Al3+ + 3OH- = Al(OH)3
Al(OH)3 – осадок белого цвета, при избытке ОН- растворяется.
Билет №2
3.Задача.
Дано: Решение:
![]() m(H2O) = 9г 9г х1 х2
m(H2O) = 9г 9г х1 х2
![]() 2Н2О = 2Н2 + О2
2Н2О = 2Н2 + О2
V(Н2) - ?
V(O2) - ? Mr (Н2О) = 18 V(Н2) = 44.8л V(O2) = 22.4л
m (Н2О) = 36
![]() 1) 36г 44.8л (Н2)
1) 36г 44.8л (Н2)
![]() 9г х1 х1 = 11.2л (Н2)
9г х1 х1 = 11.2л (Н2)
![]() 2) 36г 22.4л (О2)
2) 36г 22.4л (О2)
![]() 9г х2 х2 = 5.6л (О2)
9г х2 х2 = 5.6л (О2)
Ответ: V(Н2) = 11.2л, V(O2) = 5.6л.
Билет №3
3.Частные реакции на катионы меди Сu2+ .
Cu2+ - определяемый ион.
1) реактив ОН- дает синий осадок.
![]()
![]() CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
![]() Cu2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Cu(OH)2
Cu2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Cu(OH)2
![]() Cu2+ + 2OH- = Cu(OH)2
Cu2+ + 2OH- = Cu(OH)2
2) реактив S2- дает черный осадок.
![]() K2S + CuSO4 = K2SO4 + CuS
K2S + CuSO4 = K2SO4 + CuS
![]() 2K+ + S2- + Cu2+ + SO42- = 2K+ + SO42- + CuS
2K+ + S2- + Cu2+ + SO42- = 2K+ + SO42- + CuS
![]() Cu2+ + S2- = CuS
Cu2+ + S2- = CuS
Билет №4
3.Задача.
![]() Дано: Решение:
Дано: Решение:
m(Zn) = 6.5г
Q2 = 34.8кДж 6.5г 34.8кДж
![]() 2Zn + O2 = 2ZnO + Q1
2Zn + O2 = 2ZnO + Q1
Q1- ? М=65г/моль
Составить термо- m=130г
![]()
![]() химическое урав- 130г х
химическое урав- 130г х
![]() нение реакции.
6.5г 34.8кДж х=696кДж
нение реакции.
6.5г 34.8кДж х=696кДж
Ответ: 2Zn + O 2 = 2ZnO + 696 кДж
Билет №5
3.Частные реакции на анионы хлора Сl- .
Cl- – определяемый ион, реактив – Ag+ дает белый творожистый осадок.
![]()
![]() HCl + AgNO3 = HNO3 + AgCl
HCl + AgNO3 = HNO3 + AgCl
H+ + Cl- + Ag+ + NO3 - = H+ + NO3- + AgCl
![]() Ag+ + Cl- = AgCl
Ag+ + Cl- = AgCl
Билет №6
![]() 3.Задача.
3.Задача.
Дано: Решение:
v(MgO) = 2моль
![]() 2моль х
2моль х
m(MgSO4) - ? MgO + H2SO4 = MgSO4 + H2O
M=40г/моль М=120г/моль
1) v=m/M 2=m/40 m=80г
![]() 2) 40г(MgO) 120г (MgSO4)
2) 40г(MgO) 120г (MgSO4)
х=240г
![]() 80г(MgO) х
80г(MgO) х
Ответ: m(MgSO4) = 240г
Билет №7
3.Получить кислород О2. Доказать опытным путем, что полученный газ – О2.
В пробирку из тугоплавкого стекла (см. рис.) помещают несколько граммов твердого KMnO 4 , закрывают пробкой с газоотводной трубкой, конец которой помещают либо в пустой стакан (метод собирания кислорода вытеснением воздуха), либо в перевернутую пробирку, заполненную водой (метод собирания кислорода вытеснением воды). Нагревают пробирку на пламени спиртовки и собирают образующийся газообразный кислород.
В стакан, заполненный кислородом, опускают тлеющую лучинку. Она тут же ярко вспыхивает, что подтверждает наличие кислорода в стакане. Кислород способствует горению.
Билет №8
3.Реакции, характерные для серной кислоты.
а) Действие индикатора.
В пробирку поместить несколько капель раствора серной кислоты и добавить 2-3 капли раствора индикатора-метилоранжа. Раствор приобретает розовую окраску, характерную для растворов кислот.
б) Взаимодействие с основаниями (реакция нейтрализации).
В пробирку из опыта а) добавлять по каплям раствор щелочи КОН до перехода окраски с розовой на желтую (момент полной нейтрализации):
H2SO4 + 2KOH = K2SO4 + 2H2O
2H+ + SO42- + 2K+ + 2OH- = 2K+ + SO42- + 2H2O
2H+ + 2OH- = 2H2O
в) Взаимодействие с основными и амфотерными оксидами.
В пробирку поместить небольшое количество твердого оксида цинка ZnO и добавлять по каплям раствор серной кислоты до полного растворения оксида:
H2SO4 + ZnO = ZnSO4 + H2O
2H+ + ZnO = Zn2+ + H2O
г) Взаимодействие с металлами, стоящими в ряду активности до водорода.
В пробирку поместить гранулу алюминия и добавить 2-3 мл раствора серной кислоты. Наблюдается выделение газа:
3H2SO4 + 2Al = Al2(SO4)3 + 3H2
6H+ + 2Al = 2Al3+ + 3H2
д) Взаимодействие с солями кислот более слабых, чем серная (например угольная).
В пробирку поместить 1 мл раствора карбоната натрия Na2CO3 и добавлять по каплям раствор серной кислоты. Наблюдается энергичное выделение газа:
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2
2H+ + CO32- = H2O + CO2
Билет №9
![]() 3.Задача. Решение:
3.Задача. Решение:
Дано:
m(HCl)=72г 72г 20% х
w(HCl)=20% Zn + 2HCl = ZnCl2 + H2
![]() Mr=36.5 V=22.4л
Mr=36.5 V=22.4л
m=73г
V(H2) - ?
1) 20% = m(в-ва) / 72г * 100%
m (в-ва) = 20 % * 72г / 100%
m (в-ва) = 14.4г
![]()
![]() 2) 73г 22.4 л
2) 73г 22.4 л
![]() 14.4г х х = 4.4 л
14.4г х х = 4.4 л
Ответ: V(H2) = 4/4 л
Билет №10
3.Реакции, характерные для соляной кислоты.
а) Действие индикатора.
В пробирку поместить 5-6 капель раствора соляной кислоты и добавить 2-3 капли раствора индикатора-метилоранжа. Раствор приобретает розовую окраску, характерную для растворов кислот.
б) Взаимодействие с основаниями (реакция нейтрализации).
В пробирку из опыта а) добавлять по каплям раствор щелочи NaОН до перехода окраски с розовой на желтую (момент полной нейтрализации):
HCl + NaOH = NaCl + H2O
H+ + OH- = H2O
в) Взаимодействие с металлами, стоящими в ряду активности до водорода.
В пробирку поместить гранулу цинка и добавить 1-2мл раствора соляной кислоты. Наблюдается выделение газа:
Zn + 2HCl = ZnCl2 + H2
Zn + 2H+ = Zn2+ + H2
г) Взаимодействие с основными и амфотерными оксидами.
В пробирку поместить небольшое количество твердого оксида магния MgO и добавлять по каплям раствор кислоты до полного растворения оксида:
MgO + 2HCl = MgCl2 + H2O
MgO + 2H+ = Mg2+ + H2O
д) Взаимодействие с солями кислот более слабых, чем соляная (например угольная).
В пробирку поместить 1 мл раствора карбоната натрия Na2CO3 и добавлять по каплям раствор соляной кислоты. Наблюдается энергичное выделение газа:
2HCl + Na2CO3 = 2NaCl + H2O + CO2
2H+ + CO32- = H2O + CO2
Билет №11
3.Получить и собрать СО2.Доказать, что полученный газ - СО2.
В пробирку помещают небольшой кусочек мела СаСО3 и добавляют сверху раствор кислоты НСl. Наблюдается бурное выделение углекислого газа:
СаСО3 + 2HCl = CaCl2 + H2O + CO2
Образующийся газ пропускают с помощью трубки через раствор известковой воды Са(ОН)2 и наблюдается помутнение раствора из-за образования нерастворимого СаСО3:
![]() СО2 + Са(ОН)2 = Н2О + СаСО3
СО2 + Са(ОН)2 = Н2О + СаСО3
Углекислый газ не поддерживает горения. В стакан с углекислым газом опускаем горящую лучинку, она тут же гаснет.
Билет №12
![]() 3.Задача. Решение:
3.Задача. Решение:
Дано:
m(H2O)=100мл w = m(в-ва)/ m(р-ра) * 100%
w(HNO3)=50%
m(НNO3)=100г m(HNO3) = m(р-ра) * w/ 100% = 50%
![]()
w(р-ра) - ? m(р-ра)= m(H2O) + m(в-ва) = 100мл + 50г = 150г
w(р-ра) = 50/150 *100% = 33.3%
Ответ: w(р-ра) = 33.3%
Билет №13
3.Проделать реакции, характерные для глюкозы.
Глюкоза проявляет свойства многоатомных спиртов и альдегидов.
1.Доказать наличие в глюкозе функциональных групп ОН- можно, проделав реакцию с гидроксидом меди (в избытке щелочи):
![]() СuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
СuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
К полученному осадку добавьте равный объем раствора глюкозы, смесь взболтайте – раствор становится синим.
2.Если нагреть смесь раствора глюкозы и гидроксида меди (II), то будет наблюдаться выпадение желтого (гидроксид меди (I)), затем красного осадка (оксид меди (I)):
НОСН2(СНОН)4 – СОН + Сu(ОН)2 = НОСН2(СНОН)4 – СООН + СuОН
2СuОН = Сu2О + Н2О
Билет №14
3.Определить, в какой из пробирок находится NaOH, Na2SO4.
В пробирки с растворами добавить 2-3 капли раствора хлорида бария. Та пробирка, в которой образуется белый осадок, содержит соль серной кислоты:
![]() BaCl2 + Na2SO4 = 2NaCl + BaSO4
BaCl2 + Na2SO4 = 2NaCl + BaSO4
Билет №15
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано: 14г 0.5моль х
m(CаО) = 10л CаО + H2SO4 = CaSO4 + Н2О
v(H2SO4) = 0.5моль М(CаО) =56г/моль
![]() М(H2SO4)=98г/моль
М(H2SO4)=98г/моль
m(CaSO4) - ? М(CaSO4)=136г/моль
1) v(CаО)= m/M v(CaO)= 14/56=0.25 моль,
значит масса H2SO4 дана в избытке.
2) Расчет ведем по веществу, которое дано в недостатке:
![]() 14г (CаО) Х
14г (CаО) Х
![]() 56г (CаО) 136 г Х = 14 * 136 / 56г
56г (CаО) 136 г Х = 14 * 136 / 56г
Х = 34г
Ответ: m(CaSO4) = 34г
Билет №16
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано: 10л х
V (C2H2) = 10л С2Н2 + 3О2 = 2СО2 + 2Н2О
![]() V=22.4л V=67.2л
V=22.4л V=67.2л
![]()
![]() V (O2) - ? 22.4л(C2H2) 67.2л(O2)
V (O2) - ? 22.4л(C2H2) 67.2л(O2)
![]() 10л (C2H2) х х = 30л
10л (C2H2) х х = 30л
Ответ: V (O2) = 30л
Билет №17
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано: 165г 120г
![]() m(C6H5-NO2) = 165г C6H5-NO2 + 3Н2 C6H5-NH2 + 2Н2О
m(C6H5-NO2) = 165г C6H5-NO2 + 3Н2 C6H5-NH2 + 2Н2О
m(C6H5-NH2) = 120г М=125г/моль М=93г/моль
![]() Wпрактический 1) 125г 93г
Wпрактический 1) 125г 93г
![]() выход (C6H5-NH2) - ?
165г х х = 122.76г(теоретический выход анилина)
выход (C6H5-NH2) - ?
165г х х = 122.76г(теоретический выход анилина)
![]()
![]() 2) 122.76г 100%
2) 122.76г 100%
Похожие работы
... в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии. 2. Применение теплового эффекта на практике Тепловые эффекты химических реакций нужны для многих технических расчетов. Например, рассмотрим мощную российскую ракету "Энергия", способную выводить на орбиту космические корабли и другие полезные ...
... коэффициенты в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии. 2. Применение теплового эффекта на практике Тепловые эффекты химических реакций нужны для многих технических расчетов. Например, рассмотрим мощную российскую ракету "Энергия", способную выводить на орбиту космические корабли и ...
... условия сдвига равновесия вправо .... Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» Прикладные аспекты преподавания темы «Закономерности течения химических реакций» на мой взгляд удобнее всего рассматривать на уроках, которые следуют сразу за рассмотрением скорости реакции и химического равновесия, - это производство серной кислоты. 2.1 ...
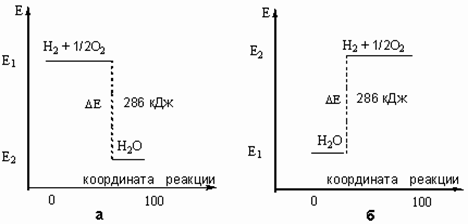
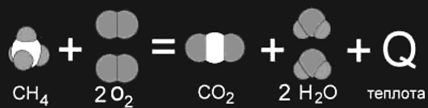
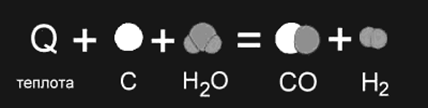
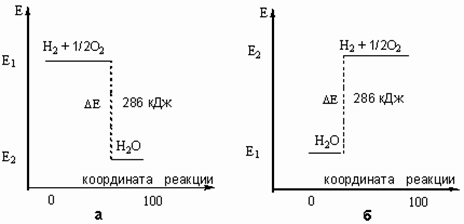
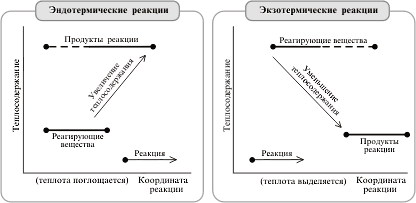
... , с другой. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, — эндотермическими. Термохимия Энергетические изменения, сопровождающие протекание химических реакций, имеют большое практическое значение. Иногда они даже важнее, чем происходящее при данной реакции образование новых веществ. В качестве примера достаточно вспомнить ...

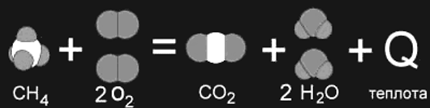




0 комментариев