Навигация
Для того чтобы прореагировать, молекулы реагентов должны столкнуться
1 Для того чтобы прореагировать, молекулы реагентов должны столкнуться.
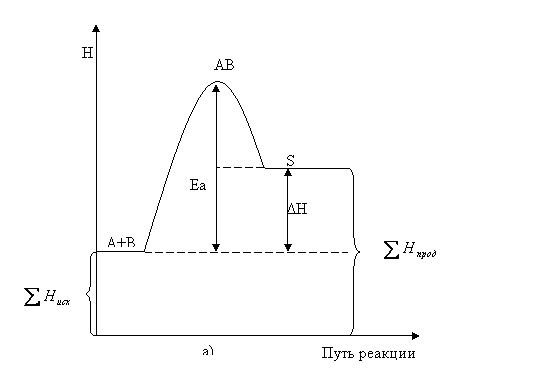
2 Чтобы столкновения частиц действительно привели к химическому превращению, избыточная энергия сталкивающихся молекул должна превышать энергию активации (Еа), т.е. молекулы реагентов должны преодолеть некий потенциальный барьер.
Энергией активации химической реакции называют избыточную энергию, которой должны обладать молекулы в момент столкновения, чтобы прореагировать.
Молекулы, имеющие избыточную энергию, больше, чем энергия активации, называются активными молекулами. В зависимости от доли активных молекул, скорость реакции может быть больше или меньше. Зависимость константы скорости реакции от температуры и энергии активации описывает уравнение Аррениуса:
![]() .
.
Здесь k0 – предэкспоненциальный множитель – постоянная величина.
Одной из проблем химической кинетики является нахождение k0 и Еа по экспериментальным данным. В качестве примера рассмотрим методику нахождения значений этих величин для реакции
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О.
Сахароза Глюкоза Фруктоза
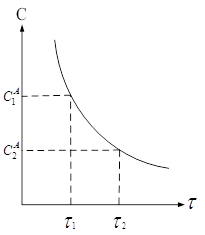
Была изучена кинетика этой реакции в присутствии серной кислоты концентрации 1,45 моль/л при различных температурах. По экспериментальным данным строится график зависимости ln k – 1/T. Исходя из уравнения Аррениуса, – это линейная зависимость (рис. 4). Находится уравнение прямой, и сопоставлением его с прологарифмированным уравнением Аррениуса
ln k = ln k0 – ![]()
рассчитываются искомые величины:
Ea = 12064∙R = 12064∙8,314 = 100300 Дж/моль,
k0 = e36,729 = 8,94 ∙ 1015.
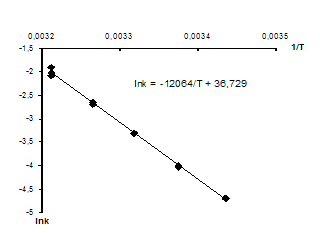
Рисунок – Нахождение коэффициентов уравнения Аррениуса
Для некоторых химических реакций, особенно в органической химии, даже при больших долях активных молекул скорость реакций оставалась незначительной. Теория активных столкновений объясняет это особенностями столкновения молекул.
3 Молекулы перед столкновением должны быть сориентированы друг относительно друга определённым образом.
Нужный вариант относительной ориентации приводит к реакции, в противном случае взаимодействия не происходит. Из термодинамики известно, что функция, характеризующая беспорядок в системе (движение молекул), – это энтропия. В соответствии с третьим положением теории уравнение Аррениуса было преобразовано:
![]() .
.
В этом уравнении Sa – энтропия активации химической реакции. Энтропия активации, как и энергия активации, может быть найдена из экспериментальных данных.
КатализКатализ – изменение скорости химической реакции в присутствии веществ, называемых катализаторами, которые, вступая во взаимодействие с реагентами, сами к концу реакции остаются химически неизменными.
Все важнейшие промышленные процессы протекают в присутствии катализаторов. В живых и растительных системах протекает громадное количество каталитических реакций. При этом увеличение скорости под действием катализаторов может достигать миллионов раз.
Общие свойства каталитических реакций:
1 Участие катализатора в реакции не отражается на её химическом уравнении. Однако скорость реакции пропорциональна количеству катализатора.
2 Катализатор обладает специфичностью действия. Он может изменять скорость одной реакции и не влиять на скорость другой.
3 Катализатор не смещает химического равновесия, так как он в равной мере изменяет скорость и прямой, и обратной реакции.
4 Некоторые вещества усиливают действие катализатора (промоторы), другие – ослабляют (яды).
Различают положительный и отрицательный катализ. Положительный катализ называют просто катализом, отрицательный – ингибированием.
Катализ бывает гомогенным и гетерогенным. Гомогенный катализ наблюдается в том случае, когда катализатор и реагенты находятся в одной фазе. Примерами гомогенного катализа являются реакции в водных растворах в присутствии кислот или щелочей.
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Большая часть каталитических реакций протекает в гетерогенных системах на твёрдых катализаторах.
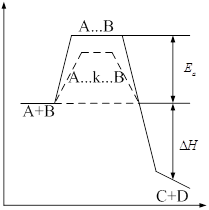
Механизм действия катализатора может быть отражён следующей схемой:
1 А + В = АВ без катализатора;
2: а) А + К = АК;
б) АК + В = АВ + К с катализатором.
Видно, что катализатор сначала связывается с одним из веществ в нестойкое соединение, а затем второй реагент вытесняет его из этого соединения.
Существующие в настоящее время представления о влиянии катализатора на скорость химической реакции объясняют увеличение скорости тем, что катализатор уменьшает энергию активации и (или) увеличивает энтропию активации химической реакции.
Похожие работы
... образования продуктов реакции равна скорости их превращения в исходные реагенты. Химическое равновесие является динамическим, то есть его установление не означает прекращения реакции. Признаки истинного химического равновесия: состояние системы остается неизменным во времени при отсутствии внешних воздействий; состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были ...
... твёрдого вещества (гетерогенные реакции); 6. от среды (растворы); 7. от формы реактора (цепные реакции); 8. от освещения (фотохимические реакции). Основной закон химической кинетики – закон действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в реакции : , где – постоянная скорости химической реакции Физический смысл при . ...
... , т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Для мономолекулярной реакции скорость реакции ...
... подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы. 3.2 «Триумфальное шествие органического синтеза» Возникновение структурной теории позволило химикам впервые обрести ...
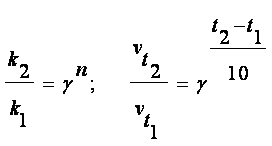
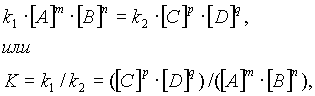
0 комментариев