Навигация
2.1 Анкетирование
Анкетирование – метод сбора первичного материала в виде письменного опроса респондентов с целью сбора информации с помощью анкеты о состоянии тех или иных сторон воспитательного процесса, отношения к тем или другим явлениям [12]. Мы использовали сплошное (опрос всех представителей выборки) и выборочное (опрос части выборки) анкетирование. По числу респондентов и типов контактов респондентов анкетирование‚ проводимое нами следует отнести к групповому (несколько респондентов) и очному (в присутствии исследователя-анкетёра) соответственно. Вопросы предложенные учащимся были составлены в закрытой (содержит полный набор возможных ответов) и открытой (ответ целиком и полностью формулирует сам респондент) форме (Приложение 7).
2.2 Тестирование
Для подведения итога по вопросу актуальности химического эксперимента в системе проблемного обучения мы использовали педагогический тест. Педагогический тест – это инструментальное средство контроля знаний, при использовании которого можно определить надежность проводимого измерения [16, 18]. Тест составлен преимущественно закрытой формой тестовых заданий. То есть‚ учащемуся предлагалось выбрать правильный ответ из нескольких возможных.
2.3Критерий «Степень обученности»
Для подведения итога по проводимым тестированиям мы использовали критерий «Степень обученности».
По В. П.Симонову степень обученности группы (СОГ) вычисляется по формуле:
СОГ = (n5 ∙ 1 + n4 ∙ 0,64 + n3 ∙ 0,36 + n2 ∙ 0,16) ∙ 100 % / N
Где : n5 – количество учащихся, получивших оценку "5"
n4 – количество учащихся, получивших оценку "4"
n3 – количество учащихся, получивших оценку "3"
n2 – количество учащихся, получивших оценку "2"
N – количество учащихся в группе.
Результат до 60 % – вторая степень обученности (низкая).
Результат от 60 до 70 % – третья степень обученности (средняя).
Результат от 70 % и выше – четвертая степень обученности (высокая) [41].
Глава 3. Методические рекомендации и разработки содержания школьного химического эксперимента в системе проблемного обучения
Известно, что большая часть, проводимых в школе опытов имеет иллюстративный характер и используется только для подтверждения изучаемых явлений. Вместе с тем учащимся 9-10-х, и, особенно, 11-х классов, целесообразно предлагать не только иллюстративные опыты, но и опыты проблемного характера, так как они обеспечивают активизацию познавательной деятельности учащихся, учат самостоятельно мыслить, развивают интерес к предмету, улучшают знания, расширяют научный кругозор и часть выводят на новый уровень понимания ранее изученных вопросов школьной программы, при изучении соединений железа на уроках или на факультативных занятиях, по усмотрению учителя, возможна постановка предлагаемых иных опытов. Такие эксперименты целесообразно включать в беседы эвристического характера или в процесс проблемного изложения материала преподавателем.
Обсуждение результатов всех рассмотренных ниже экспериментов проводится в форме фронтальной эвристической беседы, руководимой учителем. Учитель задает вопросы, позволяющие установить существующие закономерности, сделать выводы. Определения понятий, уравнения реакций, выводы, сформулированные детьми и скорректированные учителем, должны быть записаны каждым учащимся в тетрадь. По ходу обсуждения учитель отмечает успехи учащихся, в конце урока ставит им оценки.
Здесь и далее по тексту словосочетание «химический эксперимент (опыт) в системе проблемного обучения» может быть записано как «проблемный эксперимент».
Занятие №1. Тема: Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры
Приведённые ниже опыты, могут быть использованы при объяснении нового материала в изучении темы 1. «Скорость химических реакций. Химическое равновесие» у учеников 9-х классов (см. тематическое планирование для 9 класса, уроки 5-7). Использовался теоретический материал учебника 8 класса О. С. Габриеляна Химия-8 [8], методическое пособие для учителя [9], настольная книга для учителя [5], рабочая тетрадь [7].
Предварительно (на предыдущем уроке) учитель знакомит учащихся с понятием скорость химической реакции и детально подготавливает их к восприятию материала по теме «Факторы, влияющие на скорость химической реакции», повторяя материал учебной программы по темам: «Ряд активности металлов», «Концентрация растворов», «Гомогенные и гетерогенные реакции», «Теория активации». На уроке по теме «Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры» учитель проверяет в форме теста пройденный на предыдущем занятии материал и материал по темам повторения.
Цель работы: провести эксперимент, показывающий зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры
Форма проведения эксперимента: фронтальная (демонстрационный эксперимент), и/или эксперимент на лабораторной работе
Оборудование и реактивы: 10%-ый раствор НCl, 10%-ый раствор H2SO4, Mg (опилки), Zn (опилки, гранулы и порошок), Fe (опилки), CuO (порошок), дистиллированная вода; спиртовка, пробирки, пробиркодержатель, спички.
Ход работы:
Опыт №1. Зависимость скорости химической реакции от природы реагирующих веществ
До проведения опыта 1 учитель не должен акцентировать внимания учащихся на теме «Ряд активности металлов», необходимо проверить остаточные знания путём создания проблемной ситуации.
В три пробирки (подписанные, под номерами) прилить по 3 мл раствора НCl и внести в каждую из пробирок навески опилок одинаковой массы: в первую – Mg, во вторую – Zn, в третью – Fe;
Наблюдения: что химическая реакция идет во всех трех пробирках с выделением газа.
Уравнения реакций:
Mg + 2НCl → MgCl2 + Н2↑ (очень бурно)
Zn + 2НCl → ZnCl2 + Н2↑ (бурно)
Fe + 2НCl → FeCl2 + Н2↑ (медленно)
Проблема:
Учитель: массы взятых веществ навесок твёрдых веществ, концентрация соляной кислоты, условия проведения реакции одинаковы, но при этом интенсивность проходящих процессов (скорость выделения водорода) различна?
Обсуждение:
Учащиеся: мы брали разные металлы.
Учитель: все вещества состоят из атомов химических элементов. Чем отличаются химические элементы согласно знанию вами Периодического закона и Периодической системы Д. И. Менделеева?
Учащиеся: Порядковым номером, положением в Периодической системе Д. И. Менделеева, то есть они имеют различное электронное строение, а следовательно простые вещества образованные этими атомами имеют различные свойства.
Учитель: то есть эти вещества имеют различную природу. Таким образом, скорость химической реакции будет зависеть от природы того или иного реагирующего вещества, т. к. они имеют различное строение и свойства.
Вывод:
Учащиеся: Скорость химической реакции будет зависеть от природы реагирующих веществ: чем активнее металл (вещество), тем выше скорость химической реакции.
Учитель: демонстрация положения химических элементов в «Ряду активности металлов»
Опыт №2. Зависимость скорости химической реакции от концентрации реагирующих веществ
До проведения опыта 2 учитель не должен акцентировать внимания учащихся на теме «Концентрация растворов», необходимо проверить остаточные знания путём создания проблемной ситуации.
В три пробирки (пронумерованные) прилить раствор НCl: в первую – 3 мл; во вторую – 2 мл; в третью – 1 мл.
Затем во вторую и третью добавить по 1 мл и 2 мл дистиллированной воды соответственно (тем самым разбавляем раствор).
В каждую из пробирок опустить по грануле Zn (примерно одинакового размера).
Наблюдения: химическая реакция идет во всех трех пробирках, но с разной скоростью.
Уравнение реакции:
Zn + 2НCl → ZnCl2 + Н2↑
· 10%-ый бурно
раствор НCl
· разбавленный медленно
10%-ый раствор НCl
· очень разбавленный очень медленно
10%-ый раствор НCl
Проблема: природа всех реагирующих веществ, условия проведения опыта одинаковы, однако интенсивность проходящих процессов (скорость выделения водорода) различна?
Обсуждение:
Учитель: почему скорость химической реакции разная, ведь реагируют одинаковые по химической природе вещества?
Учащиеся: При добавлении воды, мы изменили (уменьшили) концентрацию соляной кислоты во второй и третьей пробирках, при этом интенсивность выделения водорода уменьшалась.
Вывод:
Учащиеся: Скорость химической реакции будет зависеть от концентрации реагирующих веществ: чем больше концентрация реагирующих веществ, тем выше скорость химической реакции.
Опыт №3. Зависимость скорости химической реакции от температуры
В три пробирки (под номерами) налить по 3 мл раствора Н2SO4 (одинаковой концентрации). В каждую поместить навеску CuO (II) (порошок). Первую пробирку оставить в штативе; вторую – опустить в стакан с горячей водой; третью – нагреть в пламени спиртовки.
Наблюдения: химическая реакция идет во всех трех пробирках: раствор окрашивается в голубой цвет. Но в первой очень медленно и практически незаметно, во второй – с небольшой скоростью, а в третьей – очень быстро.
Учитель: какие процессы происходят с веществом – сильным электролитом – в растворе?
Учащиеся: при растворении вещества в воде происходит его диссоциация, т.е. вещества диссоциируют на ионы.
Учитель: какие ионы могут образоваться при диссоциации исходных веществ?
Учащиеся: среди исходных веществ есть только один сильный электролит – это серная кислота, она диссоциирует по уравнению: Н2SO4 → 2Н+ + SO42-.
Учитель: известно, что вещества диссоциируя могут взаимодействовать с молекулами воды, образуя гидратированные ионы, и некоторые среди таких гидратированных ионов окрашивают раствор в соответствующий цвет. Однако ни один из ионов: Н+ и SO42- не имеет окраски в растворе. Следовательно, синий цвет раствору придали гидратированные ионы полученные при диссоциации продукта реакции.
Учащиеся:
Уравнение реакции:
CuO + Н2SO4 → CuSO4 + Н2О
Синий раствор
· Н.у. очень медленно
· С горячей водой медленно
· Кипячение очень быстро
Учитель: синюю окраску раствору придали гидратированные ионы меди.
Проблема:
Учитель: все взятые для эксперимента вещества имеют одинаковую природу, масса взятого порошка CuO и концентрация серной кислоты также одинаковы, однако скорость реакции разная.
Обсуждение:
Учащиеся: Значит, при изменении температуры реакции мы изменяем и ее скорость.
Учитель: Значит ли это, что при повышении температуры будет увеличиваться скорость всех химических реакций?
Учащиеся: Нет. Некоторые реакции идут при очень низких и даже минусовых температурах.
Вывод:
Учащиеся: Следовательно, любое изменение температуры на несколько градусов будет в разы изменять скорость химической реакции.
Учитель: Практически так звучит закон Вант-Гоффа, который будет здесь действовать: При изменении температуры реакции на каждые 10 ºС скорость химической реакции изменяется (увеличивается или уменьшается) в 2-4 раза.
Опыт №4. Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ
В три пробирки (под номерами) прилить по 2 мл раствора HCl, и добавить в первую – гранулу Zn, во вторую – стружку Zn, в третью – порошок Zn (одинаковые по массе).
Наблюдения: химическая реакция идет во всех трех пробирках (выделение газа), но с разной интенсивностью.
Уравнение реакции:
Zn + 2НCl → ZnCl2 + Н2↑
· гранулы медленно
· стружка с высокой скоростью
· порошок бурно
Проблема:
Учитель: все вещества одинаковы по своей химической природе, одинаковы по массе и концентрации, реагируют при одинаковой температуре, однако интенсивность выделения водорода (а следовательно и скорость) разная.
Обсуждение:
Учащиеся: Одинаковые по массе гранулы Zn, стружки Zn и пыль Zn, имеют разные занимаемые объемы в пробирке, разную степень измельчения. Там где эта степень измельчения наибольшая – скорость выделения водорода максимальна.
Учитель: эта характеристика – площадь поверхности соприкосновения реагирующих веществ. В нашем случае различна площадь поверхности соприкосновения цинка с раствором Н2SO4.
Вывод:
Учащиеся: Скорость химической реакции зависит от площади соприкосновения реагирующих веществ: чем больше площадь соприкосновения реагирующих веществ (степень измельчения), тем больше скорость реакции.
Учитель: такая зависимость наблюдается не всегда: так для некоторых гетерогенных реакций, например, в системе Твердое вещество – Газ, при очень высоких температурах (более 500 0С) сильно измельчённые (до порошка) вещества способны спекаться, тем самым площадь поверхности соприкосновения реагирующих веществ уменьшается.
Занятие №2. Тема: Катализ и катализаторы
Приведённый ниже опыт проводится фронтально при объяснении нового материала в изучении темы 1. «Скорость химических реакций. Химическое равновесие» у учеников 9-х классов (см. тематическое планирование для 9 класса, уроки 7). Использовался теоретический материал учебника 8 класса О. С. Габриеляна Химия-8 [8], методическое пособие для учителя [9].
Цель работы: изучить влияние катализатора на скорость химической реакции.
Форма работы: фронтальная (демонстрационный эксперимент).
Реактивы и оборудование: 3% раствор перекиси водорода, MnO2 (порошок), детергент; спиртовка, пробирки, пробиркодержатель, спички, лучина, кипящая водяная баня.
Ход работы
Опыт №5. Зависимость скорости химической реакции от катализатора
Следует повторить понятие реагент в химической реакции, что бы потом учащийся смог дифференцировать реагент и катализатор в конкретной реакции.
В пробирку № 1 прилить 3%-ый раствор перекиси водорода и внести детергент (растворенный стиральный порошок). В пробирку № 2 прилить 3%-ый раствор перекиси водорода внести порошок оксида марганца (IV) и внести детергент (растворенный стиральный порошок).
Наблюдения: химическая реакция очень бурно проходит во второй пробирке и сопровождается выделением газа (детергент поднимается), по окончании реакции во второй пробирке масса оксида марганца (IV) не изменилась.
Учитель: Какой это газ? Водород или кислород? Как доказать выделение каждого из газов?
Ученики: внесём тлеющую лучину.
Наблюдения: лучина вспыхивает
Ученики: следовательно, это кислород
Уравнение реакции:
2Н2О2 → 2Н2О+ О2↑
Проблема: если условия проведения опытов в пробирке № 1 и № 2 – концентрация перекиси водорода, температурный режим, природа исходного вещества – были одинаковые, а внесённый оксид марганца (IV) не израсходовался в ходе опыта, то почему во второй пробирке так интенсивно выделялся кислород?
Обсуждение:
1) проходит ли реакция разложения перекиси водорода в первый пробирке?
Обсудить с учащимися условия хранения, используемого в быту как бактерицидное средство, вещества – перекиси водорода. Обратить внимание на то, что особенно на свету она разлагается на воду и кислород, который в момент образования обладает сильными окислительными свойствами. По этой причине перекись водорода хранят в герметичных тёмных склянках.
Учитель: нам уже известно, что повышение температуры способствует повышению скорости реакции. Подогреем пробирку № 1 на водяной бане.
Наблюдения: детергент поднимается по пробирке.
Учащиеся: следовательно, газ выделяется.
2) является ли добавленный в пробирку 2 оксид марганца (IV) реагентом в данной реакции?
Ученики: обращают внимание, что после окончания реакции во 2 пробирке, остался черный порошок оксида марганца (IV). Следовательно – это не реагент.
Учитель: Используемое нами вещество – оксида марганца (IV) – это катализатор. Поскольку, катализаторы – это вещества, которые изменяют скорость химической реакции, но сами в ходе этого не расходуются. Катализаторы бывают положительные (увеличивают скорость химической реакции) и отрицательные – ингибиторы (уменьшают скорость химической реакции). катализаторы способны изменять природу реагирующего вещества (его энергию активации).
Вывод по занятиям 1 и 2:
Учитель: Давайте подведем итоги и сделаем выводы. От чего будет зависеть скорость химической реакции?
Учащиеся:
- от природы реагирующих веществ;
- от их концентрации;
- от температуры реакции;
- от площади соприкосновения реагирующих веществ;
- от катализатора.
Занятие №3. Тема: Химические свойства металлов
Приведённые ниже опыты проводились при объяснении нового материала и/или при обобщении в изучении темы 2. «Металлы» у учеников 9-х классов (см. тематическое планирование для 9 класса, уроки 12, 24). Использовался теоретический материал учебника 9 класса О. С. Габриеляна Химия-9 [10], методическое пособие для учителя [9], настольная книга для учителя [6].
Цель работы: изучить особенности взаимодействия разных металлов с водой, с кислотами и с солями.
Форма проведения эксперимента: фронтальная (демонстрационный эксперимент при объяснении нового материала).
Учитель: Назовите основное химическое свойство металлов – простых веществ.
Учащиеся: Металлы являются восстановителями, т. к. их атомы легко отдают электроны, превращаясь при этом в положительно заряженные ионы – катионы.
Учитель: (запись на доске)
М0 – n ē → М n+
(восстановитель, окисляется)
Для того чтобы прошла реакция, которая записана на доске, необходимо наличие окислителя. Давайте вспомним, какие вещества могут быть окислителями?
Учащиеся: (при обсуждении выявляется список веществ реагирующих с металлами):
- неметаллы: О2, Hal2, S, H2 и др.
- Н2О;
- кислоты;
- соли.
Опыт №1. Взаимодействие активных металлов с водой и демонстрация образцов металлов – простых веществ
Реактивы и оборудование: Аl (гранулы), Na, фенолфталеин; кристаллизатор.
Ход работы:
Учитель: Проведем опыт. Для опыта возьмём образцы двух активных металлов (см. Ряд активности металлов): Аl (гранулы) и Na. В кристаллизатор с водой прильем 2-5 капель фенолфталеина и поместим небольшой, очищенный (скальпелем) от перекиси и предварительно подсушенный (сухой фильтровальной бумагой) от керосина кусочек Na, а в пробирку с водой поместим гранулу алюминия.
Наблюдения:
· натрий «бегает» по поверхности воды и быстро реагирует с ней, полностью исчезнув, а вода окрашивается в розовато-малиновый цвет;
· в пробирке с алюминием признаков реакции не наблюдаем.
Уравнения реакций:
2 Na + 2 H2O → 2 NaOH + H2 ↑
Алюминий, будучи достаточно активным металлом, также должен вступать в реакцию с водой по уравнению: 2Аl + 6Н2О → 2Аl(OH)3 + 3H2 ↑, однако признаков реакции мы не наблюдаем.
Проблема: алюминий – активный металл при н.у. не показывает признаков реакции взаимодействия с водой?
Обсуждение:
Учитель демонстрирует учащимся образцы некоторых щелочных, щелочноземельных и амфотерных металлов. Учащиеся наблюдают, что одни металлы хранятся при обычных условиях (Аl, Zn, Fe), другие в стеклянной банке под слоем керосина (Na, Ca, К).
Учащиеся: Исходя из их химических свойств, одни металлы более активны, а другие – менее. Щелочные и щелочноземельные металлы самые активные и легко взаимодействуют с кислородом воздуха, поэтому хранят под слоем керосина. А другие менее активные они взаимодействуют с кислородом только при нагревании, поэтому могут храниться при обычных условиях.
Учитель: почему сегодня алюминиевая посуда рекомендуется только для хранения холодных продуктов, а использование её для нагревания нежелательно.
Учащиеся: при нагревании происходит химический процесс: 2Аl + 6Н2О → 2Аl(OH)3 + 3H2 ↑, ионы алюминия переходят в раствор, и их присутствие нежелательно для пищевых блюд.
Учитель: таким образом, алюминий при н.у. защищён оксидной плёнкой Al2O3. Именно эта оксидная плёнка предохраняет алюминий от активного взаимодействия с водой при н.у., если же она будет удалена, то алюминий будет энергично реагировать с водой.
Опыт №2. Взаимодействие металлов с кислотами
Реактивы и оборудование: Аl (гранулы), , Zn (гранулы), 40%-ый раствор НCl,; пробирки.
Ход работы:
В две пронумерованные пробирки нальем 3 мл 40%-го раствора НCl, 2-3 капли фенолфталеина и поместим в каждую гранулы Zn и алюминия, соответственно. В маленький кристаллизатор нальём небольшое количество (примерно 2 см в высоту) 40%-го раствора НCl .
Наблюдения:
- в пробирке с цинком: реакция сразу идёт бурно, с выделением газа, изменения окраски фенолфталеина не происходит
2HCl + Zn → ZnCl2 + H2↑
- в пробирке с алюминием: сначала не наблюдаем признаков реакции, а затем реакция идёт бурно, с выделением газа выделением газа, изменения окраски фенолфталеина не происходит
6HCl + 2Al → 2AlCl3 + 3H2↑
Проблема: все взятые металлы активны, однако они по-разному реагируют с водой?
В частности, алюминий и цинк? Оба металла находятся в раду активности рядом, значения их стандартных электродных потенциалов очень близки по значению Е0(Аl) = – 1,66, Е0(Zn) = – 0,76.
Обсуждение:
Учащиеся: пользуясь результатами опыта № 1, делают вывод, что отсроченное во времени выделение пузырьков газа на поверхности алюминия связано с присутствием на его поверхности более прочной оксидной плёнки.
Учитель: следовательно, прочность оксидной плёнки позволяет защищать алюминий не только при его взаимодействии с водой, но и при взаимодействие с сильными кислотами. Можно привести в пример опыт с нагреванием алюминиевой проволоки в пламени газовой горелки (алюминий плавится внутри капсулы, стенки которой образованы Al2O3 и предупреждают стекание алюминия).
Вывод по опыту: согласно ряду напряжения металлов, металлы, стоящие до водорода будут вытеснять его из раствора кислот (исключение: щелочные и щелочно-земельные металлы: они реагируют с водой, растворяющей кислоты).
Опыт №4. Взаимодействие металлов с растворами солей
Реактивы и оборудование: Zn (гранулы), Fe (железный гвоздь), Сu (восстановленная), 40%-ый раствор сульфата железа (II), 5 %-ый раствор СuSO4, 40%-ый раствор сульфата (хлорида) железа (III), 10 % раствор сульфата (хлорида) цинка, раствор хлорида (сульфата) железа (Ш), пробирка с налетом серебра; пробирки.
Ход опыта:
В пробирку № 1 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим кусочек железа (железный гвоздь).
В пробирку № 2 прильём раствор сульфата железа (II) и добавим восстановленную медь.
В пробирку № 3 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим гранулу цинка.
В пробирку № 4 прильём раствор сульфата (хлорида) цинка объёмом 5 мл и добавим восстановленную медь.
В пробирку № 5 прильём раствор сульфата (хлорида) железа (III) и добавим порошок восстановленной меди.
Наблюдения (запись уравнений реакций на доске):
В пробирке № 1: СuSO4 + Fe → Сu + FeSO4: красно-рыжий налет на кусочке Fe.
В пробирке № 2: FeSO4 + Cu: ничего не происходит.
В пробирке № 3: СuSO4 + Zn → Сu + ZnSO4: красно-рыжий налет на кусочке Zn.
В пробирке № 4: ZnSO4 + Cu: ничего не происходит.
В пробирке № 5: Fe2(SO4)3 + Cu: медь растворяется, появляется зеленовато-голубоватое окрашивание раствора.
Учитель: известно, что металлы реагируют с растворами солей с выделением металла, входящего в состав соли и соли металла, используемого в ходе работы, по схеме: Ме + Ме*А → Ме* + МеА.
Проблема: Все предложенные опыты – это опыты с использованием металла и соли другого металла, однако не все результаты опытов вписываются в схему Ме + Ме*А → Ме* + МеА. Почему?
Учитель: какая характеристика вещества является определяющей для его способности вступать во взаимодействие с другим веществом?
Ученик: природа реагирующего вещества.
Учитель: определяющим в природе металла является его активность. Обратимся к ряду активности металлов
Учащиеся: медь располагается правее цинка и железа.
Учитель: в реакции № 2 и № 4 с использованием меди простого вещества действительно не было наглядных признаков реакции. А в реакциях соли меди с железом и цинком простыми веществами (пробирки № 1 и № 3) реакции проходили. Вывод: медь – это менее активный металл, чем железо и цинк. Таким образом, металлы расположены в ряду активности слева направо в порядке уменьшения их активности.
Проблема: В пробирке № 5: Fe2(SO4)3 + Cu: медь растворяется, появляется зеленовато-голубоватое окрашивание раствора.
Учитель: при проведении реакции № 2 мы показали, что медь это менее активный металл, чем железо, и она не способна вытеснять железо из раствора его соли. Однако в пробирке № 5 мы отметили признаки реакций. В чём отличие использованных для реакции № 2 и № 5 солей?
Учащиеся: для реакции № 2 была взята соль железа (II), а для реакции № 5 – соль железа (III).
Учитель: таким образом, соли железа (III), в отличие от солей железа (II), способны вступать во взаимодействие с менее активными металлами. Предположим, что растворение меди происходит вследствие проявления ионами трехвалентного железа окислительных свойств,
Ученики: составляет схему предполагаемого уравнения реакции в ионном виде:
Cu0 + Fe3+ ® Cu2+ + Fe2+
В итоге учитель делает вывод, что ионы Fe3+ обладают настолько сильным окислительным свойством, что могут даже в водном растворе окислить медь, в заключении составляем уравнение реакции № 5 в молекулярном виде:
Cu + Fe2(SO4)3 → 2Fe SO4 + CuSO4
Учитель: следовательно, правило о том, что металлы, стоящие в ряду активности металлов правее железа, не должны реагировать с солями железа, справедливо только для растворов солей железа (II). Соли железа (III) в растворе обладают сильными окислительными свойствами и реагируют со многими менее активными металлами, включая медь.
В подтверждение сказанного учитель проводит опыт № 6:
в пробирку № 6 с налетом серебра (после реакции «серебряного зеркала») прилить раствор хлорида железа (III).
Наблюдения:
В пробирке № 6: Fe2(SO4)3 + Ag: растворение серебра, а через 2-3 минуты полное исчезновение налета серебра со стенок пробирки. Причем одновременно с растворением серебра происходит легкое помутнение раствора вследствие образования осадка сульфата серебра.
Ученики: составляет схему предполагаемого уравнения реакции в ионном виде:
Ag0 + Fe3+ ® Ag+ + Fe2+
После этого выдвинутую гипотезу проверяем исследованием полученной в реакции № 6 смеси. Качественная реакция на ионы серебра (с хлоридами натрия или соляной кислотой) дает положительный результат, это объясняется тем, что растворимость сульфата серебра значительно выше, чем хлорида.
В заключении ученики по краткому ионному уравнению составляют уравнение реакции № 6 в молекулярном виде:
2Ag + Fe2(SO4)3 → Ag2SO4 + 2FeSO4
Занятие № 4. Тема «Металлы»
Этот опыт проводится на уроке № 21 (см. тематическое планирование 9 класс) по теме «Соединения алюминия».
Цель опыта: изучить химические свойства солей алюминия
Форма проведения опыта: фронтальная (демонстрационный эксперимент).
Реактивы и оборудование: Na, 10 % раствор сульфата (хлорида) алюминия, фенолфталеин; пробирки, кристаллизатор.
Ход опыта:
В кристаллизатор с раствором хлорида алюминия и несколькими каплями фенолфталеина поместить небольшой кусочек натрия.
Наблюдения: выделение пузырьков газа, розово-малиновое окрашивание раствора и осадка белого цвета.
Учитель: натрий – это более активный металл, чем алюминий. Следовательно, натрий должен вытеснять алюминий из растворов его солей по уравнению:
3Na + AlCl3 → Al + 3NaCl
Проблема: Согласно этому уравнению реакции мы не должны наблюдать выделение газа и осадка белого цвета. Кроме того, ни полученное по нашей схеме вещество NaCl, ни исходное вещество AlCl3 не имеет щелочной реакции среды (можно для сравнения предложить раствор хлорида натрия и раствор хлорида алюминия с фенолфталеином). То есть, активный металл натрий не вытесняет менее активный алюминий из растворов его солей?
Учащиеся: натрий активно реагирует с водой растворяющей хлорид алюминия по уравнению: 2Na + 2 H2O → 2 NaOH + H2↑. Таким образом, мы объясняем выделение газа (водорода).
Учитель: как объяснить выделение осадка? Обратимся к таблице растворимости (растворимость исходных и продуктов).
Учащиеся: все исходные вещества и предполагаемые продукты реакции растворимы в воде.
Учитель: какие ионы имеются в предложенном растворе?
Учащиеся: ионы Na+, OH–, Al3+, Cl–.
Учитель: запишите возможные уравнения реакций взаимодействия между этими ионами:
Учащиеся:
Na+ + OH– → NaOH;
Na+ + Cl– → NaСl;
Al3++ 3Cl– → AlСl3;
Al3++ 3OH– → Al(OH)3↓.
Таким образом, все вещества находятся в одной пробирке, следовательно, вступать во взаимодействие могут не только исходные вещества, но и продукты их взаимодействия.
Учитель: запишем оба уравнения и суммируем их:
2Na + 2 H2O → 2 NaOH + H2↑
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
Суммарно: Na + AlCl3 + H2O → Al(OH)3↓ + NaCl + H2↑
Расставим коэффициенты методом электронного баланса:
Na0 + AlCl3 + H+2O → Al(OH)3↓ + Na+Cl + H20↑
Na0 – е– → Na+ 2
2 H+ + 2 е– → H20 1
2Na0 + AlCl3 + H+2O → Al(OH)3↓ + 2Na+Cl + H20↑
Занятие № 5. Тема: МеталлыПриведённые ниже опыты проводятся в 9 классе при изучении темы «Металлы» на уроке № 23 «Генетические ряды Fe2+ и Fe3+» (см. тематическое планирование 9 класс).
Цель работы: изучить свойства солей железа (III), как окислителей
Форма работы: фронтальная (демонстрационный эксперимент).
Реактивы и оборудование: кристаллический хлорид аммония и хлорид железа (Ш), колба Вюрца, известковая вода, лучинка, склянки Дрекселя, спиртовка, индикаторная бумага.
Опыт 1. Взаимодействие хлорида железа (III) с хлоридом аммония
Хлорид Fe (III) проявляет окислительные свойства по отношению к различным восстановителям. В беседе предшествующей проведению опыта, перед учащимися ставим вопрос: возможно ли химическое взаимодействие между двумя кристаллическими солями хлоридом железа трехвалентного и хлоридом аммония? В поиске ответа на данный вопрос ученики обращаются к таблице растворимости, так как, им известно, что соли взаимодействуют между собой при условии, что они хорошо растворимы, а в результате реакции обмена получается новая нерастворимая соль. В процессе беседы учитель поясняет, что таблицу растворимости в данном случае, при использовании кристаллических вещест, применять нельзя. Таким образом, предварительное обсуждение приводит учащихся к выводу о невозможности химического взаимодействия между указанными веществами.
Далее проводим эксперимент. Он представляет интерес не только для выяснения окислительных свойств хлорида железа (III), но и как способ получения азота в лабораторных условиях.
Ход опыта:
В соответствии с стехиометрическими коэффициентами в уравнении реакции: 6FeCl3 + 2NH4Cl = 6FeCl2 + 8HCl + N2, учитель готовит смесь кристаллических солей хлорида железа (III) и хлорида аммония. Эту смесь помещают в колбу Вюрца, которую соединяют с двумя склянками Дрекселя, заполненными водой (рис. 1). Промывные склянки необходимы для того, чтобы поглотить выделяющийся в ходе реакции хлороводород. Соблюдая технику безопасности, проводят нагревание. Образовавшийся азот можно собрать в 2-3 пробирки над водой.
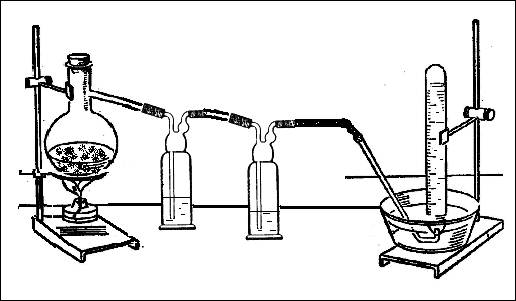
Рис. 1. Взаимодействие хлорида железа (III) с хлоридом аммония
Далее проверяем отсутствие примеси хлороводорода, поднеся влажную индикаторную бумагу к отверстию пробирки с азотом. Она не изменяет цвет. Проводим опыт подтверждающий, что собранный газ действительно азот.
а) В первую пробирку с азотом опускаем горящую лучинку она гаснет, не оставляя даже раскаленного уголька.
б) Во вторую – наливаем известковую воду, в отличие от углекислого газа, известковая вода от азота не мутнеет.
Доказав учащимся, что получен азот, отвергаем их мнение о невозможности взаимодействия хлорида железа (III) с хлоридом аммония.
Создается проблемная ситуация. Далее ученики должны выдвинуть свои предположения о роли каждого вещества в данной химической реакции. Анализ состава исходных веществ и результатов опыта приводит к выводу, что хлорид железа (III) выступает в роли окислителя, а соль аммония, имея в своем составе атомы азота в низшей степени окисления (– 3), проявляет восстановительные свойства. Подтверждаем этот вывод и напоминаем учащимся другие примеры проявления данными веществами указанных свойств. Затем предлагаем учащимся самостоятельную работу по составлению уравнения окислительно-восстановительной реакции между хлоридом железа (III) и хлоридом аммония. При составлении уравнения реакции учащиеся должны учесть, что один из продуктов реакции – хлороводород.
6FeCl3 + 2NH4Cl = 6FeCl2 + 8HCl + N2
Fe3+ + e- ® Fe2+ | 6
2N3- - 6e- ® N20 | 1
Опыт 2. Взаимодействие роданида железа (III) с фосфорной кислотой
Этот опыт очень эффектен и может быть использован в процессе эвристической беседы не только при изучении темы «Металлы», но и при рассмотрении качеств реакции на фосфат-ионы. В аналитической химии известна реакция взаимодействия растворимых солей железа (III) с фосфат-ионами, сопровождающаяся образованием желтовато-белого осадка фосфата железа трехвалентного. Этот опыт рекомендуем провести на уроке, как пример качественной реакции на фосфат-ионы и с целью подготовки учащихся к обсуждению проблемного эксперимента.
Учитель: будет ли роданид железа (III) взаимодействовать с фосфорной кислотой?
Ученики: такая реакция невозможна, поскольку эта соль железа – малодиссоциированное соединение, и ионы железа (III), необходимые для образования осадка фосфата железа (III), в растворе отсутствуют.
Реактивы и оборудование: раствор роданида железа (Ш), раствор фосфорной кислоты, пробирки.
Ход опыта:
Для проведения опыта получен роданид железа (III) путем взаимодействия растворимой соли железа (III) с роданидом калия или аммония. Этому процессу соответствует краткое ионное уравнение реакции.
Fe3+ + 3SCN- = Fe(SCN)3
К винно-красному раствору роданида железа (III) приливаем фосфорную кислоту. Протекает эффектная реакция, сопровождающаяся обесцвечиванием реакционной смеси с одновременным образованием желтовато-белого осадка фосфата железа (III).
Результаты опыта вызывают проблемную ситуацию.
Учитель: роданид железа (III), как и любое малодиссоциирующее соединение, очень плохо, но подвергается диссоциации.
Ученики:
Fe(SCN)3 <=> Fe3+ + 3SCN-
Учитель: Диссоциация процесс обратимый, следовательно, его равновесие можно сместить, добавив в раствор вещество, способное связывать ионы в соединение с меньшей степенью диссоциации. В данном случае происходит разрушение комплексного соединения роданида железа (III) вследствие образования осадка фосфата железа (III).
Fe(SCN)3 + PO43- = FePO4 + 3SCN-
Занятие № 6. Тема: «Гидролиз солей»
Предложенные ниже опыты рекомендуется проводить при изучении темы «Строение вещества и их свойства» у учащихся 11 классов, обучающихся по учебнику О. С. Габриеляна «Химия-11» на уроке по теме «Гидролиз неорганических веществ» (см. тематическое планирование 10 класс)
Цель работы: получить представления о гидролизе неорганических веществ, используя проблемный эксперимент.
Форма работы: Работа выполняется в группах (4–5 человек) или в парах учащихся.
Оборудование и реактивы: растворы веществ: HCl, HNO3, H2SO4, NaOH, KOH, Ba(OH)2, NaCl, K2SO4, Na2CO3, CuSO4, CuCl2, Pb(NO3)2, FeCl3, Na2S, K2SO3, CH3COONa, KBr, NaNO3, лакмус, фенолфталеин.
Ход опыта:
В подписанные пробирки с предложенными веществами прилить соответствующие индикаторы.
Учащиеся знакомы со свойствами кислот и щелочей изменять окраску индикаторов. Поэтому они быстро проводят соответствующие реакции с кислотами и щелочами и объясняют изменение окраски лакмуса и фенолфталеина взаимодействием индикатора с ионами H+ и OH–. При диссоциации средних солей образуются катионы металлов и анионы кислотных остатков, которые с индикаторами не взаимодействуют.
Проблема возникает тогда, когда цвет индикатора изменяется в растворах карбоната натрия и сульфата меди (II). Причем цвет лакмуса в растворе Na2CO3 становится синим, а в растворе CuSO4 – красным.
Учитель: составим таблицу «Окраска лакмуса в растворах солей»
| Соль | Окраска раствора соли при добавлении индикатора (лакмуса) | Реакция среды |
| Na2CO3 | синий | щелочная |
| CuSO4 | красный | кислая |
Учащиеся: Для объяснения наблюдаемых явлений учащиеся выдвигают ряд гипотез, одна из которых – посторонние примеси в растворах солей Na2CO3 и CuSO4.
Учитель: Для проверки этой гипотезы учитель предлагает для анализа растворы других солей: CuCl2, Pb(NO3)2, FeCl3, Na2S, K2SO3, CH3COONa, KBr, NaNO3.
Учащиеся: продолжают таблицу «Окраска лакмуса в растворах солей»
| Соль | Окраска раствора соли при добавлении индикатора (лакмуса) | Реакция среды |
| Na2CO3 | синий | щелочная |
| CuSO4 | красный | кислая |
| CuCl2 | красный | кислая |
| Pb(NO3)2 | красный | кислая |
| FeCl3 | красный | кислая |
| Na2S | синий | щелочная |
| K2SO3 | синий | щелочная |
| CH3COONa | синий | щелочная |
| KBr | фиолетовый | нейтральная |
| NaNO3 | фиолетовый | нейтральная |
Учитель: Таким образом, все соли можно разделить на три группы:
1-я группа – соли, растворы которых ведут себя по отношению к лакмусу как кислоты (CuSO4, CuCl2, Pb(NO3)2, FeCl3);
2-я группа – соли, растворы которых ведут себя по отношению к лакмусу и фенолфталеину как щелочи (Na2CO3, Na2S, K2SO3, CH3COONa);
3-я группа – соли, растворы которых не изменяют окраску индикатора (KBr, NaNO3).
Гипотезу о посторонних примесях можно считать отвергнутой.
Учитель: Почему растворы солей первой группы изменяют фиолетовую окраску раствора лакмуса на красную?
Учащийся: Значит, в этих растворах есть ионы H+.
Учитель: Откуда ионы H+ в растворе, если вы смешивали соль и воду?
Учащийся: Наверное, из воды.
Учитель: Как от воды могли отделиться ионы H+?
Учащийся: Видимо, какая-то частица соли отрывает от молекулы воды частицу OH–. Отрицательную частицу от молекулы воды может оторвать положительная частица из соли.
Учитель: Что же общего у катионов Cu2+, Pb2+, Fe3+? Почему именно они присоединяют гидроксид-ионы? Почему этого не происходит в случае катионов Na+, K+?
Учащийся: Гидроксиды Сu(OH)2, Pb(OH)2, Fe(OH)3 – cлабые основания, а NaOH, KOH – сильные. Сильные основания в растворе полностью диссоциируют на ионы.
Растворы второй группы солей изменяют фиолетовую окраску лакмуса на синюю. Значит, в их растворах есть гидроксид-ионы. Остатки слабых электролитов – анионы кислотных остатков – взаимодействуют с молекулами воды с образованием ионов OH–. В растворах солей третьей группы нет свободных ионов H+ и OH– . С водой не взаимодействуют остатки сильных электролитов (кислот и оснований).
В результате подобных рассуждений учащиеся самостоятельно приходят к выводам.
1. Если соль образована сильной кислотой и слабым основанием, реакция ее раствора будет кислая. Причина кислой среды – взаимодействие катиона (остатка слабого основания) с молекулами воды. Такое взаимодействие называется гидролизом по катиону.
Fe3+ + 3НОН → Fe(OH)3 + 3H+
2. Если соль образована слабой кислотой и сильным основанием, реакция ее раствора будет щелочная. Причина щелочной среды – взаимодействие аниона (остатка слабой кислоты) с молекулами воды. Этот процесс называется гидролизом по аниону.
CO32- + 2HOH → H2CO3 + 2OH–
3. Если соль образована сильной кислотой и сильным основанием, реакция ее раствора будет нейтральной. Катионы металла и анионы кислотного остатка таких солей не образуют прочных связей с молекулами воды. Как следствие, в растворах таких солей нет ионов H+ и OH–.
Учитель: Реакция солей, образованных сильной кислотой и сильным основанием обратима, так как в ходе неё не образуется слабый электролит.
KBr + HOH <=> KOH + HBr
Таким образом, соли, образованные сильной кислотой и сильным основанием имеют нейтральную реакцию среды, но гидролизу не подвергаются
Учащийся: А как ведут себя в растворе соли, образованные слабым основанием и слабой кислотой?
Учитель: Попробуйте самостоятельно спрогнозировать результат опыта и аргументировать свой прогноз.
Учащийся: Вероятно, реакция раствора такой соли будет нейтральной, ведь ионы H+, образованные при взаимодействии катиона – остатка слабого электролита – с молекулами воды, будут связываться ионами OH–, образованными при гидролизе по аниону.
К фиолетовому раствору лакмуса добавляем раствор ацетата аммония. Цвет не изменяется – реакция раствора нейтральная.
Ученики: составляют уравнение реакции гидролиза ацетата аммония в молекулярной, полной и краткой ионной форме:
CH3COONH4 + HOH → NH4OH + CH3COOH
CH3COO – + NH4 + + HOH → NH4+ + OH – + CH3COO– + H+
HOH → H+ + OH –
Учитель: Поэкспериментируем еще с одной солью – сульфидом аммония (NH4)2S. При его добавлении фиолетовый раствор лакмуса становится синим. Проблема!
Учащиеся: составляют уравнение реакции гидролиза сульфида аммония в молекулярной форме:
(NH4)2S + 2HOH → 2NH4OH + H2S
Учитель: Сила и слабость электролита – понятия относительные. Исходя из данных эксперимента (посинение лакмуса) сила электролита – сероводородной кислоты – оказалась меньше, чем сила гидроксида аммония.
Учащийся: гидроксид аммония лучше продиссоциировал в растворе, поэтому реакция раствора сульфида аммония щелочная.
2NH4 + + S2- + 2HOH → 2NH4 + + 2OH – + H2S↑
S2- + 2HOH → 2OH – + H2S↑
Учащийся: «Как узнать, какой электролит сильнее?»
Учитель: рассказывает о константах диссоциации слабых кислот и оснований, учит пользоваться справочными данными. В заключении учитель анализирует и подводит итоги по таблице «Окраска лакмуса в растворах солей»:
| Соль | Окраска раствора соли при добавлении индикатора (лакмуса) | Реакция среды |
| Na2CO3 | синий | щелочная |
| CuSO4 | красный | кислая |
| CuCl2 | красный | кислая |
| Pb(NO3)2 | красный | кислая |
| FeCl3 | красный | кислая |
| Na2S | синий | щелочная |
| K2SO3 | синий | щелочная |
| CH3COONa | синий | щелочная |
| KBr | фиолетовый | нейтральная |
| NaNO3 | фиолетовый | нейтральная |
| CH3COONH4 | фиолетовый | нейтральная |
| (NH4)2S | синий | щелочная |
Домашнее задание:
Составить уравнения реакций гидролиза для всех, использованных на уроке солей (NaCl, K2SO4, Na2CO3, CuSO4, CuCl2, Pb(NO3)2, FeCl3, Na2S, K2SO3, CH3COONa, KBr, NaNO3) и составить аналогичные, предложенной на уроке, таблицы для фенолфталеина и метилоранжа.
| Соль | Окраска раствора соли при добавлении фенолфталеина | Окраска раствора соли при добавлении метилоранжа | Уравнение реакций гидролиза (молекулярная, полная и краткая ионная форма) | Реакция среды |
| Na2CO3 | ||||
| CuSO4 | ||||
| CuCl2 | ||||
| Pb(NO3)2 | ||||
| FeCl3 | ||||
| Na2S | ||||
| K2SO3 | ||||
| CH3COONa | ||||
| KBr | ||||
| NaNO3 | ||||
| CH3COONH4 | ||||
| (NH4)2S |
По нашему мнению, на следующем уроке в этом классе целесообразно рассмотреть ступенчатый гидролиз для солей, образованных сильным основанием и слабой многоосновной кислотой (например, карбонат натрия) и сильной кислотой и слабым многокислотным основанием (например, сульфат алюминия).
Цель работы: получить представления о ступенчатом гидролизе неорганических веществ и изучить влияние различных фактором на скорость реакции гидролиза, используя проблемный эксперимент.
Форма работы: фронтальная (демонстрационный эксперимент)
Оборудование и реактивы: кристаллические вещества: Na2CO3, Al2(SO4)3; свежеприготовленные 1%-ые растворы CH3COONa, Na3PO4, Na2HPO4, NaH2PO4; растворы Na2CO3 и Al2(SO4)3, приготовленные задолго до занятия и оставленные в бесцветных склянках на свету и при умеренном нагревании (солнце) в герметичных склянках; универсальная индикаторная бумага, фенолфталеин, спиртовка, спички, пробиркодержатель.
Ход опыта:
Учитель: составьте уравнения реакций гидролиза карбоната натрия и сульфата алюминия в молекулярной, полной и краткой ионной формах
Учащиеся:
1) Na2CO3 + 2НОН → 2NaOH + CO2 ↑+ H2O
2Na+ + CO32- + 2НОН → 2Na+ + 2OH- + CO2↑ + H2O
CO32- + 2НОН → 2OH- + CO2 ↑+ H2O
2) Al2(SO4)3 + 6HOH → 2Al(OH)3↓ + 3H2SO4
2Al3+ + 3SO42-+ 6HOH → 2Al(OH)3↓ + 6 H+ + SO42-
Al3+ + 3HOH → Al(OH)3↓ + 3H+
Учитель: согласно предложенному вами уравнению реакции (1) выделяется газ (CO2), а по уравнению (2) – осадок (Al(OH)3). Проведём эксперимент: растворим предложенные соли в воде при н.у. и поместим в их растворы универсальную лакмусовую бумагу.
Наблюдения: в растворе (1) универсальная индикаторная бумага синего цвета (щелочная среда), а в растворе (2) универсальная индикаторная бумага красного цвета (кислая среда), что подтверждается вашими уравнениями реакций. Однако, в пробирке (1) мы не наблюдаем выделения газа, а в пробирке (2) – выделения осадка. Проблема!
Учитель: обратимся к растворам этих же солей, но приготовленным задолго до занятия и оставленным в бесцветных склянках на свету и при умеренном нагревании (солнце) в герметичных склянках. В склянке с карбонатом натрия мы видим пузырьки газа, а в склянке с сульфатом алюминия небольшой осадок. Внесение универсальной индикаторной бумаги даёт результат аналогичный показанному ранее.
Учащиеся: следовательно, мы правильно предположили среду раствора. А сам гидролиз протекает лучше при условиях, отличных от нормальных (более высокие температуры, излучение).
Учитель: действительно, гидролиз солей, образованных сильным основанием и слабой многоосновной кислотой (например, карбонат натрия) и сильной кислотой и слабым многокислотным основанием (например, сульфат алюминия) при н.у. протекает не сразу, а ступенчато. Далее учитель предлагает вспомнить виды солей (нормальные, кислые и основные) и на примере сульфата алюминия рассматривает уравнения реакций ступенчатого гидролиза с образованием основной соли, и с акцентом на число стадий в зависимости от кислотности слабого основания, реакцию среды на каждой из трёх стадий гидролиза и на преимущественном гидролизе по первой ступени. Затем учащиеся самостоятельно составляют уравнение ступенчатого гидролиза карбоната натрия по предложенной схеме, но с образованием кислой соли.
Учитель: таким образом, реакции гидролиза подчиняются тем же правилам в отношении скорости, что и другие реакции: с повышением температуры скорость реакции увеличивается. В подтверждение учащимся предлагается провести опыт с ацетатом натрия и фенолфталеином при н.у., при нагревании и при охлаждении.
Наблюдения: при н.у. – окраска фенолфталеина слабо-малиновая, при нагревании – окраска усиливается, а при охлаждении в холодной воде – слабо-малиновая
Учитель: составьте уравнения реакций гидролиза Na3PO4, Na2HPO4 и NaH2PO4. Согласно уравнениям реакций и, исходя из знания, соли, образованные сильным основанием и слабой кислотой имеют щелочную реакцию среды. Прилейте в пробирки под номерами растворы (1) Na3PO4, (2)Na2HPO4, (3)NaH2PO4, в каждую поместите универсальную индикаторную бумагу.
Наблюдения: (1) Na3PO4 – сильнощелочная (по шкале рН примерно 12), (2)Na2HPO4 – слабощелочная (по шкале рН примерно 9), (3) NaH2PO4 - слабокислая (по шкале рН примерно 6).
Учитель: мы обнаруживаем противоречия между составленными уравнениями реакций и экспериментальными данными. Какая кислота, образует эти соли?
Учащийся: слабая многоосновная ортофосфорная кислота.
Учитель: Рассмотрим сначала гидролиз средней соли – фосфата натрия. Первая (основная) ступень гидролиза выражается следующими уравнениями:
Na3PO4 + HOH <=> Na2HPO4 + NaOH
PO43- + HOH <=> HPO42- + OH-
Образующийся при гидролизе ион НРО42- практически не диссоциирует на ионы (см. константы диссоциации Н3РО4), поэтому характер среды определяют ионы ОН-, и среда водных растворов средних фосфатов является сильнощелочной.
При гидролизе гидрофосфатов на первой ступени образуются дигидрофосфат-ионы, что видно из следующих уравнений:
Na2HPO4 + HOH <=> NaH2PO4 + NaOH
HPO42- + HOH <=> H2PO4- + OH-
Образующиеся ионы Н2РО4- заметно диссоциируют:
Н2РО4- <=> Н+ + НРО42- .
Являющиеся продуктом этой диссоциации ионы водорода частично нейтрализуют ионы ОН-, образующиеся при гидролизе, и поэтому среда гидрофосфатов является слабощелочной.
Что касается дигидрофосфатов, то в их растворах наряду с гидролизом:
NaH2PO4 + HOH <=> H3PO4 + NaOH
H2PO4- + HOH <=> H3PO4 + OH-
идет процесс диссоциации дигидрофосфат-ионов: Н2РО4- <=> Н+ + НРО42-
Причем второй процесс превалирует, поэтому все ионы ОН- (продукт гидролиза) нейтрализуются ионами Н+ (продукт диссоциации), а избыток последних обусловливает слабокислый характер среды растворов дигидрофосфатов.
Занятие № 7. Тема «Гидролиз солей»Предлагаемая форма проведения проблемного эксперимента может быть осуществлена на уроке, в классе с углубленным изучением химии или на факультативном занятии.
Учитель делит класс на пять примерно равных по силе групп. Если занятие длится 2 ч, то группам (4–5 человек) дается задание провести все пять опытов, обсудить их результаты, написать уравнения происходящих процессов, сделать выводы. Затем проводится жеребьевка, в результате которой группа узнает номер опыта, результаты которого ей предстоит объяснить. Причем докладчика из группы назначает учитель, поэтому группа заинтересована, чтобы все ее представители работали и сумели объяснить и написать уравнения происходящих процессов. После выступления докладчика группа вносит исправления и дополнения. Затем остальные группы исправляют ошибки, дополняют ответы первой группы. Таким образом, итоговая оценка группы складывается из оценки выступления докладчика и оценки выступлений группы. Баллы группе приносят также замечания, дополнения к выступлениям других групп. В конце занятия учитель сообщает места, которые заняли группы, и предлагает группам самостоятельно поставить отличные оценки: 1-е место – трем представителям группы, 2-е место – двум, 3-е место – одному.
Если занятие длится 1 ч, то группам (4–5 человек) дается задание провести по одному из предложенных опытов, обсудить результаты этого опыта, написать уравнения происходящих процессов, сделать выводы. Затем проводится жеребьевка, в результате которой определяется очередность выступления групп. Дальнейший ход – как в предыдущей форме проведения занятия.
Возможна также и другая форма оценивания результатов: учитель предлагает учащимся каждой группы оценить работу членов своей группы, затем учитель спрашивает любого учащегося, и, если оценка, выставленная группой, подтверждается, вся группа получает заявленные оценки. Если же оценка оказывается ниже, все заявленные оценки снижаются на один балл.
Цель работы: рассмотреть взаимодействие веществ с продуктами гидролиза.
Реактивы и оборудование: алюминий (гранулы), оксид меди (II), твёрдый карбонат кальция, 10 %-ые растворы: карбоната натрия, хлорида железа (III), сульфата алюминия, концентрированный раствор хлорида железа (III); пробирки, спиртовка, спички.
Ход работы: Учащиеся получают задание: выполнить 5 опытов.
Опыт 1. Поместить гранулу алюминия в раствор карбоната натрия и нагреть реакционную смесь.
Опыт 2. Поместить гранулу алюминия в раствор хлорида железа(III) и нагреть реакционную смесь.
Опыт 3. Поместить в концентрированный раствор хлорида железа(III) кусочек карбоната кальция.
Опыт 4. Поместить в раствор сульфата алюминия немного (на кончике шпателя) оксида меди(II) и нагреть смесь.
Опыт 5. Учащимся предлагается более сложное задание.
УЧИТЕЛЬ. Вы знаете, что металлы, основные оксиды и нерастворимые соли могут взаимодействовать с растворами средних солей, хотя на первый взгляд это противоречит теоретическим представлениям. Подумайте, какую еще необычную для средних солей реакцию можно провести. Проведите ее и объясните наблюдаемые явления (о п ы т 5).
Учитель предлагает проанализировать продукты реакции, объяснить происходящие явления, написать уравнения соответствующих реакций.
Обсуждение результатов эксперимента
Опыт 1. Соль Na2CO3 в растворе подвергается гидролизу по аниону:
CO32– + H2O <=>HCO3– + OH–,
Na2CO3 + Н2O <=>NaHCO3 + NaOH. (1)
Амфотерный оксид алюминия, образующий защитную пленку на поверхности алюминия, взаимодействует со щелочью, полученной по уравнению (1):
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]. (2)
Алюминий, лишенный оксидной пленки, взаимодействует с водой:
2Al + 6H2O = 2Al(OH)3 ↓ + 3H2![]() . (3)
. (3)
Гидроксид алюминия, образовавшийся в реакции (3), взаимодействует с гидроксидом натрия, полученным по реакции (1), т.к. Al(OH)3 – амфотерный гидроксид:
Al(OH)3 + NaOH = Na[Al(OH)4], (4)
Al(OH)3 + OH– = [Al(OH)4]–.
Поскольку гидроксид-ионы связываются гидроксидом алюминия, равновесие гидролиза (1) смещается вправо, идет вторая ступень гидролиза:
HCO3– + H2O <=>OH– + H2CO3 (H2O + CO2![]() ),
),
NaHCO3 + H2O <=>NaOH + H2CO3 (H2O + CO2![]() ). (5)
). (5)
В ходе эксперимента учащиеся наблюдают выделение газов, которые представляют собой смесь водорода и углекислого газа.
Кроме того, наблюдается выпадение осадка. Если раствор карбоната натрия был разбавленным и взят не в избытке, то этот осадок не растворяется до конца. Поэтому есть возможность проанализировать этот осадок.
Учащиеся предполагают, что в осадке Al2(CO3)3. Однако при добавлении кислоты к осадку, промытому от раствора Na2CO3, углекислый газ не выделяется. Надо догадаться, что осадок – Al(OH)3. Гидроксид алюминия – амфотерный, он должен взаимодействовать и с кислотами, и со щелочами. При экспериментальной проверке, действительно, осадок растворяется и в соляной кислоте, и в растворе гидроксида калия:
Al(OH)3 + 3HCl = AlCl3 + 3H2O,
Al(OH)3 + 3H+ = Al3+ + 3H2O;
Al(OH)3 + KOH = K[Al(OH)4],
Al(OH)3 + OH– = [Al(OH)4]–.
Мы считаем, что не следует писать суммарное уравнение реакции алюминия с карбонатом натрия. Достаточно обсудить процессы, которые идут в исследуемой системе, описанные уравнениями реакций (1–5).
Опыт 2. Алюминий реагирует с раствором хлорида железа(III). Во-первых, алюминий более активный металл, чем железо, поэтому алюминий вытесняет железо из раствора его соли:
Al + FeCl3 = AlCl3 + Fe.
В осадке можно обнаружить частички железа, например, с помощью магнита.
Кроме того, было замечено выделение газа, и в осадке наряду с частицами железа обнаружены бурые частицы другого вещества. Анализ газа (характерный хлопок при поджигании) показал, что этот газ – водород.
Логично предположить, что хлорид железа(III) подвергается гидролизу по катиону:
Fe3+ + H2O <=>FeOH2+ + H+,
FeCl3 + H2O <=>FeOHCl2 + HCl. (1)
Получившаяся в результате реакции (1) кислота взаимодействует с алюминием и с образующимся железом с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H2![]() , (2)
, (2)
2Al + 6H+ = 2Al3+ + 3H2![]() ;
;
Fe + 2HCl = FeCl2 + H2![]() , (3)
, (3)
Fe + 2H+ = Fe2+ + H2![]() .
.
Алюминий и железо связывают ионы H+, равновесие гидролиза смещается в сторону его продуктов, гидролиз идет по 2-й и 3-й ступеням:
FeOH2+ + H2O <=>Fe(OH)2+ +H+,
FeOHCl2 + H2O <=>Fe(OH)2Cl + HCl;
Fe(OH)2+ + H2O <=>Fe(OH)3↓ + H+,
Fe(OH)2Cl + H2O <=>Fe(OH)3↓ + HCl.
Следовательно, бурые частицы осадка – это гидроксид железа(III), не растворимый в воде и щелочах, но растворимый в кислотах. Это можно проверить экспериментально:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O,
Fe(OH)3 + 3H+ = Fe3+ + 3H2O.
В растворе щелочи осадок Fe(OH)3 не растворяется.
Опыт 3. Учащиеся знают, что нерастворимые соли (СaCO3) не должны взаимодействовать с другими солями. Однако в системе FeСl3 + CaCO3 они наблюдают бурное выделение газа и выпадение бурого осадка. Для выяснения, какой это газ, в реакционную пробирку вносят горящую лучину, она гаснет. Следовательно, выделяющийся газ – CO2. Анализ осадка проводят аналогично опыту 2. Итак, при взаимодействии FeCl3 c CaCO3 образовались углекислый газ и гидроксид железа(III). Учащиеся объясняют, что образовавшаяся при гидролизе FeCl3 соляная кислота реагирует с CaCO3:
FeCl3 + H2O <=>FeOHCl2 + HCl,
Fe3+ + H2O <=>FeOH2+ + H+;
2HCl + CaCO3 = CaCl2 + H2O + CO2![]() ,
,
2H+ + CaCO3 = Ca2+ + H2O + CO2![]() .
.
Поскольку ионы H+ реагируют с CaCO3, то гидролиз FeCl3 идет по 2-й и 3-й ступеням:
FeOH2+ + H2O <=>Fe(OH)2+ + H+,
Fe(OH)2+ + H2O <=>Fe(OH)3 + H+.
Опыт 4. Учащиеся замечают изменение окраски раствора. Бесцветный раствор становится голубым, что явно свидетельствует о появлении в растворе гидратированных ионов меди Cu2+. Как это объяснить, если известно, что средние соли не реагируют с основными оксидами?
Сульфат алюминия гидролизуется по катиону:
Al3+ + H2O <=>AlOH2+ + H+,
Al2(SO4)3 + 2H2O <=>2AlOHSO4 + H2SO4;
AlOH2+ + H2O <=>Al(OH)2+ + H+,
2AlOHSO4 + 2H2O <=> (Al(OH)2)2SO4 + H2SO4.
Образующаяся серная кислота при нагревании взаимодействует с оксидом меди(II). Ионы Cu2+ переходят в раствор и придают ему голубую окраску.
CuO + H2SO4 = СuSO4 + H2O,
CuO + 2H+ = Сu2+ + H2O.
Учащиеся анализируют раствор на содержание ионов Cu2+. Для этого прибавляют к фильтрату раствор щелочи, наблюдается выпадение голубого осадка:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4,
Cu2+ + 2OH– = Cu(OH)2↓.
Опыт 5. Учащиеся исходят из следующих представлений. При гидролизе соли может образоваться кислота. Кислоты взаимодействуют с металлами, стоящими в ряду активности до водорода, основными оксидами, нерастворимыми солями (если при этом образуется газ), нерастворимыми основаниями и амфотерными гидроксидами. Первые три случая рассмотрены выше (см. опыты 2–4), следовательно, можно предположить, что растворы солей, гидролизующихся по катиону, будут растворять основания и амфотерные гидроксиды. Продукт такого гидролиза – кислота – будет взаимодействовать с основаниями и амфотерными гидроксидами. Например, в растворе Al2(SO4)3 растворится основание Cu(OH)2, а в растворе FeCl3 растворится амфотерный гидроксид Al(OH)3:
Al2(SO4)3 + 2H2O <=>2AlOHSO4 + H2SO4,
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O;
FeCl3 + H2O <=>FeOHCl2 + HCl,
3HCl + Al(OH)3 = AlCl3 + 3H2O.
Учащиеся проводят эти реакции, доказывая, что их гипотеза верна: Cu(OH)2 растворяется в растворе сульфата алюминия, а Al(OH)3 растворяется в растворе хлорида железа(III).
Можно показать такой «фокус». Нерастворимое основание Fe(OH)3 взаимодействует с раствором FeCl3, осадок растворяется:
FeCl3 + H2O <=>FeOHCl2 + HCl,
Fe(OH)3 + 2HCl = FeОНCl2 + 2H2O.
(Советуем учителю заранее подобрать нужные концентрации растворов, чтобы ожидаемые эффекты реакций, которые будут проводить учащиеся и сам учитель, наблюдались.)
Вывод. Если к раствору соли, подвергающейся гидролизу, добавить вещество, способное взаимодействовать с кислотами или щелочами, то это вещество взаимодействует с продуктами гидролиза – кислотами или щелочами.
Занятие № 8. Тема «Гидролиз солей»Предлагаемая форма проведения проблемного эксперимента может быть осуществлена на уроке, в классе с углубленным изучением химии или на факультативном занятии.
Работу можно провести в парах учащихся, а обсуждение ведется в форме эвристической беседы. Возможно также выполнение эксперимента в группах, с последующей защитой каждого опыта.
Цель работы: изучение совместного гидролиза солей
Реактивы и оборудование: 20%-ые растворы: карбоната натрия, нитрата бария, сульфата алюминия, хлорида бария, хлорида алюминия, сульфата меди (II), хлорида железа(III); пробирки.
Ход работы: Учащиеся получают задание – выполнить 5 опытов.
Опыт 1. К раствору карбоната натрия добавить раствор нитрата бария. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 2. К раствору сульфата алюминия добавить раствор хлорида бария. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 3. К раствору карбоната натрия добавить раствор хлорида алюминия. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 4. К раствору сульфата меди (II) добавить раствор карбоната натрия. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 5. К раствору хлорида железа (III) добавить раствор карбоната натрия. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Обсуждение результатов эксперимента
Опыты 1 и 2. Первые два опыта не вызывают у детей удивления, это обычные обменные реакции. Учащиеся фиксируют выпадение осадков, записывают уравнения реакций в молекулярной, полной и сокращенной ионных формах.
Опыт 3. Смешав растворы хлорида алюминия и карбоната натрия, учащиеся наблюдают выделение газа и выпадение осадка. Если предположить, что идет реакция обмена, то газа быть не должно. Внесение в реакционный сосуд горящей лучины и ее угасание служит доказательством того, что образуется углекислый газ. Учащиеся полагают, что выпадающий осадок – карбонат алюминия. Чтобы определить состав осадка, они добавляют к промытому от исходного карбоната натрия осадку соляную кислоту. Газ при этом не образуется, осадок же растворяется. Если к осадку добавить раствор щелочи, то осадок тоже растворяется. Следовательно, осадок – гидроксид алюминия. В ходе дискуссии учащиеся приходят к объяснению этого процесса. Хлорид алюминия гидролизуется по катиону:
Al3+ +H2O <=>AlOH2+ + H+,(1)
AlOH2+ + H2O <=>Al(OH)2+ + H+.
Карбонат натрия гидролизуется по аниону:
CO32– + H2O <=>HCO3– + OH–.(2)
Ионы H+ и OH– связываются в молекулы воды, их концентрация понижается, равновесие реакций гидролиза (1) и (2) смещается в сторону продуктов реакций. Идут и последние ступени реакций гидролиза:
Al(OH)2+ + H2O <=>Al(OH)3↓ + H+,
HCO3– + H2O <=>OH– + H2CO3 (H2O+ CO2![]() ).
).
Суммарное уравнение реакции совместного гидролиза имеет вид:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2![]() + 6NaCl.
+ 6NaCl.
Опыт 4. Учащиеся приливают раствор карбоната натрия к раствору сульфата меди(II). После проведения опыта 3 их уже не удивляет выделение газа, не поддерживающего горение. Они предполагают, что осадок – CuCO3 или Сu(OH)2. В таблице растворимости кислот, солей и оснований в воде указано, что соединение CuCO3 в водном растворе не существует. Учащиеся делают вывод, что осадок – это гидроксид меди(II). Смущает только цвет осадка – бирюзовый. Учитель просит получить гидроксид меди(II) взаимодействием сульфата меди(II) и гидроксида натрия. Выпавший осадок имеет голубой цвет. Учащиеся предполагают, что осадок, полученный при взаимодействии растворов CuSO4 и Na2CO3, это основная соль (СuOH)2CO3. Однако учитель может показать образец гидроксокарбоната меди(II), который имеет зеленый цвет. Учащиеся делают вывод, что осадок, полученный при взаимодействии CuSO4 и Na2CO3, – это смесь голубого Сu(OH)2 и зеленого (СuOH)2CO3. Процесс можно описать следующими уравнениями реакций:
2CuSO4 + 2Na2CO3 + H2O = (СuOH)2CO3 + CO2![]() + 2Na2SO4,
+ 2Na2SO4,
CuSO4 + Na2CO3 + H2O = Сu(OH)2 ↓+ CO2![]() + Na2SO4.
+ Na2SO4.
Опыт 5. В реакции солей FeCl3 и Na2CO3 учащиеся наблюдают выпадение бурого осадка и выделение газа, не поддерживающего горение. Довольно быстро они делают вывод, что совместный гидролиз хлорида железа, гидролизующегося по катиону, и карбоната натрия, гидролизующегося по аниону, приводит к гидроксиду железа(III) и оксиду углерода(IV). Эти вещества являются продуктами последних ступеней гидролиза исходных солей:
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2![]() + 6NaCl,
+ 6NaCl,
2Fe3+ + 3CO32– + 3H2O = 2Fe(OH)3↓ + 3CO2![]() .
.
Занятие № 9. Амфотерные соединения
Приведённые ниже опыты проводились при объяснении нового материала в изучении темы «Амфотерные оксиды и гидроксиды» у учеников 9-х классов (см. тематическое планирование для 9 класса, урок 3). Использовался теоретический материал учебника 9 класса О. С. Габриеляна Химия-9 [10], методическое пособие для учителя [9], настольная книга для учителя [6], рабочая тетрадь [11].
Цель работы: используя проблемный эксперимент, дать понятие об амфотерности оксидов и гидроксидов металлов и особенностях их химических свойств.
Форма проведения эксперимента: фронтальная (демонстрационный эксперимент)
Оборудование и реактивы:
Ход работы:
Проведение работы начинают с эвристической беседы.
Учитель: приведите классификацию простых веществ, оксидов, гидроксидов.
Ученик: простые вещества: металлы и неметаллы; оксиды: оксиды неметаллов (кислотные) и оксиды металлов (основные); гидроксиды: гидроксиды металлов и кислородсодержащие кислоты (гидроксиды неметаллов).
Учитель: предложите соответствующие друг другу химические формулы представителей простых веществ, оксидов и гидроксидов (для дальнейшего обсуждения учитель выбирает те соединения, которые необходимы ему для работы)
Ученик: простые вещества: металлы – Na, Ca, Zn, Fe, Al, Cr; неметаллы: S, O2, N2, Cl2; оксиды: основные – Na2О, CaО, ZnО, FeО, Fe2О3, Al2О3, Cr2О3, CrО; кислотые – SО3, SО2, N2О5, Cl2О7; гидроксиды: металлов – NaОН, Ca(ОН)2, Zn(ОН)2, Fe(ОН)2, Fe(ОН)3, Al(ОН)3, Cr(ОН)2, Cr(ОН)3 ; неметаллов – Н2SО4, Н2SО3, НNО3, НClО4, HCl.
Учитель: составьте возможные уравнения реакций между веществами: Ca, Zn, Al; CaО, ZnО, Al2О3; SО3; Ca(ОН)2, Zn(ОН)2, Al(ОН)3, Н2SО4
Ученик: Са + SО3→ ; Са + Н2SО4→ ; Zn + SО3→ ; Zn + Н2SО4→ ; Al + SО3→ ; Al + Н2SО4→ ; и т.д.
Учитель: учитель все предложенные вами реакции вписываются в правило, что вещества металлической природы реагируют с веществами неметаллической природы. Получим некоторые из этих гидроксидов и подтвердим это утверждение реакциями с мерной кислотой.
Опыт 1. Получение гидроксида кальция и опыты с ним
Учитель получает гидроксид кальция взаимодействием хлорид кальция, приливая по каплям гидроксид натрия, обращая внимание при этом, что избыток щёлочи приводит к увеличению объёма осадка. Затем проводит реакцию полученного осадка с раствором серной кислоты. Учащиеся записывают уравнения.
Ученик:
СaCl2 + 2NaOH → Ca(ОН)2 ↓+ 2NaCl;
Ca(ОН)2 ↓+ Н2SО4 → CaSО4 + 2Н2О;
Ca(ОН)2 ↓+ NaOH ≠
Опыт 2. Получение гидроксида цинка и гидроксида алюминия и опыты с ними
Учитель получает гидроксид цинка взаимодействием хлорид цинка, приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок, затем учитель целенаправленно приливает избыток щелочи.
Ученик: осадок растворился. Уравнение реакции получения гидроксида цинка:
ZnCl2 + 2NaOH → Zn(ОН)2 ↓+ 2NaCl;
Учитель: проведём реакцию получения гидроксида алюминия: учитель получает гидроксид алюминия взаимодействием хлорид алюминия, приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок.
Ученик: предлагает приливать щёлочь осторожно, чтобы провести реакцию с серной кислотой, подтвердив их предположение. Составляет уравнение реакции получения гидроксида алюминия: AlCl3 + 3NaOH → Al(ОН)3 ↓+ 3NaCl
Учитель: во время из беседы приливает избыток щелочи, что опять приводит к растворению осадка гидроксида алюминия.
О чём говорит признак растворение осадка в других ранее изученных процессах?
Ученик: следовательно, происходит химическая реакция
Учитель: добавление какого вещества приводит к растворению осадка гидроксидов цинка и алюминия
Ученик: гидроксида натрия
Учитель: ранее мы не встречались с подобными реакциями при которых гидроксид металла реагирует с гидроксидом другого металла. Составим уравнение реакции, с получением комплексной соли (дать только понятие о комплексных солях):
Zn(ОН)2 ↓+ 2NaOH → Na2[Zn(ОН)4] (раствор)
Al(ОН)3 ↓+ NaOH → Na[Al(ОН)4] (раствор)
Учитель: постараемся получить эти гидроксиды аккуратно, по каплям добавляя гидроксид натрия. Мы ещё не подтвердили ранее изученное свойство: способность гидроксидов металлов реагировать с кислотами. Вероятно, что если гидроксиды цинка и алюминия способны реагировать со щелочами, то они не реагируют с кислотами?
Учитель проводит реакцию гидроксидов цинка и алюминия с серной кислотой.
Ученик: осадки растворились.
Zn(ОН)2 ↓+ Н2SО4 → ZnSО4 + 2Н2О;
2Al(ОН)3 ↓+ 3Н2SО4 → Al2(SО4)3 + 6Н2О
Учитель: такая способность гидрокисидов цинка и алюминия взаимодействовать и с растворами кислот и с растворами щелочей, характерна и для их оксидов и алюминия и цинка – простых веществ. Это свойство – амфотерность. Записывают определение в тетрадь.
Учитель: проанализируем результаты других опытов:
Опыт 3. Получение гидроксида хрома (II) и (III) и изучение их свойств
Учитель получает гидроксид хрома (II) взаимодействием хлорида хрома (II), приливая по каплям гидроксид натрия, обращая внимание при этом, что избыток щёлочи приводит к увеличению объёма осадка. Затем проводит реакцию полученного осадка с раствором серной кислоты. Учащиеся записывают уравнения.
Ученик:
CrCl2 + 2NaOH → Cr(ОН)2 ↓+ 2NaCl;
Cr(ОН)2 ↓+ Н2SО4 → CrSО4 + 2Н2О;
Cr(ОН)2 ↓+ NaOH ≠
Учитель получает гидроксид хрома (III) взаимодействием хлорида хрома (III) и по каплям приливаемого гидроксида натрия. Учитель обращает внимание на получаемый осадок, затем учитель пробует прилить избыток щелочи.
Ученик: осадок растворился. Уравнение реакции получения гидроксида хрома (III):
CrCl3 + 3NaOH → Cr(ОН)3 ↓+ 3NaCl;
Учитель: таким образом, гидроксид хрома (II) ведёт себя в растворе так же как гидроксиды щелочных и щелочноземельных металлов, т.е. обладает основными свойствами. А гидроксид хрома (III) проявляет амфотерные свойства.
Сr(ОН)3 ↓+ 3NaOH → Na3[Cr(ОН)6] (раствор)
Опыт 4. Получение гидроксида железа (II) и (III) и изучение их свойств
Учитель получает гидроксид железа (II) взаимодействием хлорид железа (II), приливая по каплям гидроксид натрия, обращая при этом внимание, что избыток щёлочи приводит к увеличению объёма осадка. Затем проводит реакцию полученного осадка с раствором серной кислоты. Учащиеся записывают уравнения.
Ученик:
FeCl2 + 2NaOH → Fe(ОН)2 ↓+ 2NaCl;
Fe(ОН)2 ↓+ Н2SО4 → FeSО4 + 2Н2О;
Fe(ОН)2 ↓+ NaOH ≠
Учитель получает гидроксид железа (III) взаимодействием хлорид железа (III), приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок, затем учитель целенаправленно приливает избыток щелочи.
Ученик: осадок не растворился. Вероятно и гидроксид железа (II) и гидроксид железа (III) проявляют основные свойства. Уравнение реакции получения гидроксида цинка:
FeCl3 + 3NaOH → Fe(ОН)3 ↓+ 3NaCl;
Учитель: проверим ваше предположение, несколько изменив условия реакции: прильём к свежеприготовленному гидроксиду железа (III) горячей концентрированной щелочи.
Ученик: осадок растворяется
Учитель: таким образом, гидроксид железа (III) так же амфотерен, но проявляет это свойство при более жёстких условиях.
Таким образом, к соединениям, проявляющим амфотерные свойства относятся: цинк, оксид цинка, гидроксид цинка, алюминий, оксид алюминия, гидроксид алюминия, оксид и гидроксид хрома (III), оксид и гидроксид железа (III). Кроме того, амфотерными являются оксид и гидроксид олова (II) и оксид и гидроксид свинца (II).
Каково место положения всех названных элементов в таблице и к каким элементам (s, p, d, f) они относятся. Оформим в виде таблицы:
| Элемент | Вид элемента | Степень окисления | Амфотерность | Вывод |
| Zn | d-элемент | Высшая | + | Амфотерными свойствами обладают p- и d-элементы. При непостоянных степенях окисления амфотерными являются соединения с промежуточной степенью окисления |
| Al | p-элемент | Постоянная | + | |
| Сr (III) | d-элемент | Промежуточная | + | |
| Fe (III) | d-элемент | Промежуточная | + | |
| Sn (II) | p-элемент | Промежуточная | + | |
| Pb (II) | p-элемент | Промежуточная | + |
Глава 4. Исследование эффективности методической системы проблемного подхода к обучению химии с применением школьного химического эксперимента
Апробация материалов экспериментов, созданных для использования в системе проблемного обучения, проводилась на базе МОУ Лицей информационных систем и технологий № 73 г. Пензы.
Исследование эффективности методической системы проблемного подхода к обучению химии, с применением школьного химического эксперимента, проводилось нами в урочной деятельности с учащимися 9 и 10 классов при изучении тем «Скорость химических реакций» и «Гидролиз солей», соответственно.
Апробацию нашего эксперимента начинали с формирования двух групп учащихся, с исходно одинаковым уровнем подготовки по химии.
Схема эксперимента приведена на рис. 2.
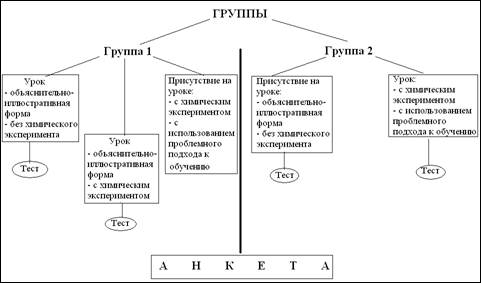
Рис. 2. Схема эксперимента
Конспект урока по теме «Гидролиз солей» для учащихся, обучавшихся с применением объяснительно-иллюстративной формы обучения представлен в приложении 4. После проведения урока по теме «Гидролиз солей» с применением объяснительно-иллюстративной формы обучения и без химического эксперимента у учащихся группы 1 и 2, нами было проведено тестирование (Приложение 5).
Анализ проведённого тестирования показал, что показатель «Степени обученности» в группе 1 и 2 на момент начала эксперимента составил 43 %, что соответствует второй (низкой) степени обученности (по В. П. Симонову) [41].
После проведения урока по теме «Гидролиз солей» с применением объяснительно-иллюстративной формы обучения и с химическим экспериментом у учащихся группы 1, нами вновь было проведено тестирование (Приложение 5).
Анализ проведённого тестирования показал, что показатель «Степени обученности» в группе 1 составил 60 %, что соответствует третьей (средней) степени обученности (по В. П. Симонову) [41].
Конспект урока по теме «Гидролиз солей» для учащихся группы 2 приведён в Главе 3, занятие № 6. Для того, чтобы эксперимент в системе проблемного обучения не приобрел развлекательный характер, учащимся с самого начала должна быть ясна цель проводимых опытов. Наш небольшой опыт показал, что учащиеся глубоко вникают в сущность проводимых опытов, задумываются над их результатами и пытаются ответить на вопросы только в том случае, если эксперимент поражает воображение и сильно влияет на эмоциональную сферу.
После проведения урока по теме «Гидролиз солей» в группе 2 с применением химического эксперимента и проблемного подхода к обучению, нами было проведено тестирование (Приложение 6).
Анализ проведённого тестирования показал, что показатель «Степени обученности» в группе 2 составил 94 %, что соответствует четвёртой (высокой) степени обученности (по В. П. Симонову) [41].
Таким образом, полученные в результате нашего исследования данные, показывают, что проблемное обучение при демонстрации опытов, способствует повышению эффективности обучения химии. Подобные опыты являются благодатной почвой для формирования диалектического и системного мышления учащихся. А включение таких опытов в процесс обучения позволяет учащимся овладевать логическими методами познания.
В дальнейшем у учащихся группы 1 и 2 нами было проведено анкетирование (Приложение 7) с целью исследования образовательного потенциала эксперимента – как средства позволяющего реализовать проблемный подход к обучению.
Анализ проведённого анкетирования показал, что все анкетируемые учащиеся проявили заинтересованность к проблемному моделированию ситуации при воспроизведении химических опытов. Большинство их опрашиваемых, при этом, отметили, что эта заинтересованность обусловлена предоставляемой возможностью логически и самостоятельно (в результате беседы) выявить и сформулировать правила и закономерностей химических явлений (процессов).
Все анкетируемые отметили, что они не испытывали сложности при восприятии нового материала, преподаваемого в системе проблемного обучения и хотели, чтобы подобные уроки чаще использовались при объяснении нового материала. Не исключено, что это связано с тем, что именно такая постановка эксперимента позволяет учащимся ощущать себя в роли исследователей-первооткрывателей.
Выводы
1. Проведён анализ психолого-педагогической, методической и химической литературы для определения современного состояния проблемы применения эксперимента в системе проблемного обучения.
2. Разработано содержание двадцати опытов по общей и неорганической химии для использования в системе проблемного обучения.
3. Разработаны методические рекомендации к опытам для учителя, использующего в своей работе проблемный подход к обучению.
4. Для исследования эффективности проблемного обучения при демонстрации опытов, в группах учащихся применяли метод педагогического тестирования учебных достижений по химии, с последующей его оценкой с помощью критерия «Степень обученности» (по В. П. Симонову).
5. «Степень обученности» в группах учащихся‚ обучавшихся по объяснительно-иллюстративной системе без применения химического эксперимента (группа 1 и 2), по объяснительно-иллюстративной системе с применением химического эксперимента (группа 1), в системе проблемного обучения при демонстрации химического эксперимента составила 43 % (низкий уровень), 60 % (средний уровень) и 94 % (высокий уровень), соответственно.
6. Для исследования образовательного потенциала эксперимента, как средства позволяющего реализовать проблемный подход к обучению, в группах учащихся применяли метод выборочного‚ группового‚ очного анкетирования.
7. Апробация материалов экспериментов проведена на уроках у учащихся 9 и 10 классов МОУ Лицей информационных систем и технологий № 73 г. Пензы.
Заключение
Проведённое нами исследование показало, что проблемное обучение при демонстрации опытов позволят ученикам активно применять полученные ранее знания и умения, помогает повысить уровень знаний, глубину понимания химических явлений, а также даёт возможность приобрести опыт конкретного решения проблемных и творческих заданий. Многие исследователи отмечают, что применение проблемного обучения при демонстрации опытов помогает преодолеть некоторые «издержки» использования концентрического принципа в обучении. Кроме того, такой эксперимент дает возможность не только устанавливать новые факты, но также исправлять ошибки в знаниях учащихся.
список Литературы
1. Баксанский О. Е. Проблемное обучение: обоснование и реализация // Наука и школа. – 2000. – № 1. – С. 19-25.
2. Брушлинский А.В. Психология мышления и проблемное обучение.- М., 1983 г.- 350 с.
3. Бурнашев С.И. Исследовательский метод // Биология (приложение к Первому сентября) 2002 г., № с.27-28
4. Выготский Л.С. Собрание сочинений в 6 томах. Т. 2- М.,- 1982г.- С.437
5. Габриелян О.С. Настольная книга для учителя. 8 класс. М., Дрофа, 2002. 65с.
6. Габриелян О. С.‚ Остроумов Г. Химия 9 класс: Настольная книга учителя. М.: Дрофа. 2003. – 400с.
7. Габриелян О. С. и др. Рабочая тетрадь. 8 класс. М., Дрофа, 2001-2002.
8. Габриелян О.С. Химия. 8 класс: Учебник. М., Дрофа, 2001.146с.
9. Габриелян О.С. Химия. 8-9 класс: Методическое пособие. М., Дрофа 1999-2001. 44-52с.
10. Габриелян О. С. и др. Химия. 9 класс: Учебник для общеобразовательных учеждений. М.: Дрофа,2003. – 224с.
11. Давыдов В.В. Проблемы развивающего обучения: Опыт теоретического, экспериментального психологического исследования. — М.: Педагогика 1986.-С. 165.
12. Дружинин В. Н. Экспериментальная психология. СПб.: Питер, 2002. 45 с
13. Дьюи Дж. Психология и педагогика мышления - Берлин., 1922 г.с. 345.
14. Зайцев О.С. Методика обучения химии. Химия в школе, 1990, № 3, с. 39–40
15. Ильницкая И.А. Проблемные ситуации.- М.,- 1985- с.356
16. Ингенкамп К. Педагогическая диагностика М.: «Педагогика» 1991г. 239 с.
17. Исследования познавательной деятельности/ Дж. Брунер, Р. Оливер, П. Гринфилд.- М., 1971 г.-с. 365
18. Кобардин О.Ф., Земляков А.Н., Тестирование знаний и умений учащихся// Советская педагогика. 1991. №12. С. 26-33.
19. Крайг Г. Психология развития.- Спб., 2000 г.- с. 560
20. Кудрявцев В.Т. Проблемное обучение: истоки, сущность, перспективы // Педагогика и психология. 1991 г.,- № 4- с. 201
21. Кудрявцев Т.В. Проблемное обучение - понятие и содержание // Вестник высшей школы.- 1984 г.- № 4-с. 24-32
22. Кудрявцев Т.В. Психология технического мышления.- М., 1975 г.-с.370
23. Левитес Д. Г. Практика обучения: современные образовательные технологии // п/р Давыденко – Мурманск.- 1997 г.- 221с.
24. Лернер И. Л. Проблемное обучение.- М., 1974 г.- с.267
25. Леонтьев А.Н. Деятельность, сознание, личность. — М.: Политиздат, 1975. - с.304.
26. Матюшкин А.М. Проблемные ситуации в мышлении и обучении. М., 1972 г.-с.325
27. Махмутов М.И. Организация проблемного обучения в школе., М., 1977 г.- с.374
28. Махмутов М.И. Теория и практика проблемного обучения. Казань, 1972 г.- с.365
29. Мельникова Е. Л. Проблемное обучение // Первое сентября- №2- 2002 г.- с.2
30. Мельникова Е. Л. Проблемный урок в начальной школе, или как открывать знания вместе с детьми// Начальная школа – плюс-минус.- 1999 г.., № 5., с. 31-37.
31. Мельникова Е.Л. Технология проблемного обучения// Школа 2100. образовательная программа. № 3. М., 1999 с. 85- 93.
32. Мочалова Н.М. Методы проблемного обучения и границы их применимости.- Казань., 1979 г.-с.385
33. Мутик М.А. Организация учебно-исследовательской деятельности учащихся.//Биология.- № 40- 2002 г.-с.7.
34. Ожегов С. И. Словарь русского языка. Советская энциклопедия. М.: 1964. – С. 595
35. Оконь В. Введение в общую дидактику.- М.,1990 г.-с.246
36. Петрушин О.В. Методы проблемного обучения на уроках биологии //Образование в современной школе. 2003 г.-№ 6-с.9-11.
37. Поддубный А.В. Еще раз о проблемном обучении// Биология в школе.- 1997 г.- № 5.-с.31-34.
38. Программа курса химии для 8-11 классов общеобразовательных учреждений. Дрофа, 2000-2002
39. Рубинштейн С.Л. О мышлении и путях его исследования-М.,1958.
40. Рубинштейн С.Л. Основы общей психологии. М.,1988 г.-с.450
41. Симонов В. П. Диагностика степени обученности учащихся: учебно-справочное пособие // Моск. пед. ун-т. фак. повышения квалификации преподавателей вузов. М.‚ 1999. 45 c.
42. Сурин Ю.В., Балезина С.С. Проблемный эксперимент при изучении гидролиза солей в ХI классе.
Приложение 1
Примерное календарно-тематическое планирование учебного материала по химии в 9 классах при 2-х уроках в неделю (по учебнику химии автора Габриеляна О.С.) (всего 68 часов) [6, 9, 10, 38]
| № урока | Содержание учебного материала |
| 1-2 | Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева |
| 3 | Амфотерные оксиды и гидроксиды |
| 4 | Периодический закон и система элементов Д.И.Менделеева |
| Тема 1.Скорость химических реакций. Химическое равновесие (6ч) по учебнику 8 класса | |
| 5 | Скорость химических реакций |
| 6 | Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры |
| 7 | Катализ и катализатор |
| 8 | Обратимые и необратимые реакции |
| 9 | Химическое равновесие и способы его смещения |
| 10 | Обобщение и систематизация знаний по теме |
| Тема 2 . Металлы (15 ч) | |
| 11 | Положение элементов металлов в Периодической системе Д.И.Менделеева и особенности строения их атомов Физические свойства металлов |
| 12 | Химические свойства металлов |
| 13 | Общие понятия о коррозии металлов |
| 14 | Сплавы |
| 15 | Металлы в природе. Общие способы их получения |
| 16 | Общая характеристика элементов главной подгруппы I группы |
| 17 | Соединения щелочных металлов |
| 18 | Общая характеристика элементов главной подгруппы II группы |
| 19 | Соединения щелочноземельных металлов |
| 20 | Алюминий, его физические и химические свойства |
| 21 | Соединения алюминия |
| 22 | Железо, его физические и химические свойства |
| 23 | Генетические ряды Fe2+ и Fe3+ |
| 24 | Обобщение по теме «Металлы» |
| 25 | Контрольная работа по теме «Металлы» |
| Тема 3 . Неметаллы (20ч.) | |
| 26 | Общая характеристика неметаллов |
| 27 | Общая характеристика галогенов |
| 28 | Соединения галогенов |
| 29 | Сера, ее физические и химические свойства |
| 30 | Оксиды серы (IV) и (VI) |
| 31 | Серная кислота и ее соли |
| 32 | Азот и его свойства |
| 33 | Аммиак и его свойства |
| 34 | Соли аммония |
| 35 | Азотная кислота и ее свойства |
| 36 | Соли азотистой и азотной кислот. Азотные удобрения |
| 37 | Фосфор |
| 38 | Соединения фосфора |
| 39 | Углерод |
| 40 | Оксиды углерода(II) и (IV) |
| 41 | Карбонаты |
| 42 | Кремний |
| 43 | Силикатная промышленность |
| 44 | Обобщение по теме «Неметаллы» |
| 45 | Контрольная работа по теме «Неметаллы» |
| Тема 4. Практикум по неорганической химии (5 ч) | |
| 46 | Получение амфотерного гидроксида и изучение его свойств |
| 47 | Получение аммиака и исследование |
| 48-49 | Решение экспериментальных задач на распознавание важнейших катионов и анионов |
| 50 | Решение экспериментальных задач на распознавание важнейших катионов и анионов |
| Тема 5 . Органические вещества (12ч.) | |
| 51 | Предмет органической химии. Строение атома углерода |
| 52 | Алканы. Химические свойства и применение алканов |
| 53 | Алкены. Химические свойства этилена |
| 54 | Понятие о спиртах на основе реакции гидратации этилена и взаимодействия этилена с раствором перманганата калия |
| 55 | Окисление альдегида в кислоту и понятие об одноосновных карбоновых кислотах |
| 56 | Понятие о сложных эфирах. Жиры |
| 57 | Понятие об аминокислотах |
| 58 | Реакция поликонденсации аминокислот. Белки |
| 59 | Углеводы |
| 60 | Полимеры |
| 61 | Обобщение знаний учащихся по органической химии |
| 62 | Решение экспериментальных задач на распознавание органических веществ с использованием качественных реакций на альдегиды, многоатомные спирты, крахмал и непредельные соединения |
| Тема 7. Обобщение знаний по химии за курс основной школы (6ч.) | |
| 63 | Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома |
| 64 | Строение вещества (виды химических связей и типы кристаллических решеток) |
| 65 | Химические реакции |
| 66 | Классы химических соединений в свете ТЭД. |
| 67 | Контрольная работа по теме «Органические вещества» и «Обобщение знаний по химии за курс основной школы» |
| 68 | Подведение итогов |
Приложение 2
Примерное календарно-тематическое планирование учебного материала по химии в 8классах при 2 – х уроках в неделю (по учебнику химии автора Габриеляна О.С.) (всего 68 часов)
| № урока | Содержание учебного материала |
| 1 | Предмет химии. Вещества. |
| 2 | Превращение веществ. Роль химии в жизни человека. Краткие сведения по истории химии. Основоположники отечественной химии. |
| 3 | Знаки (символы) химических элементов. Периодическая таблица химических элементов Д.И. Менделеева |
| 4 | Химические формулы. Относительная атомная и молекулярная массы |
Тема 1. Атомы химических элементов (10 часов)
| 1 | Основные сведения о строении атомов. Состав атомных ядер: протоны, нейтроны |
| 2 | Изменение числа протонов в ядре – образование новых химических элементов. Изменение числа нейтронов в ядре – образование изотопов |
| 3 | Электроны. Строение электронных оболочек атомов элементов №1 – 20 |
| 4 | Периодическая таблица химических элементов Д.И. Менделеева и строение атомов. |
| 5 | Изменение числа электронов на внешнем электронном уровне атома химического элемента – образование положительных и отрицательных ионов. Ионная химическая связь. |
| 6 | Взаимодействие атомов элементов неметаллов между собой – образование молекул простых веществ. Ковалентная неполярная связь. |
| 7 | Взаимодействие атомов элементов– неметаллов между собой – образование молекул соединений Электроотрицательность (ЭО). Ковалентная полярная химическая связь |
| 8 | Взаимодействие атомов элементов-металлов между собой – образование металлических кристаллов |
| 9 | Обобщение и систематизация знаний об элементах: металлах и неметаллах, о видах химической связи |
| 10 | Контрольная работа №1 |
Тема 2. Простые вещества (7 часов)
| 1 | Простые вещества – металлы. Общие физические свойства металлов. Аллотропия |
| 2 | Простые вещества – неметаллы. Физические свойства неметаллов – простых веществ |
| 3 | Количество вещества |
| 4 | Молярная масса вещества |
| 5 | Молярный объем газообразных веществ |
| 6 | Урок- упражнение |
| 7 | Обобщение и систематизация знаний по теме |
Тема 3.Соединения химических элементов (13 часов)
| 1 | Степень окисления. Бинарные соединения металлов и неметаллов: оксиды, хлориды, сульфиды и др. |
| 2 | Важнейшие классы бинарных соединений - оксиды, летучие водородные соединения |
| 3 | Основания |
| 4 | Кислоты |
| 5 – 6 | Соли как производные кислот и оснований. |
| 7 | Урок – упражнение |
| 8 | Аморфные и кристаллические вещества. Межмолекулярные взаимодействия. Молекулярные кристаллические решетки. Ионные, атомные и металлические решетки |
| 9 | Чистые вещества и смеси |
| 10 | Массовая и объемная доля компонентов смеси, в том числе и доля примесей |
| 11-12 | Расчеты, связанные с понятием «доля» |
| 13 | Контрольная работа №2 |
Тема 4. Изменения, происходящие с веществами (10 часов)
| 1 | Физические явления |
| 2 | Химические реакции. Закон сохранения массы вещества |
| 3 | Химические уравнения. Реакции разложения |
| 4 | Реакции соединения |
| 5 | Реакции замещения |
| 6 | Реакции обмена |
| 7 – 8 | Расчёты по химическим уравнениям |
| 9 | Обобщение и систематизация знаний по теме |
| 10 | Контрольная работа №3 |
Тема 5. Простейшие операции с веществами. Химический практикум (6 часов)
| 1 | Правила по технике безопасности при работе в химическом кабинете. Приёмы обращения с нагревательными приборами и лабораторным оборудованием |
| 2 | Признаки химических реакций. Наблюдения за изменениями, происходящими с горящей свечой, и их описание |
| 3 | Анализ почвы и воды |
| 4 | Получение водорода и изучение его свойств |
| 5 | Получение кислорода и изучение его свойств |
| 6 | Приготовление раствора сахара и определение массовой доли сахара в растворе |
Тема 7. Растворение. Растворы. Свойства растворов электролитов (18 часов)
| 1 | Растворение как физико-химический процесс. Растворимость. Типы растворов |
| 2 | Электролитическая диссоциация |
| 3 | Основные положения теории электролитической диссоциации |
| 4 | Ионные уравнения реакций |
| 5 – 6 | Кислоты в свете ТЭД, и их классификация и свойства |
| 7 | Основания в свете ТЭД, их классификация и свойства. |
| 8 | Оксиды |
| 9 | Соли в свете ТЭД и их свойства |
| 10 | Генетическая связь между классами неорганических веществ |
| 11 | Обобщение и систематизация знаний по теме Контрольная работа №4 . |
| 13 | Классификация химических реакций. Окислительно-восстановительные реакции. |
| 14 | Упражнения в составлении окислительно –восстановительных реакций . |
| 15 | Свойства изученных классов веществ в свете окислительно-восстановительных реакций |
| 16 | Обобщение и систематизация знаний по теме |
| 17 | Практическая работа «Решение экспериментальных задач на распознавание катионов и анионов» |
| 18 | Контрольная работа №5. |
Приложение 3
Примерное календарно-тематическое планирование учебного материала по химии в 11 классах при 2 – х уроках в неделю (по учебнику химии автора Габриеляна О.С.) (всего 68 часов) [5, 7, 8, 9, 38]
| Содержание учебного материала | |
| Тема №1 Строение атома | |
| 1. | Основные сведения о строении атома. |
| 2. | Электронная оболочка. Особенности строения электронных оболочек переходных элементов. |
| 3. | Периодический закон и периодическая система химических элементов Д.И.Менделеева. |
| 4. | Значение периодического закона Д.И. Менделеева. |
| 5. | Виды химической связи. Ионная связь. |
| 6. | Ковалентная полярная и неполярная химическая связь. |
| 7. | Металлическая связь. |
| 8. | Водородная химическая связь. |
| 9. | Повторение и обобщение знаний по теме «Строение атома. Химическая связь» |
| 10. | Контрольная работа №1 по теме «Строение атома» |
| Тема №2 Строение вещества и их свойства | |
| 11. | Полимеры. |
| 12. | Органические полимеры. Волокна. |
| 13. | Органические полимеры. Волокна. |
| 14. | Неорганические полимеры. |
| 15. | Вещества молекулярного строения. Газообразные вещества. |
| 16. | Жидкие вещества. |
| 17. | Твердые вещества. |
| 18. | Чистые вещества и смеси. |
| 19. | Дисперсные системы. |
| 20. | Состав смесей. Разделение смесей. |
| 21. | Истинные растворы. Способы выражения концентрации. |
| 22. 23. 24. 25. | Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. |
| 26. | Урок-зачет «Решение задач» |
| 27. | Классификация химических реакций. Реакции, которые идут без изменения состава. |
| 28. | Классификация химических реакций, которые идут с изменением состава вещества. |
| 29. | Тепловой эффект химической реакции. |
| 30. | Скорость химической реакции. |
| 31. | Обратимость химических реакций. Химическое равновесие. |
| 32. | Условия смещения химического равновесия. |
| 33. | Электролитическая диссоциация. |
| 34. | Реакции ионного обмена. |
| 35. | Гидролиз. Гидролиз неорганических веществ. |
| 36. | Гидролиз органических веществ. |
| 37. | Среда водных растворов. Водородный показатель. |
| 38. 39. | Окислительно-восстановительные реакции. |
| 40. 41. | Электролиз. |
| 42. | Обобщение знаний по теме «Строение вещества и их свойства» |
| 43. | Контрольная работа №2 по теме «Строение вещества и их свойства» |
| Тема №3 Вещества и их свойства | |
| 44. | Металлы и их свойства. |
| 45. | Металлотермия. Коррозия металлов |
| 46. | Общие способы получения металлов |
| 48 | Общая характеристика инертных газов. |
| 49 | Общая характеристика галогенов. |
| 50 | Классификация неорганических и органических веществ. |
| 51 | Оксиды. |
| 52 | Кислоты. Химические свойства кислот. Неорганические и органические кислоты. |
| 53. | Особые свойства серной кислоты. |
| 54. | Особые свойства азотной кислоты. |
| 55. | Основания. |
| 56. | Соли. |
| 57. | Химические свойства солей. |
| 58. | Генетическая связь между классами неорганических соединений |
| 59. | Генетическая связь между классами органических соединений |
| 60. | Повторение и обобщение темы «Вещества и их свойства» |
| 61. | Урок-зачет по теме «Вещества и их свойства». |
| 62. | Контрольная работа №3 по теме «Вещества и их свойства» |
| 63. | Практическая работа №1 |
| 64. | Практическая работа №2 |
| 65. | Химия в жизни общества (урок- конференция) · Химия и промышленность · Химия и сельское хозяйство · Химия и экология · Химия и повседневна жизнь человека |
| Резерв | |
| 66. 67. 68 | Решение задач и упражнений |
| Общее число по курсу | |
| Демонстрации | |
| Лабораторные опыты | |
| Практические работы | |
| Контрольные работы | |
Приложение 4
Конспект урока по теме «Гидролиз солей»
Метод: объяснительно-иллюстративный
| Учитель Ученик Учитель Запись на доске Запись в тетради Запись в тетради Вопрос Ученик Учитель Закрепление | Водные растворы солей имеют разные значения pH и показывают различную реакцию среды- кислую, щелочную и нейтральную. Например: водный раствор AlCl3 (pH<7) K2CO3 (pH>7) NaCl (pH=7) Чем же можно объяснить различные среды водных растворов солей? Ведь они не содержат в своем составе ионы H+ и OH-, которые определяют среду расвора. Это объясняется тем, что в водных растворах соли подвергаются гидролизу. Слово «гидролиз» означает разложение водой. «гидро» - вода, «лизис» - разложение Гидролиз – одно из важнейших химических свойств солей. Гидролизом соли называется взаимодействие ионов соли с H2O, в результате которого образуются слабые электролиты. Гидролиз – процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h). Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул: n
N n – число молекул соли, подвергшихся гидролизу; N – общее число растворенных молекул. Степень гидролиза зависит от природы соли, концентрации раствора, температуры. При разбавлении раствора, повышении его температуры степень гидролиза увеличивается. Как можно представить любую соль? Как продукт взаимодействия кислоты с основанием. Например: NaCl образована сильной кислотой HCl и сильным основанием NaOH. В зависимости от силы исходной кислоты и исходного основания соли можно поделить на 4 типа, это соли образованные: 1. Сильным основанием + слабой кислотой (NaCN; Ba(NO2)2); 2. Сильной кислотой + слабым основанием (CuCl2; FeSO4); 3. Сильным основанием + сильной кислотой (NaCl; K2SO4); 4. Слабой кислотой + слабым основанием (CH3COONH4; NH4CN). Соли 1, 2, 4 типов подвергаются гидролизу, соли 3 типа нет. Рассмотрим примеры: 1. Сильное основание + слабая кислота (подвергается гидролизу по аниону)
HNO2 –слабая кислота
При добавлении фенолфталеина раствор окрасился в малиновый цвет. Эти соли при растворении в H2O показывают щелочную среду pH>7. 2. Сильная кислота + слабое основание (гидролиз по катиону)
HI – сильная кислота
При добавлении метилоранжа раствор окрашивается в розовый цвет; pH<7. 3. Слабая кислота + слабое основание (гидролиз по катиону и аниону)
NH4OH – слабое основание
Реакция среды нейтральная; pH=7 (используем универсальную индикаторную бумагу) 4. Сильное основание + сильная кислота Не гидролизуется; pH=7 1. Какую реакцию среды показывают водные растворы различных солей? 2. Что такое гидролиз? 3. Что называют степенью гидролиза? 4. От чего зависит степень гидролиза? 5. На какие группы можно разделить соли? |
Приложение 5
Тест № 1. Тема «Гидролиз», для учащихся обучавшихся по объяснительно-иллюстративной форме обучения
1. Какую реакцию среды показывают водные растворы различных солей?
а) кислую;
б) нейтральную;
в) щелочную.
2. Что называется гидролизом солей?
а) взаимодействие соли с H2O, с образованием слабого электролита;
б) процесс распада молекул соли на ионы;
в) процесс образования солей.
3. Что такое степень гидролиза?
а) произведение числа гидролизованных молекул соли к общему числу растворенных молекул;
б) отношение числа молекул соли к числу гидролизованных молекул;
в) отношение числа гидролизованных молекул соли к общему числу растворенных молекул.
4. От чего зависит степень гидролиза?
а) от природы соли;
б) от давления;
в) от концентрации раствора;
г) от температуры;
д) от влажности воздуха.
5. Какие соли подвергаются гидролизу?
а) образованные сильным основанием и слабой кислотой;
б) образованные сильным основанием и сильной кислотой;
в) образованные слабым основанием и сильной кислотой;
г) образованные слабым основанием и слабой кислотой.
6. Какие соли гидролизуются по аниону?
а) NaCN;
б) CuCl2;
в) (NH4) 2СО3;
г) NaCl.
7. Какие соли гидролизуются по катиону?
а) Ba(NO2)2;
б) FeSO4;
в) CH3COONH4;
г) K2SO4.
8. Какие соли гидролизуются и по катиону, и по аниону?
а) Rb2CO3;
б) Mn(NO3)2;
в) NH4CN;
г) NaCl.
9. Какие соли не подвергаются гидролизу?
а) NaCl;
б) CuCl2;
в) K2SO4;
г) Ba(NO2)2.
10.На какие 4 группы можно разделить соли? Приведите примеры солей.
Приложение 6
Тест № 2. Тема «Гидролиз» для учащихся, обучавшихся в системе проблемного обучения
1.Что называется гидролизом солей?
а) процесс распада молекул соли на ионы;
б) взаимодействие соли с H2O, с образованием слабого электролита;
в) процесс образования солей.
2. Какую реакцию среды показывают водные растворы различных солей?
а) нейтральную;
б) среднюю;
в) щелочную;
г) кислую.
3.Степень гидролиза определяется по формуле:
N
![]() а) h= *100%
а) h= *100%
n
б) n
![]() h= *100%
h= *100%
N
в) N
![]() h= *100%
h= *100%
M
4. От чего зависит степень гидролиза?
а) от концентрации раствора;
б) от влажности воздуха;
в) от природы соли;
г) от давления;
д) от температуры.
5. Какие соли подвергаются гидролизу?
а) образованные сильным основанием и сильной кислотой;
б) образованные слабым основанием и сильной кислотой;
в) образованные сильным основанием и слабой кислотой;
г) образованные слабым основанием и слабой кислотой.
6. Какие соли гидролизуются по аниону?
а) CuCl2;
б) NaCN;
в) (NH4) 2СО3;
г) NaCl.
7. Какие соли гидролизуются по катиону?
а) CH3COONH4;
б) Ba(NO2)2;
в) K2SO4;
г) FeSO4.
8. Какие соли гидролизуются и по катиону, и по аниону? Какова реакция среды?
а) Rb2CO3;
б) NH4CN;
в) Mn(NO3)2;
г) NaCl.
9. Какие соли не подвергаются гидролизу? Какова реакция среды?
а) CuCl2;
б) K2SO4;
в) NaCl;
г) Ba(NO2)2.
10. На какие 4 группы можно разделить соли? Приведите примеры солей. Напишите молекулярное, полное и сокращенное ионные уравнения реакций гидролиза этих солей.
Приложение 7
Анкета для учащихся «Эффективность проблемного обучения при демонстрации опытов»
1. Проводились ли ранее подобные (с созданием проблемных ситуаций) уроки в Вашей школе?
а) да;
б) нет.
2. Какой из предложенных нами уроков Вам был наиболее интересен?
Почему?
а) урок – объяснение нового материала без химического эксперимента;
б) урок – объяснение нового материала с химическим экспериментом
в) урок – объяснение нового материала с применением химического эксперимента и с созданием проблемной ситуации
3. Какой из предложенных уроков, по Вашему мнению, был более запоминающимся и эффективным? Почему?
а) урок – объяснение нового материала без химического эксперимента;
б) урок – объяснение нового материала с химическим экспериментом
в) урок – объяснение нового материала с применением химического эксперимента и с созданием проблемной ситуации
4. Испытывали Вы сложность в восприятии урока – объяснения нового материала с применением химического эксперимента и с созданием проблемной ситуации. Если да, то какую?
5. Испытывали Вы сложность в восприятии урока – объяснения нового материала без химического эксперимента. Если да, то какую?
6. Хотели бы Вы, чтобы уроки объяснения нового материала с применением химического эксперимента и с созданием проблемной ситуации проводились периодически на Ваших занятиях? Если да, то почему?
7. Хотели бы Вы сами участвовать в подготовке и проведении уроков объяснения нового материала с применением химического эксперимента и с созданием проблемной ситуации?
8. Нравится ли Вам химия как наука?
9. Хотели бы Вы связать свою жизнь с химией?
Благодарим за участие в исследовании!
Похожие работы
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
... вещество с запахом пота, т.пл. 31 С, т. кип. 233 С. Получают ее каталитическим гидрированием бензойной кислоты. [8] 3. ПРИМЕРЫ ПРОБЛЕМНЫХ СИТУАЦИЙ И ИХ РЕШЕНИЕ Проблемные ситуации при изучении предельных одноосновные кислоты можно рассмотреть через систему уроков по теме: «Карбоновые кислоты». УРОК 1. Карбоновые кислоты, их классификация. Краткое содержание. Строение карбоксильной группы. ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... экономики» и др. Семинар - это метод, сближающий школьные формы работы с вузовскими, и для старшеклассников он полезен [5-7]. 4. СИСТЕМА СЛОВЕСНО-НАГЛЯДНЫХ МЕТОДОВ ОБУЧЕНИЯ ХИМИИ И ИХ ВЗАИМОСВЯЗЬ СО СРЕДСТВАМИ НАГЛЯДНОСТИ Словесно-наглядные методы обучения определяют использование в учебном процессе различных средств наглядности в сочетании со словом учителя. Они непосредственно связаны со ...





0 комментариев