Навигация
Cl - - 2ê → Cl2↑ 2H2O - 4ê→O2+4H+; 4OH - - 4ê→O2+2H2O
2 Cl - - 2ê → Cl2↑ 2H2O - 4ê→O2+4H+; 4OH - - 4ê→O2+2H2O.
I - Br S2 - Cl - OH - SO42 - NO3 - F -
ослабление восстановительной способности анионов Применение электролиза: покрытие металлов; защита от коррозии; получение металлов и других соединений; очистка веществ от примесей.
4. Опираясь на правила, составим уравнение электролиза раствора иодида калия и расплава хлорида меди (II).
а) KI + H2O →
К (-): К+; H2O H2O + 2ê →H2 +2OH - восстановление А (+): I-; H2O2 I - - 2ê → I2 окисление 2KI + H2O → 2KOH + I2 + H2 ↑.
б) CuCl2 расплав→
К (-): Cu2+ Cu2+ + 2ê → Cu0 восстановление А (+): Cl- 2 Cl - - 2ê → Cl2↑ окисление CuCl2 расплав→ Cu0 + Cl2↑.
Вода не является участником процесса расплава веществ.
IV. Закрепление материала (10 мин).
Учащимся предлагается 3 карточки-задания, которые они постепенно выполняют. Те задания, которые не выполнили в классе переходят как домашнее задание. Три человека работают на оценку.
Карточка 1.
1. Составьте уравнение электролиза:
а) раствора бромида железа (II); б) расплава оксида алюминия;
в) раствора нитрата ртути.
2. Расставьте коэффициенты методом электронного баланса H2SO4 + H2S → S + H2O.
Карточка 2.
1. Составьте уравнение электролиза:
а) раствора иодида никеля (II); б) расплава хлорида натрия;
в) раствора серной кислоты.
2. Расставьте коэффициенты методом электронного баланса FeO+ HNO3(конц) =Fe(NO3) 3+NO2+ H2O.
Карточка 3.
1. Составьте уравнение электролиза:
а) раствора гидроксида меди (II); б) расплава оксида кальция;
в) раствора нитрата серебра.
2. Расставьте коэффициенты методом электронного баланса NaNO3=NaNO2+O2.
ИТОГИ УРОКА
V. Домашнее задание § 36, выполнить задание на карточках, подготовка к самостоятельной работе.
Урок №3
Тема: "Коррозия металлов".
Задачи: актуализировать, расширить и углубить знания о коррозии металлов; закрепить полученные знания и умения по всей теме.
Оборудование: карточки-задания для проверки домашнего задания, опыт (ставится за 3 дня) 5 стаканов, 5 гвоздей, растворы щелочи и поваренной соли, цинк и медная проволока, варианты самостоятельной работы.
Ход урока:
I. Организация класса.
II. Проверка домашнего задания (10 мин)
2 человека у доски выполняют задания:
1) составить схемы процессов электролиза раствора бромида меди, гидроксида калия, расплава хлорида магния.
2) составить схемы процессов электролиза раствора нитрата натрия, гидроксида цинка, расплава иодида алюминия.
Вопросы классу: 1) Что такое процесс электролиза? 2) Какие вещества являются участниками этого процесса, почему? 3) Какое промышленное значение имеет данный процесс? 4) Что такое активный и инертный электроды?
III. Изучение нового материла (15 мин)
Демонстрация опыта (приготовлен за 3 дня).
В 5 стаканах находятся гвозди, но погруженные в различные среды: 1 – вода, 2 – в растворе NaCl, 3 – в растворе NaOH, 4 – в воде, но гвоздь связан с цинком, 5 - в воде, но гвоздь связан с медью.
Вопросы: 1) что произошло с гвоздем в каждом стакане?
2) по каким причинам это произошло?
В 1 стакане процесс коррозии прошел сильно, так как вода является агрессивной средой; 2 ст. – коррозия прошла еще сильнее (чем в 1 стакане) по причине наличия более агрессивных хлорид-ионов; 3 ст. – процесс не заметен, так как гидроксид-ионы замедляют коррозию; 4 ст. – наблюдаем разрушение цинка металла, а сам гвоздь при этом не прокорродировал; 5 ст. – медь не изменилась, а гвоздь подвергся процессу коррозии.
Вопросы: 1) что произошло? 2) почему в стаканах различные продукты? 3) какую роль играет цинк? 4) почему произошло разрушение меди? 5) влияет ли среда на процесс коррозии?
Дать ответы на все эти вопросы вы сможете, познакомившись с текстом учебник на стр.229 (§37). Работаем по плану: определение, виды, сущность каждого вида коррозии (механизм); группы способов защиты в виде таблицы:
| Методы защиты | Принцип действия | Область применения |
Выводы: 1) наблюдали коррозию металла по электрохимическому механизму; 2) скорость процесса коррозии зависит от среды; 3) в качестве защиты можно использовать металлические покрытия из более активного металла. Механизм электрохимической коррозии:
К (+): 2H2O+O2+4ê→4OH - , 2H++2ê→H2, 4H++ O2+4ê→2H2O.
А (-): Men+ + nê→Me0 окисление IV. Самостоятельная работа по теме "Окислительно-восстановительные реакции" (12 мин).
I вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Co+ HNO3(конц) →...
2. На рисунке изображен разрез хромированного железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов.
 |
H2O (O2)
3. Разделите вещества HNO3, KClO4, H2O2, Mg, NH3 на три группы:
1 - проявляющие только окислительные свойства;
2 - проявляющие только восстановительные свойства;
3 - проявляющие как окислительные, так и восстановительные свойства.
4. При электролизе раствора КОН на катоде выделится:
а) водород; б) кислород; в) калий?
5. При электролизе раствора хлорида бария на аноде выделяется:
а) водород; б) хлор; в) кислород?
Остальные варианты – приложение 2.
V. Домашнее задание: закончить конспект по теме.
В данной главе подробно рассмотрены этапы формирования умений пользоваться химическим языком на теоретическом уровне. С целью осуществления методики на практике разработаны уроки, дающие возможность устранить формализм в знаниях учащихся.
Глава 3. Эксперимент по проверке эффективности предложенной методики на развитие личности учащихся 3.1. Организация, логика, этапы педагогического эксперимента
Основания задача эксперимента состояла в том, чтобы исследовать целесообразность и эффективность методики формирования умений пользоваться химическим языком в курсе общей химии. Данная задача направлена на развитие мышления и творчества учащихся, самостоятельной деятельности, является средством рационализации учебно-познавательного процесса.
В период 29 января-17 февраля 2007г. в средней школе № 8 г. Калуги под руководством учителя Григорьевой Л.Л. была применена разработанная нами методика на уроках химии в 11 "А" классе. За это время представилась возможность осуществить педагогический эксперимент, но проводить сравнение с другим 11 классом не было возможным, т. к. в школе всего один 11 класс. Изучение химии идет по программе Габриеляна О.С. и как таковую тему "ОВР" в учебнике 11 класса не предусмотрено, она разбита на отдельные уроки в темах: 1 – Классификация химических реакций; 2 – Металлы: а) Коррозия металлов; б) Способы получения металлов. Применение нашей методики не нарушило целостность образовательного процесса, так как учителя в праве менять до 20% учебного материала.
После изучения темы с учащимися мы провели анкетирование (приложение 3) с целью проверки результатов эффективности разработанной нами методики.
Педагогический эксперимент проводился в школе № 23 г. Калуги под руководством учителя В.Г. Бархударян. Подготовка к проведению эксперимента проводилась в два этапа.
На первом этапе были разработаны теоретические основы формирования умений, определена тема, при изучении которой будет проходить реализации методики. Было решено сделать 11 "Б" экспериментальным классом. Для проведения сравнительного эксперимента необходимо было выбрать контрольный класс, им стал 11 "А" класс, так как по составу учащихся он был близок к экспериментальному.
На втором этапе подготовки к проведению эксперимента тщательно изучена тема "Окислительно-восстановительные реакции", были составлены планы уроков для экспериментального класса (приведены в главе 2 выпускной работы), планы уроков для контрольного класса (представлены в приложении 4), а также составлен вариант самостоятельной работы для экспериментального и контрольного классов с целью проверки эффективности методики.
Эксперимент проводился с 13 ноября по 23 декабря 2006 г. в школе № 23 г. Калуги под наблюдением В.Г. Бархударян. Занятия проводились: в 11 "А" классе (контрольный) – по программе Габриеляна О.С., в 11 "Б" классе – с применением методики формирования умений. Сравнивались два варианта преподавания:
· первый вариант: контрольный, без использования специальной методики;
· второй вариант: экспериментальный, с применением методики формирования умений пользоваться химическим языком.
На заключительном уроке в обоих классах была проведена самостоятельная работа, выполнение которой показывает на успешное формирование знаний и умений пользоваться химическим языком. Работа проводилась в течение 15 минут и состояла из 4 вариантов, по 5 заданий в каждом варианте (рассмотрен в главе 2). Условия проведения были одинаковыми для всех классов. Оценивалась вся работа в целом, а также засекалось время, за которое учащиеся справлялись с заданием.
3.2. Интерпретация результатов педагогического эксперимента
С учащимися 11 класса школы № 8 мы провели анкетирование (приложение 3) с целью проверки результатов эффективности разработанной нами методики. Результаты:
| ответы | сложная | пришлось подумать | не очень сложная | вообще не сложная |
| % | 12 | 34 | 45 | 7 |
1 вопрос:
| ответы | они тянулись | как обычно | быстрее, чем раньше | быстро, незаметно |
| % | 7 | 3 | 33 | 57 |
2 вопрос:
| ответы | никак не помогут | иногда помогут | конечно помогут |
| % | 13 | 40 | 47 |
3 вопрос:
| ответы | нет | немного было | да |
| % | 24 | 32 | 44 |
4 вопрос:
Проанализировав самостоятельные работы учащихся 11 классов школы № 23 по содержанию, стало видно, что у учащихся экспериментального 11 "Б" класса записи были четкими, лаконичны, последовательны, ответы давались грамотным химическим языком, с использованием правил составления и преобразования, операций с химическими знаками. Можно сделать вывод формирование всей группы понятий в теме "ОВР", а также можно наблюдать прогнозирование на основе символики. Учащиеся контрольного 11 "А" класса успешно справились с заданием, но не прослеживалось особой четкости в записях, "ломанный" химический язык наблюдался практически во всех работах, большинство придерживалось образцов, рассмотренных на уроках, не проявляя своей инициативы.
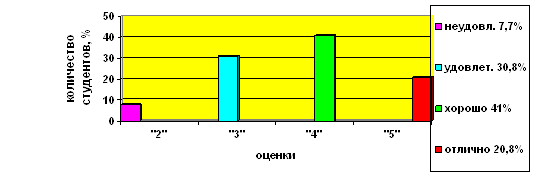
Результаты проверки решения самостоятельной работы приведены в таблице (таблица 4) и изображены в виде гистограммы (рис 1. – приложение 5).
Таблица 4.
| Класс | Всего учащихся | Писали работу | Оценки | |||
| 2 | 3 | 4 | 5 | |||
| 11 "А" (контрольный) | 20 | 20 | 2 | 6 | 8 | 4 |
| 11 "Б" (экспериментальный) | 18 | 18 | - | 2 | 9 | 7 |
Анкетирование с учащимися 11 класса 23 школы представлены 9.
На основании проведенного эксперимента в школах № 8 и № 23 можно сделать следующие выводы:
Степень сформированности групп умений пользоваться химическим языком в экспериментальном классе выше, чем в контрольном: об этом свидетельствует количество отличных оценок (приложение 6), а также само оформление работы.
У учащихся экспериментального класса знания систематизированные, четкие, построенные грамотным химическим языком. Отмечается моделирование вариантов записей, прогнозирование на основе химической символики. У учащихся контрольного класса такие показатели наблюдалось лишь у некоторых человек, остальным не удалось выполнить задания в полной мере, используя язык химической науки.
Сформированные умения пользоваться химическим языком позволяют рационализировать учебно-познавательный процесс, активизирует мышление учащихся, стимулируют развитие самостоятельной деятельности.
Заключение
В соответствии с поставленной целью выпускной работы – формирование умений пользоваться химическим языком – было сделано следующее:
Проанализировано состояние проблемы методики формирования умений пользоваться химическим языком в средней школе в трудах различных авторов и в практике школьного преподавания.
Выявлено, что умения пользоваться химическим языком являются рациональным компонентом учебно-познавательного процесса, стимулируя развитие мышления, творчества и самостоятельной деятельности учащихся.
Разработана конкретная методика формирования умений пользоваться химическим языком в 11 классе при изучении темы: "Окислительно-восстановительные реакции".
С целью оценки эффективности применения методики формирования у школьников умений в средней школе № 23 г. Калуги проведен сравнительный педагогический эксперимент, в школе № 8 применение методики.
Проанализированы результаты эксперимента: по времени выполнения заданий.
Решение этих задач, итоги эксперимента, беседа с учащимися и результаты выполнения ими работ – все это позволяет сделать общий вывод, что методика формирования умений повышает качество знаний учащихся, совершенствует их навыки в выполнении основных заданий по химии, способствует развитию творчества, самостоятельности, активной мыслительной деятельности, повышает интерес к предмету. Этот вывод подтверждает выдвинутую в начале работы гипотезу.
Список литературы
1. Александрова М.А. Урок "Электролиз растворов и расплавов солей" // Химия в школе. - 2005. - № 3 - с.61-66.
2. Алексинский В.Н. занимательные опыты по химии: Книга для учителей. – 2-е изд., испр. – М.: Просвещение, 1995. – 96 с.: ил.
3. Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. – 4-е изд., испр. – М.: Высш. шк.; 2002. – 743 с.: ил.
4. Ахлебинин А.К., Ахлебинина Т.В., Карпов В.А., Лазыкина Л.Г., Ларионова В.М., Лихачев В.Н., Майерли А.А., Нифантьев Э.Е., Чайков С.Г., "1С: Образовательная коллекция. Химия для всех – XXI: Химические опыты со взрывами и без". Мультимедийный компакт-диск с комплектом программ для поддержки школьного курса химии. "1С". 2002. – 283 МБ.
5. Балаев И.И. Домашний эксперимент по химии. Пособие для учителя. Из опыта работы. – М.: Просвещение, 1977. – 126 с.
6. Балуева Г.А., Осокина Д.Н. Все мы дома химики. – М.: Химия, 1979. – 128 с.: ил.
7. Герасимова Н.Ф., Смирнова Т.В., Супоницкая И.И. Опорный конспект в обобщении знаний о коррозии и защите металлов // Химия в школе. – 1997. - № 7 – с.40-42.
8. Герус С.А. Теория и практика рационализации процесса обучения химии в средней школе: Монография. – СПб.: Изд-во РГПУ им.А.И. Герцена, 2003. – 160 с.
9. Грибакина Л.В., Кузнецова Н.Е. О причинах формализма в знаниях учащихся // Химия в школе. - 1988. - № 6. – с.17-18.
10. Единый государственный экзамен 2001: Тестовые задания: Химия / М.Г. Минин, Н.С. Михайлова, В.Ф. Гридаев и др.: М-во образования РФ. - М.: Просвещение, 2001. – 47с.: ил.
11. Жуков С.Т. Аликберов Л.Ю. Окислительно-восстановительные реакции. Часть 5. Природа вещества и процессы окисления – восстановления // Химия в школе. – 2005. - №1 с.36-42.
12. Журин А.А. Окислительно-восстановительные реакции. – М.: Аквариум, 1998. – 256 с.
13. Кузнецова Л.М. Причины формализма в знаниях учащихся и пути его устранения // Химия в школе. – 1990. - № 3 – с.16-19.
14. Кузнецова Н.Е. Формирование систем понятий в обучении химии. – М.: Просвещение, 1989. – 144 с.: ил.
15. Кузнецова Н.Е. Шорова Ж.И. Изучение химического языка на первых этапе обучения // Химия в школе. – 1981. - № 5 – с.41-44.
16. Методика преподавания химии / Под ред. Н.Е. Кузнецовой. – М.: Просвещение, 1984. – 415 с.
17. Новые образовательные стандарты по химии // Химия: Методика преподавания. – 2004. - № 7 – с.3-8.
18. Ожегов С.И. Словарь русского языка: 70 000 слов/ Под ред.Н.Ю. Шведовой – 21-е изд., перераб. И доп. – М.: Рус. Яз., 1989. – 924 с.
19. Программы по химии для 8-11 классов общеобразовательных учреждений / Под ред. Н.Е. Кузнецовой. – М.: Вентана-Граф, 2006. – 128 с.
20. Программно-методические материалы. Химия: Средняя школа.8-11 кл. / Сост. С.В. Суматохин. - 4-е изд., перераб. И до. – М.: Дрофа, 2001. – 192 с.
21. Радаева О.В. Роль научного языка на уроках химии // Химия: Методика преподавания. – 2005. - №7 – с.27-29.
22. Рогожин О.В. развитие интеллектуальных умений школьников // Химия: Методика преподавания. – 2004. - №5 – с.43-47.
23. Степин Б.Д. Аликберова А.Ю. Занимательные задания и эффективные опыты по химии. – М.: Дрофа, 2002. – 432 с.: ил.
24. Суматохин С.В. О приоритетных направлениях развития общего химического образования и использование учебных заданий по химии в 2005/06 уч. году // Химия: Методика преподавания. – 2005. - №5 – с. 20-27.
25. Теория и практика интегративно-модульного обучения общей химии студентов медицинского вуза. / Т.Н. Литвинова. Краснодар: Издательство Кубанской государственной медицинской академии, 2001. – 265 с.
26. Химии: 11 класс: Учеб. Для общеобразовательных учреждений/ О.С. Габриелян Г.Г. Лысова. – 2-е изд., испр. – М.: Дрофа, 2002. – 368 с.: ил.
27. Химия: Учебник для учащихся 8 класса общеобразовательных учреждений / Кузнецова Н.Е., Титова И.М. и др. – 2-е изд., перераб. – М.: Вентана-Граф, 2005. - 224 с.: ил.
28. Химия: Учебник для учащихся 9 класса общеобразовательных учреждений / Кузнецова Н.Е., Титова И.М. и др. – М.: Вентана-Граф, 2005. - 234 с.: ил.
29. Химия: Учебник для учащихся 11 класса общеобразовательных учреждений в 2 частях / Кузнецова Н.Е., Левкина И.М. и др. – 2-е изд., перераб. – М.: Вентана-Граф, 2006. - 424 с.: ил.
30. Хомченко Г.П. Севастьянова К.И. Окислительно-восстановительные реакции: Книга для внеклассного чтения учащихся 8-10 кл. сред. Шк. – 3-е изд., перераб. – М.: Просвещение, 1989. – 141 с.
31. Шаповаленко С.Г. Методика обучения химии в восьмилетней и средней школе. – М.: Учпедгиз, 1963. – 667.
32. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. – 1983. - № 2 – с.33-34.
Приложение 1
Варианты самостоятельных работ к уроку №2. Тема: "Окислительно-восстановительные реакции".
II вариант 1. Дать определение понятию восстановитель, приведите примеры процесса.
2. Укажите коэффициент перед окислителем в реакции
Cu+ H2SO4(конц) →CuSO4+H2O+SO2:
а) 2; б) 3; в) 4; г) 1.
3. Сера проявляет восстановительные свойства в реакции:
а) Br2 + H2S → S + HBr; в) S+F2→SF6; б) SO2+Na2O→Na2SO3; г) Mg+ H2SO4→MgSO4+ H2O.
4. Сумма коэффициентов в уравнении реакции N2+H2↔NH3 составляет:
а) 3; б) 4; в) 6; г) 5.
5. Сильнее окислительные свойства будут выражены:
а) Cl1+; б) Cl1-; в) Cl3+; г) Cl5+.
6. Недостающим продуктом реакции Mg+HNO3(конц) = Mg(NO3) 2+…. +H2O является: а) NH4NO3; б) N2O; в) NO; г) NO2.
III вариант 1. Дать определение понятию "процесс окисления", приведите примеры.
2. Углерод НЕ проявляет восстановительные свойства в реакции:
а) C+H2 → CH4; в) MgO+ CO2→Mg+CO; б) FeO +CO→Fe+CO2; г) Al+C→Al4C3.
3. Укажите коэффициент перед восстановителем в реакции C+ H2SO4(конц) →CO2+H2O+SO2
а) 1; б) 2; в) 3; г) 4.
4. Сумма коэффициентов в уравнении реакции SO2+O2↔SO3 составляет:
а) 3; б) 4; в) 5; г) 6.
5. Сильнее окислительные свойства будут выражены:
а) S2 - ; б) S0; в) S2+; г) S4+.
6. Недостающим продуктом реакции S+ HNO3(конц) → SO2+ H2O+…является а) NO2; б) NO; в) N2; г) NH4NO3.
IV вариант 1. Дать определение понятию "восстановление", приведите примеры процесса.
2. Сера проявляет окислительные свойства в реакции:
а) О2 + H2S → SO2+ H2O; в) Mg + H2SO4→Mg SO4+ H2; б) S + H2→ H2S; г) Br2 + H2S → S + HBr.
3. Укажите коэффициент перед окислителем в реакции C+ HNO3(разб) → СO2+ H2O+ NO
а) 3; б) 4; в) 5; г) 6.
4. Сумма коэффициентов в уравнении реакции H2O→H2+O2 составляет:
а) 5; б) 4; в) 3; г) 2.
5. Сильнее восстановительные свойства будут выражены
а) Mn7+; б) Mn0; в) Mn2+; г) Mn4+.
6. Недостающим продуктом реакции Р+ HNO3(конц) → Р2O5+ H2O+…является а) NO2; б) NO; в) N2; г) NH4NO3.
ОТВЕТЫ
| № вопроса вариант | 2 | 3 | 4 | 5 | 6 |
| I | г | в | а | г | г |
| II | а | в | в | г | г |
| III | г | а | в | г | а |
| IV | б | б | а | б | а |
Приложение 2
Варианты самостоятельных работ к уроку №3. Тема: "Коррозия металлов".
II вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Р + H2SO4(конц) →…
2. На рисунке изображен разрез никелированного железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов.
H2O (O2)

3. Разделите вещества K2SO4, N2O, HCl, Zn, HBrO на три группы:
1 - проявляющие только окислительные свойства;
2 - проявляющие только восстановительные свойства;
3 - проявляющие как окислительные, так и восстановительные свойства.
4. При электролизе раствора NaОН на аноде выделяется:
а) натрий; б) кислород; в) водород?
5. При электролизе расплава хлорида ртути на катоде выделяется:
а) ртуть; б) хлор; в) кислород?
III вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Fe + HNO3(конц) → …
2. На рисунке изображен разрез луженого железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов.
H2O (O2)

3. Разделите вещества K2SO3, Li, HClO4, HNO2, K2Cr2O7 на три группы:
1 - проявляющие только окислительные свойства;
2 - проявляющие только восстановительные свойства;
3 - проявляющие как окислительные, так и восстановительные свойства.
4. При электролизе раствора Ba(ОН) 2 на аноде выделяется:
а) водород; б) кислород; в) барий?
5. При электролизе расплава хлорида свинца (II) на катоде выделяется:
а) свинец; б) хлор; в) процесс не возможен?
IV вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Hg + H2SO4(конц) →…
 |
2. На рисунке изображен разрез оцинкованного железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов.
H2O (O2)
3. Разделите вещества SO2, Fe, KMnO4, N2O3, CrO3 на три группы:
1 - проявляющие только окислительные свойства;
2 - проявляющие только восстановительные свойства;
3 - проявляющие как окислительные, так и восстановительные свойства.
4. При электролизе раствора Cu(NO3) 2 на катоде выделяется:
а) медь; б) кислород; в) водород?
5. При электролизе раствора хлорида алюминия алюминий выделяется:
а) на катоде; б) на аноде; в) остается в растворе?
ОТВЕТЫ
| Вариант № задания | I | II | III | IV |
| 4 | а | б | б | а |
| 5 | б | а | а | в |
Приложение 3
Вопросы анкеты для учащихся:
1. На сколько сложной для изучения вам показалась данная тема?
2. Быстро ли проходили уроки?
3. Как вы считаете, полученные вами знания помогут вам в дальнейшем при изучении предмета?
4. Появилось ли у вас желание самостоятельно составлять уравнения ОВР?
Приложение 4
Разработка планов уроков для контрольного класса (по учебнику О.С. Габриеляна).
Урок № 1.
Тема: "Классификация химических реакций"
Цель: обобщить и расширить представление учащихся о классификации химических реакций.
Оборудование: сера, спиртовка, зажим, кристаллизатор с водой, магний, щипцы,, H2SO4, BaCl2, H2O2, MnO2, мультимедийные проектор, диск, компьютер.
Тип урока: обобщение и систематизация знаний.
Ход урока:
Организация класса.
Изучение нового материала.
Учащиеся самостоятельно по учебнику (§ 11, стр.100-111) заполняют таблицу (25 мин)"Классификация химических реакций".
| Признак классификации | Типы реакций | Определение типов реакций | Примеры |
В конце урока учитель демонстрирует опыты, учащиеся классифицируют реакции по шести признакам, записанным в таблице:
1. переход кристаллической серы в пластическую;
2. горение магния;
3. разложение малахита;
4. взаимодействие раствора иодида калия с хлорной водой;
5. взаимодействие раствора серной кислоты с хлоридом бария;
6. разложение пероксида водорода под действием оксида марганца (IV).
7. взаимодействие меди с концентрированным раствором азотной кислоты.
Рассмотрение метода электронного баланса (на примере последней реакции):
![]()
![]() Cu + HNO3(конц) = Cu(NO3) 2+ NO2 +H2O
Cu + HNO3(конц) = Cu(NO3) 2+ NO2 +H2O
1 2 Cu0 - 2ê → Cu2+процесс окисления, медь – восстановитель 2 N5+ + ê → N4+процесс восстановления, кислота – окислитель Cu + 4HNO3(конц) = Cu(NO3) 2+ 2NO2 +2H2O.
Итоги урока.
Домашнее задание: § 11, упр.1,6.
Урок № 2.
Тема: "Коррозия металлов".
Цель: актуализировать, расширить и углубить знания учащихся о коррозии металлов.
Оборудование: образцы "чистого" и ржавого железа, металлических изделий, защищенных от коррозии покрытиями.
Тип урока: комбинированный.
Ход урока:
Организация класса.
Проверка домашнего задания (5-7 мин).
Самостоятельная работа: составить 5 уравнений реакций металла с разными классами веществ. Работа выполняется по вариантам: I – натрий, II – цинк, III – алюминий, IV – железо.
Изучение нового материала.
Прочитайте о коррозии в учебнике на стр. 208-210. Выпишите определение коррозии.
Запишите классификацию видов коррозии по характеру воздействия на металлическую поверхность и по химизму.
Запишите примеры химической коррозии. в какой среде она происходит?
Запишите, в какой среде происходит электрохимическая коррозия.
Далее учитель объясняет, что электрохимическая коррозия при контакте двух металлов, это приводит к образованию гальванической пары, в которой более активный металл отдает свой электроны менее активному и разрушается: Fe0 - 2ê → Fe2+, а на поверхности менее активного металла идет восстановление в кислой среде: 2H+ +2ê → H2 ↑;
в нейтральной среде или щелочной: 2H2O + 2ê→ 2OH - + H2 ↑.
Поэтому в нейтральной и щелочной среде образуется гидроксиды железа Fe2+ + 2OH - → Fe(OH) 2; 4 Fe(OH) 2 + 2H2O + O2 → 4Fe(OH) 3;
Fe(OH) 3 → FeO(OH) + H2O.
В кислой среде ржавчина не образуется, ионы металла переходят в раствор: Fe0 + 2H+ → Fe2+ + H2 ↑.
ИТОГИ УРОКА
IV. Домашнее задание: § 18 стр. 208-214. Выписать в тетрадь способы защиты от коррозии, упр.16-20.
| Методы защиты | Принцип действия | Область применения |
Урок № 3.
Тема: "Способы получения металлов".
Цель: актуализировать и обобщить знания учащихся о способах получения металлов.
Оборудование: коллекция "Руды металлов".
Тип урока: комбинированный.
Ход урока:
Организация класса.
Проверка домашнего задания (10-12 мин).
Ученик у доски заполняет таблицу о способах защиты металла. В это время проводится устный опрос класса по вопросам:
Что такое коррозия?
Какие виды коррозии вы знаете? Приведите примеры.
Какова сущность основных видов коррозии?
Изучение нового материала (20 мин).
Прочитайте учебник на стр.214-216 и сделайте записи по плану:
определение металлургии; 2) способы получения, сущность процессов, примеры.
Электролиз - окислительно-восстановительная реакция, протекающая под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита.
Что такое электролиты? Почему электролиты являются участниками электролиза?
электролиз расплавоврастворов Правила определения продуктов электролиза расплавов и растворов электролитов (схемы представлены на каждого ученика).
I. Катодные процессы
электрохимический ряд напряжений металлов Li Rb K Ba Ca Na Mg Mn Zn Cr Fe Pb Cu Hg Ag Pt Au
восстановление H2Oвосстановление H2O и восстановление H2O + 2ê →H2 +2OH - металла Men+ + nê→Me0 металла усиление окислительных свойств катионов II. Анодные процессы
анионы
бескислородсодержащиекислородсодержащие галогенид-ионы OH - , NO3-, SO42-
Похожие работы
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... заключается во взаимной нейтрализации положительных и отрицательных зарядов мельчайших частичек вещества. На основе разработанной им теории Берцелиус сделал принципиально важный вывод: все химические элементы состоят из отрицательных и положительных веществ. Созданная на основе этих представлений дуалистическая модель явилась попыткой рассмотреть химическое родство как стремление к уравниванию ...
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
... , а в адрес нерадивых учителей, которые находят множество причин для исключения реального эксперимента из своей практики. Эта статья представляет электронное издание «Виртуальная химическая лаборатория для 8-11 классов», разработанное в Лаборатории систем мультимедиа МарГТУ. При создании данного ППС разработчики попытались реализовать основные идеи современной концепции сотворчества ученика и ...


0 комментариев