Навигация
ЗАПИШИТЕ РЕЗУЛЬТАТЫ в лабораторный журнал
1. ЗАПИШИТЕ РЕЗУЛЬТАТЫ в лабораторный журнал
2. Покажите журнал преподавателю
ЗАНЯТИЕ 6 «ОКИСЛЕНИЕ-ВОССТАНОВЛЕНИЕ»
Опыт с диоксидом серы продемонстрировал нам одну из многочисленных окислительно-восстановительных реакций. В таких реакциях атомы одних веществ присоединяют электроны, а других – отдают электроны. Первые носят название окислителей (перманганат калия), вторые – восстановителей (диоксид серы).
Поставим еще несколько опытов с окислением-восстановлением.
На свежий срез картофеля капните разбавленной иодной
настойкой: появится синяя окраска. Это крахмал, содержащийся в картофеле, синеет в присутствии свободного иода. Такую реакцию часто используют для того, чтобы обнаружить крахмал, значит, это тоже качественная реакция.
На то же место, куда вы капнули иодную настойку, налейте немного раствора сульфита натрия. Окраска быстро исчезнет. Произошло вот что: сульфит отдал свободному иоду электрон, тот стал электрически заряженным, превратился в ион, а в таком состоянии иод уже не реагирует с крахмалом.
Такое свойство сульфита натрия, как и диоксида серы, означает, что эти вещества – хорошие восстановители. Вот еще любопытный опыт с сульфитом. Его компаньоном-окислителем вновь будет перманганат калия.
В четыре пробирки налейте бледно-розовый, розовый, светло-фиолетовый и темно-фиолетовый растворы марганцовки. В каждую пробирку добавьте раствор сульфита натрия. Содержимое первой пробирки станет почти бесцветным, второй – буроватым. В третьей пробирке выпадут бурые хлопья, в четвертой тоже, но осадка будет намного больше. Во всех пробирках образуется твердый оксид марганца МпО2. Но во-первых, двух пробирках он существует в виде коллоидного раствора (твердые частицы настолько малы, что раствор кажется прозрачным). А в остальных двух пробирках концентрация МпО2 настолько велика, что частицы слипаются и выпадают в осадок.
Вообще марганцовка напоминает химического хамелеона – так она умеет менять свой цвет. Например, в щелочной среде раствор перманганата калия из красно-фиолетового становится зеленым, потому что перманганат восстанавливается до зеленого манганата. Чтобы проверить это, бросьте в раствор щелочи – в концентрированный прокипяченный раствор стиральной соды – кристаллик марганцовки, и вместо привычного розового окрашивания появится зеленое.
Этот опыт. получается еще красивее, когда работают с едким натром. Поставьте опыт так: налейте в тонкостенный стакан немного красного раствора марганцовки (он должен быть прозрачным) и очень небольшими порциями, чтобы реакционная смесь не разогревалась, добавляйте достаточно концентрированный раствор едкого натра. Наблюдайте за цветом жидкости – сначала он будет становиться все более фиолетовым, затем, по мере увеличения щелочности, синим и, наконец, зеленым.
Смена окраски особенно отчетливо видна в проходящем свете. В любом случае освещение должно быть хорошим, без этого переходы оттенков можно и не заметить.
Следующий опыт поможет вам отличить грязную воду от чистой. Одну пробирку наполните чистой водой, другую – водой из застоявшейся лужи или из болота. Добавьте в пробирки немного раствора окислителя – перманганата калия. В водопроводной воде он станет розовым, в воде из лужи – обесцветится. В теплую погоду в стоячей воде скапливаются органические вещества. Они, как и сульфит натрия, восстанавливают перманганат калия, меняют его окраску.
Последний опыт на тему "окисление-восстановление" мы оставим с соединениями хрома. Такие опыты часто бывают красочными, что не удивительно, так как "хромое" по-гречески означает "цвет".
Так, возьмите немного желтого раствора хромата калия К2СгО4, это вещество широко применяют в технике в качестве окислителя, например для очистки сильно загрязненных деталей; обращаться с ним надо аккуратно. Если добавить в желтый раствор немного серной кислоты (осторожно! лить кислоту медленно!), то он станет красным. В такой подкисленный раствор бросьте несколько кусочков цинка. Если у вас нет гранулированного цинка, с которым обычно ставят опыты, то добудьте цинк самостоятельно, из негодной батарейки: металлические стаканчики в элементах питания – цинковые.
Итак, вы бросили в стакан с раствором немного цинка, и хромат, восстанавливаясь, меняет цвет на темно-зеленый. Это образовались ионы Сг3+. Одновременно благодаря реакции цинка с кислотой выделяется газ – водород. Если продукты реакции не окисляются кислородом воздуха, то реакция будет идти и дальше, причем появится голубая окраска – такой цвет у раствора сульфата хрома СгSО4. Перелейте его в другой стакан; пока вы будете это делать, произойдет окисление, и раствор опять станет зеленым.
1. ЗАПИШИТЕ РЕЗУЛЬТАТЫ в лабораторный журнал
2. Покажите журнал преподавателю
ЗАНЯТИЕ №7 «АДСОРБЦИЯ»
С физико-химическим явлением, о котором сейчас пойдет речь, знаком, наверное, каждый, хотя, может быть, не все знают, что оно называется адсорбцией. Если даже вы и не проходили адсорбцию на уроках, наблюдали вы ее неоднократно. Как только вы сажаете чернильную кляксу на бумагу или, что гораздо хуже, на одежду, так сразу и знакомитесь с этим явлением. Когда поверхность одного вещества (бумаги, ткани и т. д.) поглощает частицы другого вещества (чернил и проч.), это и есть адсорбция.
Очень хороший адсорбент – уголь. Причем не каменный, а древесный, и не просто древесный, а активный (активированный). Такой уголь продают в аптеках, обычно в виде таблеток. С него и начнем опыты по адсорбции.
Приготовьте бледный раствор чернил любого цвета и налейте в пробирку, но не доверху. Положите в пробирку таблетку активного угля, лучше растолченного, закройте пальцем и встряхните как следует. Раствор посветлеет на глазах. Поменяйте раствор на какой-либо другой, но тоже окрашенный – пусть это будет разбавленная гуашь или акварель. Эффект окажется таким же. А если взять просто кусочки древесного угля, то они будут поглощать краситель значительно слабее.
В этом нет ничего странного: активный уголь отличается от обычного тем, что у него гораздо большая поверхность. Его частицы буквально пронизаны порами (для этого уголь особым способом обрабатывают и удаляют из него примеси). А коль скоро адсорбция – это поглощение поверхностью, то ясно: чем больше поверхность, тем и поглощение лучше.
Адсорбенты способны поглощать вещества не только из растворов Возьмите пол-литровую стеклянную банку и капните на дно одну каплю одеколона или любого другого пахучего вещества. Обхватите банку ладонями и подержите ее так с полминуты, чтобы немного нагреть пахучую жидкость – тогда она будет быстрее испаряться и сильнее пахнуть. Как принято в химии, не нюхайте вещество прямо из склянки, а легкими взмахами руки направьте к носу воздух вместе с парами летучего вещества: не всегда ведь известно, хорошо ли пахнет то вещество, которое в склянке.
Каким бы ни был запах, вы его, конечно, почувствуете явственно. А теперь положите в склянку немного активного угля, закройте ее плотно крышкой и оставьте на несколько минут. Снимите крышку и вновь направьте воздух к себе взмахами ладони. Запах исчез. Он поглотился адсорбентом, или, точнее, поглотились молекулы летучего вещества, которое вы поместили в банку.
Не обязательно брать для этих опытов активный уголь. Есть много других веществ, которые могут служить адсорбентами: туф, сухая размолотая глина, мел, промокательная бумага, Словом, самые разные вещества, но обязательно с развитой поверхностью, В том числе и некоторые пищевые продукты – вы, наверное, знаете, как легко хлеб впитывает посторонние запахи. Недаром пшеничный хлеб не советуют держать в одной упаковке со ржаным – их запахи смешиваются, и каждый теряет свой особый, только ему присущий аромат.
Очень хороший адсорбент – воздушная кукуруза, или кукурузные палочки, столь любимые многими из нас. Конечно, тратить на опыт пакет или даже четверть пакета нет смысла, но несколько штук... Попробуем. Предыдущий опыт с пахучими веществами повторите в присутствии кукурузных палочек – и запах совершенно исчезнет. Конечно, после опыта есть палочки уже нельзя,
Вернемся к опыту с получением диоксида углерода (углекислого газа). Заполните этим газом две пробирки, причем в одну положите кукурузные палочки и встряхните несколько раз. Далее, как и прежде, проделайте опыт с известковой водой (можно просто "наливать" в нее газ из пробирок – он тяжелее воздуха). Будет ли разница в поведении известковой воды? Да, будет. Жидкость станет мутной только в том стакане, в который "вылили" газ, не обработанный адсорбентом. А из другой пробирки, той, где были кукурузные палочки, диоксида углерода не извлечь: его поглотил адсорбент.
Сейчас на многих кухнях над газовыми плитами ставят разнообразные устройства для очистки воздуха от чада и дыма. В таких устройствах, помимо прочего, есть патрон с каким-либо адсорбентом, через который прогоняют загрязненный воздух. Что при этом происходит, вы теперь знаете. А когда вся поверхность будет занята посторонними, "впитанными" из воздуха частицами, патрон заменяют свежим.
1. ЗАПИШИТЕ РЕЗУЛЬТАТЫ в лабораторный журнал
2. Покажите журнал преподавателю
ЗАНЯТИЯ 8- 10 «УЧЕБНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА УЧАЩИХСЯ»
ЛИТЕРАТУРА
1. Ольгин О. Опыты без взрывов. Изд. 3-е – М.: Химия, 1993. – 144 с.: ил. (Научно-популярная библиотека школьника)
2. Оржековский П. А., Давыдов В. Н., Титов Н. А. Экспериментальные творческие задачи по неорганической химии: Книга для учащихся. (Методическая библиотека.) – М.: АРКТИ, 1998. – 48 с. Ил.
3. Пичугина Г. В. Повторяем химию на примерах из повседневной жизни. Сборник заданий для старшеклассников и абитуриентов с ответами и решениями. – М.:АРКТИ, 1999. – 136 с.: ил. (методическая библиотека).
4. Сурин Ю. В. Методика проведения проблемных опытов по химии: Развивающий эксперимент. – М.: Школа-Пресс, 1998. – 144 с. («Химия в школе». Библиотека журнала. Вып. 2).
5. Малышкина В. Занимательная химия. – С-Пб.:Тригон, 1998 – 576 с., ил.
6. Леенсон И. А. 100 вопросов и ответов по химии: Материалы для школьных рефератов, факультативных занятий и семинаров: Учеб. Пособие. /И. А. Леенсон. – М.ООО «Издательство АСТ»: ООО «Издательство Астрель», 2002. – 347 с.: ил.
ПРИЛОЖЕНИЕ
Оборудование ХИМИЧЕСКОЙ ЛАБОРАТОРИИ из подручных средств
Оборудование собственной лаборатории, если взяться за него всерьез, тоже поучительное занятие. Если при слове "лаборатория" вы представили себе просторную комнату с вытяжным шкафом, стеклянными приборами, печами, насосами и высоченными шкафами, доверху набитыми посудой и реактивами, – то вы в данном случае ошиблись. Речь идет об уголке комнаты, не обязательно жилой, в котором можно поставить небольшой столик и повесить над ним полку. Но прежде чем устраивать лабораторию, выполните два требования. Первое: точно решите для себя, хотите ли вы серьезно заниматься химическими опытами, хватит ли у вас терпения тщательно их ставить, не смущает ли вас подготовка к опытам и такие скучные занятия, как уборка и мытье грязной посуды. Если вы сознательно идете на все это, то остается второе требование: получить согласие старших. Будем надеяться, что ваша твердая убежденность возымеет действие.
Начнем с устройства рабочего места.
Рабочий стол желательно поставить поближе к окну, чтобы освещение было хорошим; к тому же если работать возле окна, то легче проветривать помещение. Если у окна места нет, позаботьтесь об электрическом освещении. В любом случае имейте в виду, что нельзя ставить опыты в полутемном помещении!
Как бы аккуратно вы ни работали, на стол могут попасть брызги растворов, просыпаться порошки. Во избежание неприятностей, чтобы уберечь стол, положите на него лист линолеума, или толстую фанеру, или прессованный картон. В крайнем случае, можно обойтись и обычной клеенкой либо полиэтиленовой пленкой. Если стол не отдан полностью в ваше распоряжение, сделать это совершенно необходимо. Вдобавок не помешает поставить на стол еще и поддон – например, большую фотографическую кювету, которую легко можно вымыть после опыта. Между прочим, и стол после работы нужно протереть влажной тряпкой, а затем вытереть насухо.
Очень удобно, если над столом можно повесить полку или шкафчик и держать в них все необходимое для опытов, Если же это невыполнимо, то все равно держите посуду и реактивы в одном месте, недалеко от рабочего стола. Ни в коем случае не разбрасывайте их по комнате!
Обзаведитесь, пожалуйста, плотным фартуком, лучше всего клеенчатым, Нам придется иногда иметь дело с едкими веществами, и фартук предохранит вашу одежду. В аптеке или хозяйственном магазине купите пару резиновых перчаток, пригодятся для некоторых опытов.
Теперь поговорим о посуде. Конечно, лучше всего было бы обзавестись настоящими пробирками, колбами, химическими стаканами и тиглями. Однако далеко не всегда это выполнимо. Но выход из положения найдется; надо использовать то, что есть под рукой.
Пробирки проще всего заменить тонкостенными стеклянными ампулами из-под таблеток. Поскольку дно у них плоское, нагревать их на открытом пламени нельзя, а вот. водяную баню они выдерживают. Для проведения опытов и для хранения веществ, годятся также флакончики из-под пенициллина, стрептомицина и других лекарств. На первых порах понадобится не более десяти таких самодельных пробирок.
Иногда пробирки приходится нагревать, и, конечно, их при этом нельзя держать голыми руками. Лучшего держателя для пробирок, чем деревянная бельевая прищепка, нам, пожалуй, не найти, Для удобства прищепку можно удлинить, прикрепив к, одной из ее развилок палочку или кусок толстой проволоки. Из : толстой мягкой проволоки нетрудно сделать держатель, но не забудьте надеть на 'тот конец, за который вы будете браться рукой, кусок резинового шланга или обмотайте его изоляционной лентой.
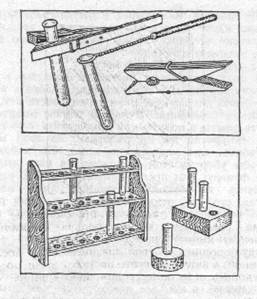
Специальный штатив для большинства опытов не требуется, но полезно сделать штатив-подставку для пробирок, чтобы не держать их долго в руках. Самый простой штатив – это брусок, в котором просверлены (не насквозь) отверстия диаметром чуть большим, чем диаметр пробирок.
Химической посудой могут служить также разнообразные флаконы и банки из-под лекарств, которые закрываются обычно полиэтиленовыми пробками. Такие пробки очень удобны, потому что они стандартны и подходят ко многим склянкам. Но главное – полиэтилен химически стоек, он не разрушается даже под действием концентрированных растворов кислот и многих органических растворителей, и поэтому во флаконах с полиэтиленовыми пробками можно хранить и такие реактивы, от которых со временем разрушаются резиновые пробки, Между прочим, когда количество реагирующих веществ невелико, крышки и пробки тоже можно использовать для опытов.
Стеклянная тара от пищевых продуктов – майонезные банки, бутылки, стеклянные банки из-под варенья и компота – годится для хранения реактивов и для некоторых опытов. Помните, что посуду из толстостенного стекла нельзя нагревать – она может лопнуть. В описаниях опытов мы будем советовать, какую посуду лучше взять. Если же посуда не оговорена, значит, годится любая склянка, которая есть под рукой.
Какую бы посуду для хранения веществ вы ни выбрали, она должна быть плотно закрыта, и к ней обязательно надо приклеить этикетку. Самая простая этикетка – из лейкопластыря. Он легко приклеивается к сухому стеклу, на нем удобно писать шариковой ручкой: когда запись поблекнет, ее нетрудно подновить.
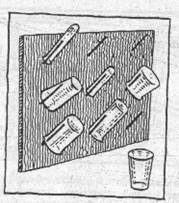
Можно сделать и бумажную этикетку, приклеив ее казеиновым канцелярским клеем, а чтобы она дольше держалась, ее надо закрыть прозрачной липкой лентой. Можно также подписывать посуду специальным маркером, который предназначен для надписи на большинстве поверхностей.
Всю посуду перед использованием (и после каждого использования) необходимо тщательно мыть; если посуда грязная, ее моют стиральным порошком с помощью ершика, а потом еще несколько раз чистой водой.
Посуда должна храниться только чистой. Ее надо мыть сразу после опыта (это, кстати, и легче, потому что через час-другой грязь может так пристать к стенкам, что насилу отмоешь), Вымытую посуду лучше сушить так, чтобы вода легко стекала с нее. Можно изготовить для этого нехитрую сушилку: вбить в толстый лист фанеры длинные гвозди, чтобы они пробили лист насквозь и ушли в него по самую шляпку, отогнуть торчащие из фанеры гвозди вверх под углом примерно, 45' и обмотать их изоляционной лентой, чтобы не поцарапаться (или надеть резиновые трубки). На всякий случай не помешает затупить напильником острия гвоздей. Это и есть сушилка. Ее надо повесить на стену и поставить внизу поддон, чтобы вода, стекая с пробирок и склянок, надетых на гвозди, не капала на стол или на пол,
Иногда по ходу опыта необходимо прокалить какое-либо вещество. Для этого есть специальная фарфоровая посуда, но можно обойтись и без нее. Выручат тщательно вымытые жестяные баночки из-под гуталина или вазелина. А если вещества немного, воспользуйтесь столовой или даже чайной ложкой из нержавеющей стали. Конечно, для еды эта ложка уже не годится, Точно так же, как бутылки, банки и прочая посуда, которую вы взяли для опытов.
Лучше, наверное, будет купить специально одну-две стальные ложки для своей лаборатории. Они годятся не только для прокаливания, но могут и заменить шпатели, которыми набирают вещества для опытов. Если же опыт проводят в пробирке, то можно обойтись и без шпателя: порошки набирают большей частью прямо в сухую пробирку.
Теперь немного о фильтрах. Они будут нужны очень часто.
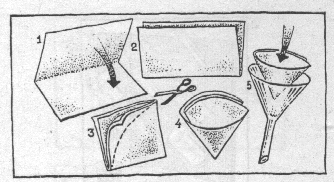
В описаниях опытов вам то и дело будут попадаться советы: профильтровать жидкость, отделить осадок от раствора. Иногда, правда, можно обойтись без фильтрования. Если осадок достаточно тяжелый, ему дают осесть, а жидкость сливают с него в чистый стакан по стеклянной палочке (этот прием называется декантацией). Но чаще приходится все же фильтровать, а для этого надо уметь делать бумажные фильтры. Для этого нужна специальная бумага, не пропитанная клеем. Она так и называется – фильтровальная. Все с ней хорошо знакомы, даже первоклассники – это обычная промокашка.
Чтобы сделать фильтр, надо приготовить квадратный кусок фильтровальной бумаги, сложить его пополам и еще раз пополам, а потом обрезать края так, чтобы при развертывании получился круг. Такой сложенный вчетверо листок надо раздвинуть, чтобы образовался конус. Половина этого конуса будет из одного слоя бумаги, другая половина – из трех слоев.
Другой фильтр немного посложнее – складчатый. Для него вырезают из бумаги круг и складывают его многократно, чтобы получилась гармошка. Через такие складки жидкость фильтруется быстрее, но тяжелый осадок может этот фильтр прорвать; он годится только для легких, хлопьевидных осадков или для крупных кристаллов.
Какой бы фильтр вы ни взяли, его надо положить в воронку – стеклянную (химическую) или пластмассовую, которую продают в хозяйственных магазинах. Он должен плотно прилегать к воронке и не доходить до ее края на несколько миллиметров. Перед работой фильтр смачивают растворителем (как правило, водой; мы чаще всего будем иметь дело с водными растворами), затем осторожно льют жидкость с осадком. Фильтрование требует терпения, потому что жидкость через промокательную бумагу проходит медленно. Но ни в коем случае не отрывайте носик фильтра – вся работа пойдет насмарку. !иногда можно фильтровать через ткань или несколько слоев марли – это несколько скорее, но не так эффективно. В описаниях опытов будет сказано, через какой материал можно фильтровать без ущерба для дела. Если же особых замечаний по этому поводу вы не обнаружите, то фильтруйте через бумажный фильтр.
Во многих опытах реагирующие вещества необходимо
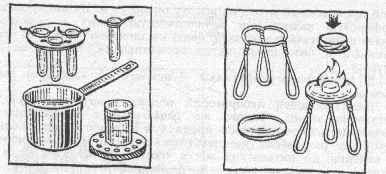
нагревать. Если требуется температура не выше 100'С, то удобнее всего (да и безопаснее) пользоваться водяной баней. Ею может служить любая кастрюля (лучше с ручкой) или просто широкая консервная банка, в которую налита вода. Воду нагревают до требуемой температуры, скажем, до кипения, ставят в нее пробирку или склянку с реакционной смесью, а чтобы пробирка не упала, делают какое-либо приспособление. Например, обматывают пробирку проволокой так, чтобы проволочные концы торчали вроде усов, и эти усы кладут на край кастрюльки. Или делают крышку из фанеры так, чтобы она могла лежать на кастрюле, а в крышке просверливают отверстие для пробирок и закрепляют их проволочными усами, только совсем короткими.
Когда вещество нагревают в стакане, то крышка не нужна, Стакан ставят в водяную баню, но не прямо на дно (так он может перегреться), а на подставку из фанеры или куска дерева. В подставке желательно прорезать отверстия, чтобы вода могла циркулировать. А чтобы дерево не всплывало, подставка должна плотно прилегать к стенкам бани,
Наливать много воды не надо – достаточно, если стакан или пробирка будут погружены в воду наполовину. По мере выкипания воду надо понемногу доливать.
Водяную баню можно нагревать на газовой или электрической плите либо на закрытой электроплитке (пожалуйста, помните об аккуратности в работе!). Если же надо нагревать вещества на открытом пламени до более высоких температур, то лучше пользоваться горелкой с "сухим спиртом", таблетки которого продают в хозяйственных и спортивных магазинах, – таким сухим горючим часто пользуются туристы. Таблетки горючего дают ровное и жаркое пламя. Сжигать их надо на специально сделанном таганке. Его можно изготовить из толстой стальной проволоки в виде треноги и положить сверху жестяную крышку с загнутыми краями, например от стеклянной консервной банки; на этой крышке и поджигают таблетку. Приготовьте и жестяной колпачок, например маленькую консервную банку, которым вы будете гасить пламя: накройте колпачком горящую таблетку, воздух перестанет к ней поступать, и пламя погаснет.
Еще один способ нагревания до высокой температуры песочная баня. В небольшую сковородку насыпьте ровным слоем сухой прокаленный песок на высоту около 2 см. На песок поставьте фарфоровую чашку или металлическую банку с реакционной смесью и нагревайте песочную баню на электроплитке. Это старый, надежный и безопасный метод прокаливания, хотя и не очень быстрый.
В заключение этой главы – немного об измерении масс и объемов.
Для домашней лаборатории подойдут аптечные весы, они достаточно точны. Что же касается измерения объемов, то для этой цели можно использовать аптечную мензурку – стеклянную рюмочку с делениями – или мерный стакан. В крайнем случае, можно воспользоваться мерной бутылочкой, из которой кормят через соску младенцев.
ОБРАЗЦЫ ИССЛЕДОВАТЕЛЬСКИХ ПРОЕКТОВ
О некоторых особенностях роста кристаллов NaCl Алексей Лохов, Андрей Пальянов Руководитель: П.В. Денисенко 8 класс школы-колледжа 130, г. Новосибирск 1996 AННОТАЦИЯВ докладе рассказывается об образовании и росте нового типа плавающих кристаллов NaCI и сопутствующих этому явлению эффектах, как-то: образование соляных колец при высыхании капель раствора NaCI, рост дендритов по горизонтальной и вертикальной плоскостям.
ВВЕДЕНИЕПроблемой образования колец при высыхании капель растворов солей занимались ещё в 19 веке. В 1882 Лизеганг обнаружил, что при высыхании капли 20% раствора AgNО3 на поверхности, покрытой слоем смеси желатина и К2Сr2О7 образуется система концентрических колец, которые состоят из продукта реакции AgNO3 и K2Cr2O7 - бихромата серебра [5]. Проблемой образования плавающих кристаллов занимался Д.И.Менделеев, который их обнаружил и описал их форму: полые четырехгранные пирамидки, плавающие вершиной вниз. Ещё одно известное наблюдение - на месте высохшей капли AgCI образуются несколько концентрических колец. Рисунок 1 объяснит их образование [3].
По краям выпадают кристаллы, но по мере высыхания капли её объем уменьшается, и она висит на кристаллах. В какой-то момент капля с них срывается и собирается в каплю, но меньшего диаметра. Этот процесс повторяется несколько раз до того момента, когда вся вода испарится.
Рассмотрев несколько высохших капель раствора NaCl, мы увидели одну и ту же картину (рис. 2): несколько кристаллов находится в центре капли, соляное кольцо по периметру и дендритные структуры за пределами капли. Кристаллы в центре и некоторые кристаллы из соляного кольца имеют характерный крестик.
Рассмотрев процесс высыхания капли, мы заметили следующее: кристаллы образуются на поверхности раствора, а потом часть из них, находящаяся близко к краю, сползает к границе капли, и в процессе роста образуется соляное кольцо, а остальные опускаются вслед за понижающимся уровнем раствора и ложатся на дно. Рассмотрев такой кристалл под микроскопом, мы увидели, что он представляет из себя плавающую пирамидку Менделеева.
После этого мы решили подробнее рассмотреть процесс образования пирамидок. Известно ( [1], [2] ), что растворимость NaCI мало зависит от температуры, т.е. плотность раствора, насыщенного при 15 градусах равна плотности раствора, насыщенного при 20 градусах. Это означает, что поверхностный слой раствора может концентрацию большую, нежели сам раствор. По словам Д.И.Менделеева, эти кристаллы не тонут, т.к. постоянно доращиваются при опускании (рис. 4):
ЭКСПЕРИМЕНТМы повторили опыт Менделеева: взяли сосуд с раствором, имеющем концентрацию, близкую к максимальной, и поместили над ним на расстоянии 20 см настольную лампу (лампочка 100 Вт). При температуре 22 градуса и влажности 50% мы получили менделеевские кристаллы. Но они образуются не всегда. Если поставить колбу с раствором в закрытый объём при почти 100% влажности, то образуются другие кристаллы, имеющие форму кубиков со срезанной верхней вершиной и ориентированные другой вершинкой вниз ( рис. 5 ):
Обычно они собираются в группы по 7-40 штук, а потом, достигнув размеров грани каждого кристалла 3-4мм, падают на дно. Кристаллы со срезанной вершинкой образовывались иногда и на дне сосуда, т.к. первоначально были ориентированы вершинкой вверх, а не боком (см. рис 6).
Впоследствии мы обнаружили наличие плавающих кристаллов для растворов других солей, например раствор AIK(SO4)2*12Н2О образует на поверхности одиночные кристаллы. Наоборот, при увеличении скорости испарения поверхность раствора покрывалась сплошной соляной коркой, которая состоит из сросшихся пирамидок Менделеева ( рис. 7 ):
При проведении опытов с кристаллами на поверхности мы заметили, что на стенках сосудов образуются дендриты, которые иногда даже "вылезали" наружу и росли по внешней стенке. Между дендритами и раствором находится полоса свободного пространства, покрытая тонкой пленкой раствора ( рис. 8 ):
Если поместить у основания растущего дендрита каплю концентрированного раствора NaCI, подкрашенную тушью, то она начинает подниматься по дендриту, показывая путь "строительного материала" ( рис. 9 ):
Как выяснили Хлуднева Евгения и Лапина Люба, строительный материал доставляется к вершине в основном по капиллярам внутри дендритов. Если же подкрашенную каплю поместить в центр высыхающей капли, то мы видим такую картину: из капли туши вытянулись тонкие лучи. Это следы сползающих плавающих кристаллов и потоков раствора к растущим дендритам.
РЕЗУЛЬТАТЫРезультатом проделанной работы явилось:
1. Обнаружение нового типа плавающих кристаллов, описание которого мы в литературе не нашли.
2. Установление возможности роста дендритов по вертикальной плоскости, описание чего мы также в литературе не нашли.
БЛАГОДАРНОСТИ
Благодарим нашего консультанта Денисенко П.В., Хлудневу Евгению и Лапину Любовь за предоставленные результаты, В.И. Шелеста за помошь в редактировании отчета.
СПИСОК ЛИТЕРАТУРЫ
1. Кузнецов "Кристаллы и кристаллография"
2. Менделеев Д.И. "Общая химия"
3. Гегузин "Капля"
4. Реми "Неорганическая химия"
5. Шубников А.В. "Зарождение и рост кристаллов"
vlad@ssl.nsu.ru
ГИМНАЗИЯ №1 ИМЕНИ В. И. ЛЕНИНА
УЧЕБНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ТЕМЕ:
“ИССЛЕДОВАНИЕ МОЮЩЕГО ДЕЙСТВИЯ СТИРАЛЬНЫХ ПОРОШКОВ С ОТБЕЛИВАЮЩИМ ЭФФЕКТОМ ДЛЯ АВТОМАТИЧЕСКИХ СТИРАЛЬНЫХ МАШИН”
Выполнил ученик 8Э КЛАССА Ахметов Данил
Научный руководитель:
Ахметов Марат Анварович
www.maratakm.narod.ru
Ульяновск 2004 год
Пояснительная записка.
В настоящих время существует огромный выбор стиральных порошков и других моющих средств. Наше внимание было обращено на группу стиральных порошков, предназначенных для использования в автоматических стиральных машинах для стирки белого белья (постельное белье, рубашки, блузки и т. п.). Основная проблема, с которой сталкиваются хозяйки – это постепенная потеря привлекательного вида таких изделий, связанная с появлением желтоватого и сероватого оттенка у этих изделий, что негативно отражается на их внешнем виде. Интерес подогревался еще и тем, что существует достаточно жесткая конкуренция между производителями стиральных порошков, и как говорится, на слуху, и на виду у многих телевизионная реклама, знакомящая с уникальными возможностями тех или иных стиральных порошков.
1. ИССЛЕДОВАНИЕ УПАКОВКИ ПОРОШКА[2]
Нами было проведено исследование стиральных порошков следующих производителей: Procter & Gamble (ARIEL, TIDE, МИФ), Sorti (BIMAX, SORTI), Невская косметика (SARMA), Хенкель (ПЕМОС).
1. УПАКОВКА. Практически все производители выпускают порошки в картонной коробке (более удобная упаковка) и в пакетах (более дешевая упаковка).
2. ЦЕНА. Цена порошка колеблется от 8,33 (ARIEL) до 3,5 (ПЕМОС) рублей за 100 г порошка, что примерно составляет стоимость одной стирки 4 кг белья в мягкой воде
3. ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА (ПАВ). Стиральные порошки ARIEL и ТIDЕ содержат все типы ПАВ (анионные, катионные и неионогенные). МИФ содержит неионогенные и анионные ПАВ. Все остальные порошки содержат только анионные ПАВ. Анионные ПАВ наиболее распространенные и наиболее дешевые типы ПАВ. Добавление небольшого количества катионных и неионогенных ПАВ должно увеличивать диапазон действия порошка.
4. ОТБЕЛИВАТЕЛИ. Все порошки содержат кислородсодержащие отбеливатели, обычно это перборат натрия NaBO3∙H2O2∙3H2O и оптические отбеливатели (вещества, увеличивающие светоотражающую способность ткани)
5. ЭНЗИМЫ (ферменты или биологические катализаторы) способствуют разрушению и удалению белковых загрязнений (пятен крови и т. д.). Действуют при температуре до 60 0С, так как белок составляющий структуру фермента при более высокой температуре денатурирует (разрушается). Включены в состав всех исследованных синтетических моющих средств (СМС), кроме SARMы и ПЕМОСа.
6. ФОСФАТЫ И ЦЕОЛИТЫ служат цели смягчения воды. Фосфаты, попадая в сточные воды, способствуют росту сине-зеленых водорослей (цветение воды в водоемах), поэтому с точки зрения экологии оптимальным смягчителями воды являются цеолиты, хотя они увеличивают стоимость СМС. Единственный порошок, в состав которого входят цеолиты, наряду с фосфатами – это ARIEL.
7. Поликарбоксилаты (КМЦ) препятствуют повторному осаждению грязи на ткани. Входят в состав всех порошков.
8. Фософонаты (пеногасители) входят в состав практически всех порошков
9. Силикаты и карбонаты способствуют понижению кислотности моющего раствора за счет гидролиза солей. Также смягчают воду.
10. Сульфат натрия. Связывает избыток влаги Na2SO4 + 10H2O = Na2SO4∙10H2O
Похожие работы
... данным программным продуктом (это можно найти в руководстве по его применению), а лишь хотим показать возможность использования его при изучении химии. Реакции, сопровождающиеся взрывом, практически невозможно продемонстрировать в школе, но здесь к нам на помощь опять приходит пакет MultiVision. Он позволяет не только самим создавать мультфильмы, но и дает возможность монтировать видеофильмы из ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
. одновременно всем классом, что в значительной степени затрудняет контроль за выполнением правил техники безопасности. Лабораторные работы проделывав ют учащиеся в порядке получения новых знаний и освоения навыков. Они повторяют действия учителя, показывающего, как нужно правильно выполнять работу, Практические работы выполняют учащиеся после прохождения соответствующего раздела курса. При этом ...
... ,информация же полученная экспертами в лабораторных условиях, способна внести ясность в суть дела и ответить на широкий круг вопросов и разрешение которых будет способствовать раскрытию преступления, связанного с противоправным взрывом. Но это утверждение является истинным только при условии правильной фиксации и изъятия следов взрыва, и последовательности назначения той или иной экспертизы. ...







0 комментариев