Навигация
Характеристика твердых отходов процесса хромирования
1.2 Характеристика твердых отходов процесса хромирования
В работе анализировались методы определения твердо-жидких отходов гальванических производств с целью оценки качественного состава твердых отходов техпроцесса хромирование. Характеристика технологического процесса приведена в Приложении.
Отходы хранятся на территории цехов в закрытых металлических емкостях по 50 кг каждая. По статистическим данным на КАПО им. С.П. Горбунова за год образуется в среднем 10 т твердых гальванических отходов в год. (Данные не уточняются ввиду того, что отходы с основных ванн технологических процессов не сортируются).
1.3 Хром, его физические и химические свойства, хромирование
Хром – серебристый с голубоватым отливом металл. Атомный вес его 52, удельный вес 7,1 г/см3, температура плавления 1830 оС, электрохимический эквивалент 0,323 г/а-ч, нормальный потенциал 0,55 в.
Благодаря склонности к пассивации хром длительное время сохраняет блеск. Он стоек во влажной атмосфере, к действию щелочей, органических кислот, серы, серной и азотной кислот.
В гальванической паре с железом хром является катодом, несмотря на более электроотрицательный потенциал.
Пассивная пленка, покрывающая хром, сдвигает его потенциал в положительную сторону, а значительная пористость хромовых покрытий вызывает необходимость создания подслоя для защиты стальных изделий.
Хром обладает рядом ценных качеств. Кроме упомянутой уже химической стойкости и способности длительное время сохранять блеск, хрому свойственна высокая твердость, низкий коэффициент трения, значительная жаростойкость. Эти свойства хромовых покрытий делают гальваническое хромирование весьма распространенным видом покрытия, которое практически нельзя заменить другим.
Основные области применения хрома – декоративная защита, повышение износостойкости трущихся деталей, поршневых колец и цилиндров, мерительного и режущего инструмента, коррозионно-стойкие комбинированные покрытия.
Декоративные хромовые покрытия осаждают на предварительно никелированные или омедненные и никелированные покрытия.
Разработаны электролиты, позволяющие непосредственно на стали получать малопористые хромовые покрытия, обладающие защитными и декоративными свойствами. Технология получения комбинированного двухслойного хрома позволяет сочетать в покрытии коррозионно-стойкие и защитные функции.
Хромовые осадки отличаются высокими внутренними напряжениями, поэтому на хромовых покрытиях уже при толщине слоя 0,1 мк образуется сетка мелких трещин. При увеличении толщины хромового покрытия старые трещины перекрываются вновь образовавшимися.
В зависимости от условий хромирования сеть трещин может быть различной. Это свойство хромовых покрытий используют для предания деталям антифрикционных свойств, а также для создания новой технологии получения комбинированного защитно-декоративного никель-хромового покрытия. Хромовые покрытия в 5-8 раз повышают износостойкость стали. Самой высокой износостойкостью отличаются матовые хромовые покрытия, самой низкой – блестящие.
Наибольшее влияние на твердость хромовых покрытий имеет режим электролиза – температура электролита и применяемая плотность тока.
2. Методы определения
Наиболее удовлетворительными методами определения хрома являются колориметрические и объемный. Объемный метод основан на окисление хрома до хромата, прибавление избыточного количества сульфата железа (II) и титрование избытка последнего перманганатом. Колориметрический метод пригоден для определения малых количеств хрома, какие обычно содержаться в горных породах. При значительном содержании хрома, когда колориметрические методы не применимы, пользуются объемным методом.
2.1 Титрование сульфатом железа(II) и перманганатом
По нашим данным, наиболее удовлетворительный метод определения хрома заключается в окислении хрома до хромата, введение в раствор отмеренного количества сульфата железа (II) и оттитровывании избытка последнего перманганатом или бихроматом калия. Окисление хрома можно осуществлять в процессе сплавления или соответствующей обработкой кислого раствора. Оба эти метода нашли практическое применение.
Сплавлением с карбонатом натрия и нитратом калия пользуются при определении малых количеств хрома; когда определяют большие количества хрома, лучше применять сплавление с перекисью натрия. В кислом растворе хром можно окислить двуокисью свинца, хлоратом калия, перманганатом калия и персульфатом калия или аммония в присутствии нитрата серебра.
Из этих методов наилучшим является последний. Ниже приводится его подробное описание.
В персульфатном методе присутствие нитрата серебра имеет существенное значение для полного окисления хрома. Нитрат серебра вводят в горячий кислый раствор перед прибавлением персульфата так, чтобы его содержание было не меньше, чем содержание хрома. При чрезмерно высокой концентрации кислоты в растворе достигнуть полного окисления хрома не удается. Наиболее благоприятными условиями является содержание 5-6 мл серной и 1 мл азотной кислот в 100 мл раствора. В присутствии железа и вольфрама целесообразно вводить 3-5 мл сиропообразной фосфорной кислоты, так как она удерживает вольфрам в растворе и, кроме того, обесцвечивая желтую окраску железа (III), делает конечную точку титрования более отчетливой.
Для окисления применяют свежеприготовленный раствор персульфата 95%-ной чистоты. Во всех случаях анализируемый раствор следует кипятить 8-10 минут, чтобы обеспечить полное окисление хрома и разложение избытка персульфата. Марганец при этом окисляется до перманганата или двуокиси марганца, которые также необходимо разрушить до прибавления сульфата железа (II). Для этого, после разложения персульфата кипячением, на каждые 300 мл раствора прибавляют по 5 мл разбавленной (1:3) соляной кислоты и продолжают кипятить до восстановления окисленных соединений марганца, после чего кипятят еще 5 минут для удаления хлора. Если до прибавления соляной кислоты персульфат был полностью разрушен, хромовая кислота при этой обработке не восстанавливается.
Большие количества хрома наиболее целесообразно восстанавливать взвешанным количеством однородных кристаллов соли Мора FeSO4(NH4)2SO4*6H2O. В случае же, когда содержание хрома невелико и особенно когда приходится одновременно проводить большое число определений, удобнее пользоваться разбавленным сернокислым раствором этой соли. В присутствии значительных количеств хрома определение конца титрования несколько затрудняется вследствие зеленой окраски раствора, но соответствующая поправка для конечной точки определяется легко. Все реакции протекают стехиометрически; следовательно, можно пользоваться теоретическими титрами, установленными по оксалату натрия.
Ванадий и мышьяк не мешают титрованию, так как они хотя и восстанавливаются сульфатом железа (II), но затем снова окисляются эквивалентным количеством перманганата. Небольшие количества вольфрама изменяют окраску раствора в точке эквивалентности, но не влияют на результаты титрования. Если содержание вольфрама настолько велико, что конечная точка титрования становится неотчетливой, его лучше предварительно отделить, а хром, захваченный осадком вольфрама, определить отдельно. Никель, кобальт, молибден и уран не оказывают влияния на титрование.
Ход определения. Раствор, полученный после разложения пробы с плавлением или другим способом, свободный от хлорид-ионов и содержащий приблизительно 15-18 мл серной кислоты и 3 мл азотной кислоты в общем объеме 300 мл, нагревают до кипения. Прибавляют 2,5%-ный раствор нитрата серебра в количестве, соответствующем 0,01 г соли на каждую 0,01 г находящегося в растворе хрома. Нагревают до кипения и приливают 20 мл свежеприготовленного 10%-ного раствора персульфата аммония. Кипятят 10 минут и затем, если образуется перманганат или окислы марганца, вводят 5 мл 5%-ного раствора хлорида натрия или 5 мл разбавленной (1:3) соляной кислоты, снова нагревают до кипения и после восстановления соединении марганца продолжают кипятить еще 5 минут. Если при этом марганец не восстанавливается, вводят еще некоторое количество хлорида натрия или соляной кислоты и снова кипятят.
После охлаждения раствора прибавляют отмеренное избыточное количество раствора соли Мора или взвешенное количество этой соли и затем титруют раствором перманганата, титр которого установлен по оксалату натрия. По окончании титрования отмечают израсходованное количество перманганата, нагревают раствор до кипения для разрушения избытка перманганата, охлаждают до комнатной температуры и затем снова титруют перманганатом до появления окраски такой же интенсивности, как при первом титровании. Израсходованный в этом случае объем перманганата вычитают из объема раствора, израсходованного при первом титровании. Полученную разность умножают на количество соли Мора, эквивалентное 1мл раствора перманганата. Это произведение вычитают из введенного количества соли Мора и затем вычисляют содержание хрома, исходя из соотношения 3Fe:1Cr.
Для установления соотношения между солью Мора и перманганатом приготавливают раствор из такого же количества соли, какое было введено в анализируемый раствор; приготовленный раствор должен иметь такой же объем и такую же кислотность, как анализируемый раствор в момент титрования. Приготовленный раствор титруют перманганатом. Из израсходованного объема раствора перманганата вычитают количество его, которое требуется для окрашивания раствора в точке эквивалентности.
При выполнении массовых анализов после сплавления с перекисью натрия нет необходимости окислять хром персульфатом. В этом случае плав растворяют в 200 мл воды, прибавляют 1г перекиси натрия и сильно кипятят до разложения перекиси (приблизительно 10 минут). Фильтруют через асбест и промывают осадок горячей водой, следя за тем, чтобы он все время был влажным. Фильтрат и промывные воды подкисляют серной кислотой и затем вводят сульфат железа (II). При этом следует избегать введения в раствор органических веществ, (что происходит, например, при фильтровании через бумагу), так как это приводит к получению пониженных результатов для хрома. Эта ошибка обусловлена не восстановлением хромата, как можно было бы предположить, а восстановлением перманганата в процессе титрования.
Легкость, с которой можно осуществить потенциометрическое титрование хрома, применяя соответствующую аппаратуру, характеризуется следующим ходом анализа. В охлажденный до 20С разбавленный сернокислый раствор, содержащий хром (+6), погружают каломельный и платиновый электроды; пучок лучей, отраженных зеркальным гальванометром, устанавливают вблизи левого края шкалы. Затем в раствор постепенно вводят титрованный раствор сульфата железа (II), пока пучок лучей не начнет непрерывно передвигаться вправо. После этого прибавляют эквивалентный титрованный раствор хромата калия до прекращения перемещения пучка лучей влево. Снова вводят раствор сульфата железа (II), пока опять не начнется перемещение вправо. Вычитают израсходованный объем раствора хромата из введенного объема сульфата железа и вычисляют содержание хрома, исходя из соотношения 1Cr:3Fe. Ванадий также восстанавливается железом (II) и учитывается совместно с хромом. Вольфрам не влияет на титрование.
Похожие работы
... . На поверхность печатных форм наносят тончайшее покрытие Cr, Ni, Co. Наиболее прочным является хромовое покрытие, далее рассмотрим его свойства. электрохимия осаждение хром полиграфия 2. Общие сведения о хроме Хром – элемент 6-й группы периодической системы элементов Д.И. Менделеева. Его атомный номер 24, атомная масса 51,99. Физические свойства хрома следующие: температура плавления 1890 ...
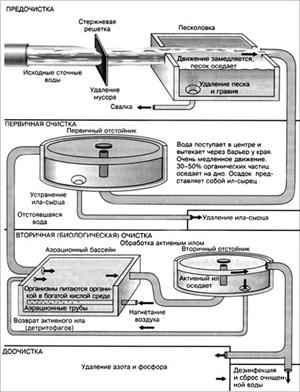
... состоит анализируемое вещество и какие ионы, группы атомов или молекулы входят в его состав. При исследовании состава неизвестного вещества качественный анализ всегда предшествует количественному, так как выбор метода количественного определения составных частей анализируемого вещества зависит от данных, полученных при его качественном анализе. Качественный химический анализ большей частью ...
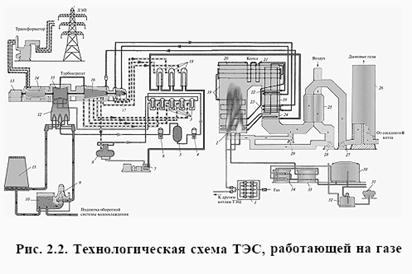
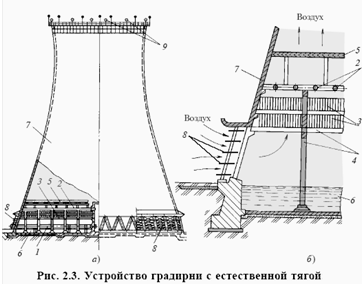
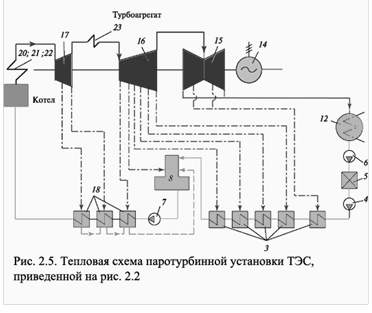
... Пример тепловой схемы рассмотренной ТЭС приведен на рис. 2.5. При этом для более легкой идентификации мы сохранили одинаковые номера для одинакового оборудования. Глава 2. ИЗВЛЕЧЕНИЕ ХРОМА ИЗ ВОДЫ, ИСПОЛЬЗУЕМОЙ В ГРАДИРНЯХ Во многих промышленных процессах приходится отводить большие количества тепла. Для этой цели в качестве теплоносителя обычно применяют воду, циркулирующую в системе. ...
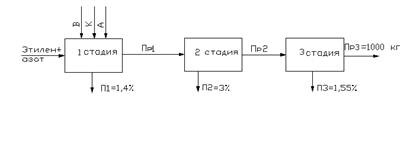
... труб, пленок, листов, моноволокна, тонко- и толстостенных изделий различного габарита (сиденья, ведра, бачки, контейнеры). 2.2 Характеристика сырья [3] Характеристика основного сырья приведена в таблице 2.1. Таблица2.1 Характеристика основного сырья Наименование сырья, материалов и полупродуктов Государственный или отраслевой стандарт, технические условия, регламент или методика на ...

0 комментариев