Навигация
Опишите процесс электрохимической коррозии при контакте металла и изделия из Sn во влажной среде (Без аэрации и при аэрации)
10.4. Опишите процесс электрохимической коррозии при контакте металла и изделия из Sn во влажной среде (Без аэрации и при аэрации).
Решение.
Если включения олова в цинк имеют значительные размеры, то мы будем иметь дело с гальваническим элементом.
Поскольку электродные потенциалы для олова и цинка равны:
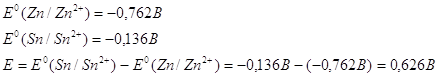
Мы будем иметь гальванический элемент в котором цинк будет более активным металлом по сравнению с оловом, что приведет к его окислению.
Рассмотрим случай, когда мы имеем включения олова в цинк во влажной атмосфере без аэрации. Отсутствие аэрации означает отсутствие активного кислорода, который может вступать в электрохимические взаимодействия.
На скорость коррозии цинка будет также влиять наличие оксидной пленки на поверхности цинка.
Олово будет оказывать на цинк поляризирующее влияние, что приведет к тому, что цинк (потенциал которого меньше) будет поляризироваться анодно и скорость его коррозии возрастет.
На аноде будет проходить реакция: ![]() .
.
На катоде, в роли которого выступает олово, будет протекать реакция: ![]() . В результате реакции будет выделяться водород. Ионы гидроксила будут взаимодействовать с ионами цинка и в результате мы получим гидроксид цинка.
. В результате реакции будет выделяться водород. Ионы гидроксила будут взаимодействовать с ионами цинка и в результате мы получим гидроксид цинка.
![]()
Рассмотрим процесс коррозии при аэрации. Наличие аэрации означает доступ кислорода к контакту двух металлов.
На аноде будет проходить реакция: ![]() .
.
На катоде, в роли которого выступает олово, будет протекать реакция: ![]() . В результате реакции мы получим ионы гидроксила. Ионы гидроксила будут взаимодействовать с ионами цинка и в результате мы получим гидроксид цинка.
. В результате реакции мы получим ионы гидроксила. Ионы гидроксила будут взаимодействовать с ионами цинка и в результате мы получим гидроксид цинка.
![]()
Процесс коррозии при аэрации проходит более активно чем без аэрации, поэтому такой вид коррозии будет более опасен для цинковых деталей чем коррозия без доступа воздуха.
10.5. Опишите процесс электролиза с учетом перенапряжения.
Электролит – раствор ZnCl2 PH= 2, 5
Электроды: катод – С,
анод – Zn.
Решение.
В растворе хлорид цинка будет диссоциировать на ионы согласно уравнения:
![]()
Рассмотрим процессы, которые будут происходить на аноде.
Анод цинковый. На цинковом аноде могут происходить несколько процесов:
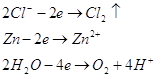
Запишем потенциалы прохождения указанных процессов:
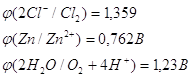
Перенапряжение выделения кислорода на цинковом электроде при плотности тока 1мА/см2 равно 1,75 В. Это значит, что кислород данной реакции выделятся не будет и на аноде возможны только две электрохимические реакции:
![]()
Как видно из значений электродных потенциалов на аноде будет происходить реакция окисления цинка: ![]() , потенциал которой будет ниже чем потенциал восстановления хлора. Мы будем иметь дело с рафинированием цинка.
, потенциал которой будет ниже чем потенциал восстановления хлора. Мы будем иметь дело с рафинированием цинка.
Рассмотрим электродные процессы на катоде. Материал катода – уголь или графит, катод инертен и не будет брать участия в электрохимических процессах. На катоде также возможны несколько реакций, рассмотрим их. РН среды равно 2,5. На графите при температуре 20ºС перенапряжение выделения водорода при плотности тока 1 А/см2 равно 1,2 В, а при плотности тока 1 мА/см2 всего лишь 0,6 В. За уравнением Нернста мы можем вычислить значение потенциала перенапряжения водорода при РН=2,5. потенциал водородного электрода находится в линейной зависимости от РН среды.
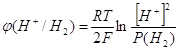
При давлении водорода 1 атмосфера ![]() , и при РН=2,5 мы получим перенапряжение равное:
, и при РН=2,5 мы получим перенапряжение равное: ![]()
При плотности тока равной 1 А/см2 перенапряжение равно: ![]() а при плотности тока 1 мА/см2
а при плотности тока 1 мА/см2 ![]() .
.
Ионы же цинка восстанавливаются при потенциале равном - 0,763 В. Перенапряжением восстановления ионов цинка на графитовом электроде можно пренебречь, поскольку оно довольно мало по значению. Из полученных расчетов видно что при малых плотностях тока на графитовом электроде возможны две конкурирующие реакции:
![]()
При плотности тока ![]() на катоде будет выделятся водород по уравнению
на катоде будет выделятся водород по уравнению ![]() , поскольку потенциал восстановления водорода будет равен
, поскольку потенциал восстановления водорода будет равен ![]() , что больше потенциала восстановления цинка . При плотности тока
, что больше потенциала восстановления цинка . При плотности тока ![]() будут происходить конкурирующие реакции:
будут происходить конкурирующие реакции:
![]()
При этих условиях потенциал восстановления водорода равен около ![]() . При плотности тока равной 1 А/см2 перенапряжение равно:
. При плотности тока равной 1 А/см2 перенапряжение равно: ![]() , при этих условиях мы можем вести выделение цинка из раствора по уравнению:
, при этих условиях мы можем вести выделение цинка из раствора по уравнению: ![]() . Тогда водород на электродах выделяться не будет.
. Тогда водород на электродах выделяться не будет.
При проведении электролиза надо учитывать повешение температуры, при повышении температуры на 1ºС перенапряжение уменьшается на 2 – 3 мВ. Оно также зависит от вида поверхности электрода и от наличия некоторых органических добавок в электролите.
Список использованной литературы.
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Полеес М. Э. Аналитическая химия. – М.: Медицина, 1981. – 286 с.
3. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
4. Мороз А. С., Ковальова А. Г. Физическая и коллоидная химия. – Л. : Мир, 1994. – 278 с.
5. Физическая химия. Практическое и теоретическое руководство. Под ред. Б. П. Никольского, Л.: Химия, 1987. – 875 с.
6. Скуг Д., Уэст Д. Основы аналитической химии. В 2 т. Пер с англ. М.: Мир, 1979, - 438 с.
7. Натарова Н. Г. Аналитическая химия цинка. – М.: Химия, 1982. – 378 с.
Похожие работы
... а и b очень близки. В отражённом свете хлорофилл, кажется вишнёво-красным, так как он излучает поглощённый свет с изменением длины его волны. Это свойство хлорофилла называется флюоресценцией. Биосинтез хлорофилла Исходными для синтеза хлорофилла субстратами являются очень простые органические соединения – ацетат и глицин. Процесс синтеза хлорофилла принято подразделять на три этапа. ...
... ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая. 2.Химические свойства По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ...
... 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий. Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ...
... из цинка. Значительна роль этого элемента в полиграфии. Из цинка делают клише, позволяющие воспроизвести в печати рисунки и фотографии. Специально приготовленный и обработанный типографский цинк воспринимает фотоизображение. Это изображение в нужных местах защищают краской, и будущее клише протравливают кислотой. Изображение приобретает рельефность, опытные граверы подчищают его, делают ...


0 комментариев